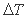 ) в экспериментах вырос с - 10 до - 72°С [1, 2]. Считается, что капли воды в верхних слоях атмосферы переохлаждаются также на величину, близкую к 70°С.
) в экспериментах вырос с - 10 до - 72°С [1, 2]. Считается, что капли воды в верхних слоях атмосферы переохлаждаются также на величину, близкую к 70°С. Переход жидкого состояния в кристаллическое при охлаждении может осуществляться, как известно, двумя путями - путем инициированной кристаллизации, вызванной наличием каких-либо затравок, при температуре плавления, и путем спонтанной кристаллизации переохлажденного расплава, связанной с гомогенным зародышеобразованием. Однако вопрос о том, существует ли предельная величина переохлаждения расплава для определенного вещества, до сих пор считается открытым. Более того, если исходить из широко распространенного взгляда на гомогенное зародышеобразование как на флуктуационный, случайный процесс, то понятие предельного переохлаждения вообще лишается смысла. Если говорить о переохлаждении воды, то за период с 1724 года, когда Фаренгейт впервые наблюдал это явление, до второй половины двадцатого столетия температурный интервал переохлаждения (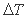 ) в экспериментах вырос с - 10 до - 72°С [1, 2]. Считается, что капли воды в верхних слоях атмосферы переохлаждаются также на величину, близкую к 70°С.
) в экспериментах вырос с - 10 до - 72°С [1, 2]. Считается, что капли воды в верхних слоях атмосферы переохлаждаются также на величину, близкую к 70°С.
По современным представлениям, основанным на учении Гиббса о химическом потенциале [3], кристаллическое и жидкое состояния вещества термодинамически равноправны лишь при температуре плавления. Выше этой температуры устойчиво только жидкое состояние, ниже - только кристаллическое. Этим обосновывается термодинамическая неизбежность процесса кристаллизации расплава и, соответственно, "незаконность" жидкого состояния ниже точки плавления. Но поскольку, несмотря на якобы термодинамическую обусловленность перехода жидкого состояния в твердое, кристаллизация без вмешательства посторонних факторов не идет, то причину этого традиционно связывают с силами поверхностного натяжения расплава, препятствующими процессу гомогенного зародышеобразования. В работе [2], посвященной проблеме спонтанной кристаллизации расплавов, по этому поводу говорится, что появление новой фазы в однородной системе невозможно при отсутствии затравки или "слабых" мест. Кристаллизация при незначительном переохлаждении обусловлена гетерогенным зародышеобразованием. По мере же углубления в область метастабильных состояний повышается вероятность возникновения флуктуационным путем жизнеспособного зародыша и в "чистой" системе [2, стр. 6].
В основе описанных представлений лежат, как мы видим, две посылки: то, что кристаллическое и жидкое состояния при температуре плавления энергетически одинаково выгодны, и то, что для образования зародыша необходимо преодоление барьера, связанного с поверхностной энергией расплава.
Эти утверждения, однако, не являются бесспорными и их нельзя безоговорочно принимать в качестве аргументов, объясняющих причину переохлаждения. Во-первых, постулат об одинаковой энергетической выгодности жидкого и кристаллического состояний при температуре плавления требует корректировки. Эти состояния действительно могут существовать при одной и той же температуре, но энергетически они никак не являются равноправными. Это однозначно следует из того, что жидкое и кристаллическое состояния вещества при температуре плавления энергетически различаются на величину удельной теплоты плавления.
Второй постулат - о необходимости при зародышеобразовании преодоления барьера, связанного с поверхностной энергией расплава, - также не бесспорен. Когда анализируется процесс плавления, то в этом случае энергетическим критерием перехода кристаллического состояния в жидкое является только удельная теплота плавления. Никакая дополнительная энергия для образования поверхности жидкого зародыша в кристаллической среде здесь не рассматривается. И это естественно. Все энергетические затраты, необходимые для перевода системы из одного состояния в другое, входят в изменение энтальпии системы (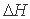 ), которое по величине равно тепловой энергии (
), которое по величине равно тепловой энергии (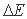 ), подведенной к системе из внешней среды
), подведенной к системе из внешней среды
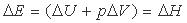 (1)
(1)
С аналогичных позиций, т.е. с позиций теплообмена, необходимо анализировать и процессы, связанные с охлаждением и спонтанной кристаллизацией расплавов, что было предложено нами ранее [4,5] и что легло в основу настоящего доклада.
В процессе плавления подводимое тепло (см. рис.) практически не дает прироста температуры из-за резко возрастающей теплоемкости, стремящейся к бесконечности. Теплоемкость же расплава много меньше теплоемкости плавящегося твердого тела. Вследствие этого температурная кривая обратного хода располагается ниже кривой прямого хода. После полного отвода удельной теплоты плавления начинается спонтанная кристаллизация, сопровождающаяся подъемом температуры.
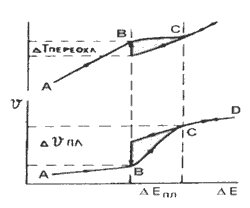
Рис. Характер изменения температуры и удельного объема в зависимости от тепловой энергии, подводимой к твердому телу и отводимой от расплава.
Максимальное переохлаждение расплава, т.е. интервал от температуры плавления до начала спонтанной кристаллизации (при квазистатическом охлаждении) можно оценить, зная теплоемкость расплава в окрестности температуры плавления и теплоту плавления:
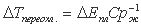 (2)
(2)
Справедливость этого вывода подтверждается экспериментальными данными по переохлаждению расплавов различных металлов , а также воды.
Теплота плавления льда - 5980 Дж/моль, теплоемкость воды при температуре 273 К - 75,9 Дж/моль К. Экстраполяция значений теплоемкости в область переохлажденного состояния дает среднюю теплоемкость воды 77 9 Дж/моль К. Отсюда максимальное переохлаждение воды
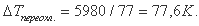
Близость максимальных значений 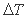 , полученных в экспериментах и вычисленных на основании термодинамических данных, позволяет заключить, что температура начала спонтанной кристаллизации расплава - это физическая константа для каждого индивидуального вещества. Именно она является истинной температурой начала кристаллизации расплава. В связи с этим нельзя не привести высказывание Дж. Бернала по поводу спонтанной кристаллизации. Он писал, что если бы "точка спонтанного образования центров кристаллизации существовала у всех жидкостей, то ее следовало бы рассматривать как значительно более фундаментальную физическую характеристику жидкостей, чем точка плавления обычных кристаллов" [6, стр. 159]. Результаты проведенного анализа дают право утверждать, что такая точка действительно существует и имеет под собой строгое термодинамическое обоснование.
, полученных в экспериментах и вычисленных на основании термодинамических данных, позволяет заключить, что температура начала спонтанной кристаллизации расплава - это физическая константа для каждого индивидуального вещества. Именно она является истинной температурой начала кристаллизации расплава. В связи с этим нельзя не привести высказывание Дж. Бернала по поводу спонтанной кристаллизации. Он писал, что если бы "точка спонтанного образования центров кристаллизации существовала у всех жидкостей, то ее следовало бы рассматривать как значительно более фундаментальную физическую характеристику жидкостей, чем точка плавления обычных кристаллов" [6, стр. 159]. Результаты проведенного анализа дают право утверждать, что такая точка действительно существует и имеет под собой строгое термодинамическое обоснование.
Литература
© 2003 Горох Алексей Васильевич
По всем вопросам обращайтесь: E-mail: gor@konstant.ac.donetsk.ua