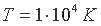 число ионизированных атомов составляет меньше 10% от общего числа атомов, а при температуре
число ионизированных атомов составляет меньше 10% от общего числа атомов, а при температуре 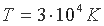 практически все атомы ионизированы.
практически все атомы ионизированы.В систематиках животных и растений, горных пород и минералов, в географической систематике ландшафтов и т.п. всегда проявляются признаки общности происхождения систематизируемых объектов, независимо от принципов, заложенных в основу систематики. В периодической системе химических элементов Д.И. Менделеева генетических признаков в явном виде не просматривается, хотя Менделеев указывал, что "периодическая законность... открывает новые горизонты зрения на химические эволюции" [1]. Вслед за Менделеевым и другие ученые неоднократно подчеркивали, что периодическую систему нельзя рассматривать как нечто обособленное, только как способ систематики элементов, что она является отображением более глубоких закономерностей, и скорее всего закономерностей генетического характера. Наиболее последовательно идею связи периодической системы с генезисом химических элементов проводили в своих работах Крукс, Вернадский, Ферсман [2-4]. Академик Ферсман, в частности, писал: "Весь ход химических процессов космоса есть не что иное, как грандиозная менделеевская система, в которой законы энергетики и уровни энергии как бы управляют отдельными клетками, перемещая элементы и сочетания элементов во времени и пространстве... В будущем уравнении, выражающем общую закономерность развития материи в неорганической природе, клетка менделеевской таблицы с величиной заряда и характерными термами будет основной величиною" [4].
Признавая справедливость приведенных мнений и высказываний, следует в то же время отметить, что они, в своей основе, интуитивны и не базируются на каких-либо строгих критериях, позволяющих дать генетическую интерпретацию периодической системы. Однако такой критерий имеется. Им является величина энергии связи электронов с 2 ядром, которую можно уподобить энергии образования химических соединений из свободных атомов.
О закономерностях, выявленных при анализе экспериментальных данных по энергии связи электронов в атомах естественного ряда химических элементов, а также следствиях, вытекающих из этих закономерностей, и пойдет речь в настоящей статье.
В литературе, начиная с классических работ Н. Бора [5], А. Зоммерфельда [6] и заканчивая современными учебными курсами и справочниками по атомной физике и химии [7-10], а также популярными публикациями, например [11], формирование электронных оболочек атомов химических элементов дается в последовательности от легких элементов к тяжелым. Так в работе [7] говорится, что при переходе от элемента с атомным номером Z к следующему, более тяжелому элементу с номером Z+1, т.е. при увеличении заряда ядра на единицу, присоединится и (Z+1)-й электрон, занимая уровень, которому отвечает наименьшая возможная энергия. Такая схема формирования электронного окружения атомов является, по словам Зоммерфельда, "генетическим описанием построения элементов от водорода до урана" [10, стр.141 ].
Если переходить от элемента к элементу в порядке их нумерации, пишется в упомянутой [11] научно-популярной книге по периодической системе, то электронная оболочка будет расти подобно снежному кому: новый электрон каждого последующего элемента будет "напластовываться" на электронную оболочку каждого предшествующего или внедряться в нее. Отсюда следует, пишется далее, что любой последующий элемент сохраняет в себе электронную конфигурацию (структуру) любого предшествующего.
В справочнике [12] также говорится, что периодичность физико-химических свойств связана с существованием электронных оболочек атома, постепенно заполняющихся с возрастанием Z.
Приводя перечисленные высказывания и утверждения нельзя не подчеркнуть, что все они, претендуя на описание процесса формирования электронных оболочек атомов в зависимости от величины заряда ядра, в действительности рисуют стационарную картину электронного строения атомов с различным Z, без привлечения данных по энергии связи электронов с ядром. Судить же об истинной очередности присоединения электронов к ядрам с различной величиной Z можно лишь опираясь на энергетику взаимодействия соответствующих электронов с ядром. Именно этот подход позволяет выявить связь местоположения элементов в периодической системе с очередностью их формирования в природе.
Если в вопросе о происхождении химических элементов исходить из представлений о горячей ранней Вселенной [13], то процесс образования атомов можно связывать только с поэтапным остыванием первичной высокотемпературной материи. На начальном этапе, еще при сверхвысоких энергиях, исчисляемых мега электрон-вольтами, шло образование ядер атомов. Энергия связи ядер, приходящаяся на один нуклон, составляет 8 МэВ. На последующих этапах, после образования плазмы, состоявшей из атомных ядер и свободных электронов, шло непосредственно формирование атомов, путем "обрастания" ядер электронами. Этот процесс охватывал диапазон энергий от тысяч до единиц электрон-вольт. Поскольку химические свойства элементов определяются, главным образом, взаимодействием электронов с ядрами, рассмотрим только этот аспект формирования атомов, не касаясь проблемы образования самих ядер.
Для того, чтобы наглядно представить процесс перехода плазменного состояния материи в атомное рассмотрим вначале обратный процесс — образование плазмы из нейтральных атомов [14]. Если в замкнутом сосуде нагревать какое-либо вещество, то сначала пройдут агрегатные превращения: твердое → жидкость → пар, затем атомизация молекул пара и, наконец, ионизация атомов. С увеличением температуры относительная доля ионов и электронов в газовой смеси быстро возрастает. Так для водорода при 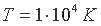 число ионизированных атомов составляет меньше 10% от общего числа атомов, а при температуре
число ионизированных атомов составляет меньше 10% от общего числа атомов, а при температуре 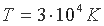 практически все атомы ионизированы.
практически все атомы ионизированы.
Поскольку у водорода один электрон, то при 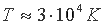 ионизация заканчивается. У атомов с большим числом электронов, обладающих разной энергией связи с ядром, при температуре
ионизация заканчивается. У атомов с большим числом электронов, обладающих разной энергией связи с ядром, при температуре 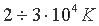 отрывается только часть электронов, принадлежащая внешним слоям оболочки, а для полной ионизации необходима энергия в тысячи и сотни тысяч электрон-вольт.
отрывается только часть электронов, принадлежащая внешним слоям оболочки, а для полной ионизации необходима энергия в тысячи и сотни тысяч электрон-вольт.
Если теперь рассмотреть обратный процесс, т.е. процесс охлаждения полностью ионизированной плазмы, то картина, естественно, будет прямо противоположной, как в кинофильме с обратным движением кадров — "обрастание" ядер электронами начинается с наиболее тяжелых элементов, постепенно захватывая, по мере снижения температуры, все более легкие. Последовательность присоединения каждого из электронов, слагающих оболочку, определяется силой их притяжения к ядру, т.е. энергией связи, судить о которой можно по соответствующим потенциалам ионизации.
К настоящему времени все потенциалы ионизации экспериментально определены лишь для атомов первых двадцати восьми элементов таблицы Менделеева [15]. Для остальных элементов в справочниках приводятся данные по энергии связи только внешних (от одного до десяти-двенадцати) электронов [16].
Необходимость знать величину энергии связи каждого из электронов для атомов всех элементов периодической системы привела нас к попытке найти какую-либо эмпирическую зависимость, позволяющую получить хотя бы оценочные данные по энергии связи соответствующих электронов с ядром.
Основываясь на том, что в водородоподобных атомах (ионах) корень квадратный из энергии связи единственного электрона с ядром описывается соотношением:
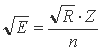
где R - постоянная Ридберга (13,606 эВ); n - главное квантовое число, равное 1, было решено проверить эту функциональную связь и на других изоэлектронных сериях ионов, для которых подобная связь считалась невозможной из-за электрон - электронного взаимодействия.
Построив по справочным данным графики зависимости корня квадратного из соответствующих изономерных (считая от ядра) потенциалов ионизации от атомного номера, мы обнаружили [16], что все они линейны и группируются в пучки, соответствующие квантовым слоям - К, L, M, N. Математическое выражение найденной зависимости по виду оказалось таким же, как и для водородоподобных ионов:
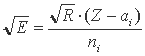
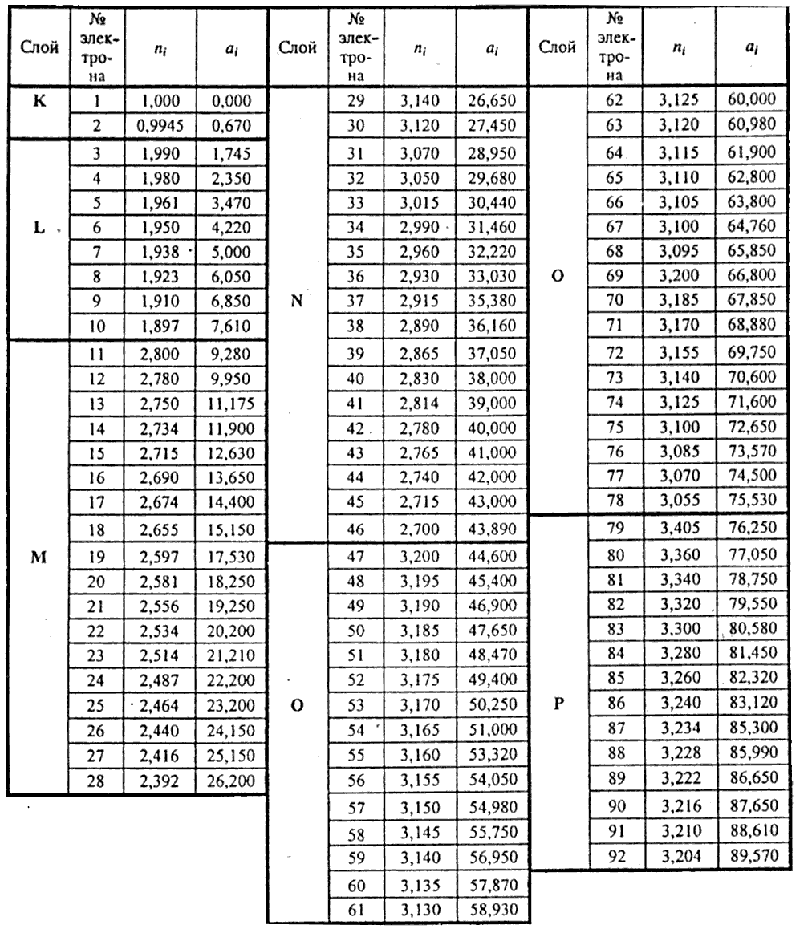
Особенностью этого выражения является то, что оно содержит постоянную экранирования (ai) которая представляет собой величину заряда ядра для i-й серии электронов, нейтрализуемую электронами более глубоких уровней. Кроме того, главное квантовое число (ni) здесь относится не к квантовому слою, а к каждой изономерной серии электронов и не является целочисленным. По физическому смыслу ni, представляет собой часть заряда ядра пропорциональную величине энергии связи электрона, равной 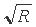 . В одноэлектронных (водородоподобных) ионах такая величина энергии связи пропорциональна единичному заряду ядра.
. В одноэлектронных (водородоподобных) ионах такая величина энергии связи пропорциональна единичному заряду ядра.
Таблица - Схема эффективных главных квантовых чисел 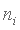 и постоянных экранирования
и постоянных экранирования 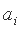 изономерных серий электронов
изономерных серий электронов
После определения для каждой изономерной серии электронов (через тангенс угла наклона соответствующих графиков) величин ai и ni (см. таблицу), появилась возможность вычислить энергию связи каждого электрона для всех атомов естественного ряда химических элементов и нарисовать общую картину их электронного строения (рис.1).
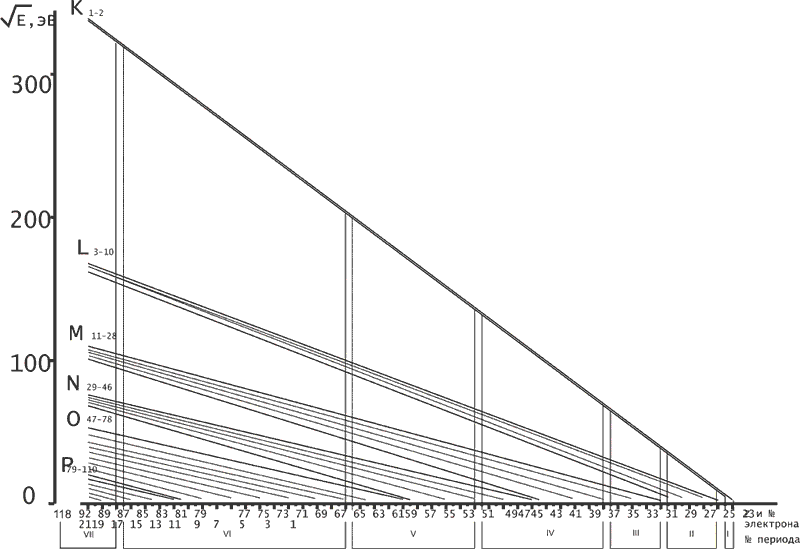
Риcунок 1 - Графики зависимости и общая структура электронных оболочек атомов естественного ряда химических элементов
Как видно из приведенных графиков, величина потенциалов ионизации закономерно снижается от электрона к электрону по мере удаления от ядра и по мере снижения его заряда. Следовательно, если электронам присвоить порядковые номера с первого по девяносто второй, идя от центра атома к периферии, то эта нумерация определит и очередность их присоединения в процессе формирования электронных оболочек каждого из атомов. Из графиков следует, что еще до того, как у атомов легких элементов (от аргона и ниже) появится первый электронный слой, у тяжелых, в этом энергетическом диапазоне, сформируются первый, второй, третий, четвертый и даже пятый слои - К, L, М, N, О. Так, применительно к урану (Z=92) и аргону (Z=18) энергетика присоединения электронов к их ядрам выглядит следующим образом. Для урана энергия связи первого (К) электрона составляет 115111 эВ, восемнадцатого (М) - 11394 эВ, сорок пятого (N) - 4432 эВ, семьдесят восьмого (О) - 395 эВ. У аргона же энергия связи первого (К) электрона составляет всего 4408 эВ, а восемнадцатого (М) - 15,67 эВ. Это и дает основание утверждать, что к моменту, когда энергетические условия станут благоприятными для присоединения к ядру аргона первого электрона, ядро урана будет окружено уже 45 электронами.
Особый интерес в картине электронного строения атомов естественного ряда химических элементов, основанной на зависимости 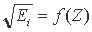 , представляет то, что линейные графики изономерных серий электронов в первых трех квантовых слоях - К, L, М, сближаясь по мере возрастания Z, пересекаются в окрестности
, представляет то, что линейные графики изономерных серий электронов в первых трех квантовых слоях - К, L, М, сближаясь по мере возрастания Z, пересекаются в окрестности 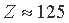 [17]. Значение величины
[17]. Значение величины 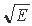 (эВ) в точках пересечения составляет 461±0,04; 228,32±0,09; 152,36±0,05 для К, L и M-слоев, соответственно. Физическое содержание точек пересечения самым непосредственным образом связано с энергетической устойчивостью электронных структур атомов, что, в свою очередь, проливает свет на проблему верхней границы периодической системы.
(эВ) в точках пересечения составляет 461±0,04; 228,32±0,09; 152,36±0,05 для К, L и M-слоев, соответственно. Физическое содержание точек пересечения самым непосредственным образом связано с энергетической устойчивостью электронных структур атомов, что, в свою очередь, проливает свет на проблему верхней границы периодической системы.
Проблема верхней границы естественного ряда химических элементов имеет два аспекта - аспект ядерной устойчивости сверхтяжелых атомов и аспект их электронной устойчивости. Первого аспекта мы касаться не будем, а кратко остановимся на втором.
Электронная устойчивость атомов определяется критическим значением Z, выше которого существование атомов невозможно из-за мгновенного орбитального захвата электрона. Определение критического значения Z и является, следовательно, решением означенной проблемы. Именно с этой точки зрения и представляет интерес величина 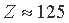 , где пересекаются графики
, где пересекаются графики 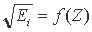 К, L и М квантовых слоев. Если продлить каждый из пересекающихся графиков в область значений
К, L и М квантовых слоев. Если продлить каждый из пересекающихся графиков в область значений 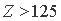 , то окажется, что энергия связи электронов более удаленных от ядра выше таковой менее удаленных, что, конечно же, противоестественно. Из этого логично сделать вывод, что в окрестности
, то окажется, что энергия связи электронов более удаленных от ядра выше таковой менее удаленных, что, конечно же, противоестественно. Из этого логично сделать вывод, что в окрестности 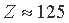 лежит граница устойчивости электронных структур атомов. При
лежит граница устойчивости электронных структур атомов. При 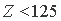 - структуры устойчивы, а при
- структуры устойчивы, а при 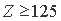 их формирование энергетически невозможно. Другими словами,
их формирование энергетически невозможно. Другими словами, 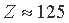 можно рассматривать как верхнюю границу периодической системы. Этот вывод находится в довольно близком согласии с величиной критического
можно рассматривать как верхнюю границу периодической системы. Этот вывод находится в довольно близком согласии с величиной критического 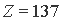 , вычисленной П.Дираком [18] в 1928 г., а также с вероятностными данными об устойчивости электронных конфигураций атомов с
, вычисленной П.Дираком [18] в 1928 г., а также с вероятностными данными об устойчивости электронных конфигураций атомов с 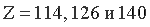 [19].
[19].
Все изложенное выше об энергетической очередности формирования электронных структур атомов в порядке снижения заряда ядра, а также о границе их зарядовой устойчивости, с несомненностью свидетельствует о том, что в атомных номерах естественного ряда химических элементов содержится и генетическая информация. Наглядно она проявляется в табличном изображении периодической системы с расстановкой элементов в нисходящем по атомному номеру порядке [17, 20]. Периодическая система в таком изображении предстает как естественный, энергетически ранжированный по величине Z, ряд химических элементов с периодически повторяющимися свойствами. Если принять, что верхняя граница устойчивости электронных структур атомов находится в окрестности гипотетического элемента с 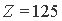 , то периодическую систему уверенно можно строить, начиная со 118-го элемента. Он должен возглавить седьмой период и быть аналогом инертного газа радона из нижележащего шестого периода.
, то периодическую систему уверенно можно строить, начиная со 118-го элемента. Он должен возглавить седьмой период и быть аналогом инертного газа радона из нижележащего шестого периода.
Табличное изображение периодической системы, основанное на энергетической очередности формирования электронных структур атомов, приведено ниже (рис.2).
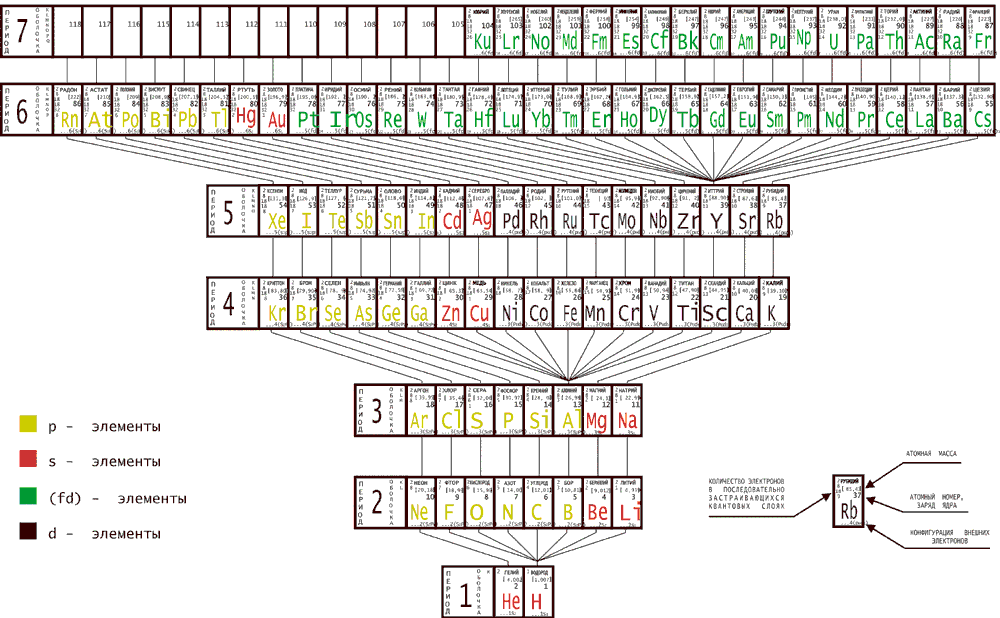
Рисунок 2 - Периодическая система с учетом энергетической очередности формирования электронных структур атомов
Особенностью представленной таблицы, кроме нисходящего расположения в ней элементов, является то, что она не содержит групп, а сходные по свойствам элементы увязываются между собой, как и в таблице Бора-Томсена, прообраз которой взят нами за основу, лишь соединительными линиями.
Другая особенность таблицы та, что в трех "малых" периодах выделены элементы - Y, А1, Н, как аналоги не одного, а целого ряда элементов вышележащего, более длинного периода. Это сделано на основе следующих соображений.
Каждый период в химическом отношении содержит такое число элементов, которые в сумме дают спектр свойств от инертных до щелочных. Но в разных периодах этот спектр образуется разным числом элементов - тридцатью двумя, восемнадцатью, восемью и двумя. Из этого можно заключить, что в более коротком периоде имеется особый элемент, который несет в себе черты не одного, а целой группы элементов большего периода. Именно таким элементом является иттрий - аналог лантана и еще 14-ти редкоземельных f-элементов, недостающих в пятом периоде по сравнению с шестым. В третьем периоде таким особым элементом является алюминий, по которому проходит граница между металлами и металлоидами, и который можно рассматривать как аналог галлия и десяти d-элементов четвертого периода, недостающих в третьем. В первом периоде особым элементом является водород, который благодаря проявлению полярных свойств - щелочных и галоидных, может характеризоваться как аналог и других элементов второго периода, располагающихся между литием и фтором.
Расстановка элементов в нисходящем порядке решает и ряд дискуссионных вопросов периодической системы. Так, в литературе неоднократно обсуждался вопрос, где располагать инертные газы - или их выделять в нулевую группу и ставить перед щелочными металлами, как было принято раньше, или помещать их в восьмой группе, как это стали делать впоследствии. Генетический подход однозначно определяет: место инертных газов во главе каждого периода, поскольку они имеют наибольшую энергию связи электронного окружения с ядром по сравнению с другими элементами периода. При этом число полностью завершенных электронных слоев в оболочке инертного газа соответствует и номеру периода.
При нисходящей расстановке элементов снимается и проблема размещения актиноидов и лантаноидов в таблице. Эти элементы не обособляются в особые группы, а органически вписываются в общую структуру системы, занимая соответствующие места в своих периодах.
Однозначным, с рассматриваемых позиций, оказывается и замыкающее положение водорода в периодической системе, поскольку энергия связи "электронного окружения" с ядром у него наименьшая по сравнению с другими элементами, т.е. атомы водорода, как химические индивиды, формировались последними на пути эволюционного остывания исходной плазмы.
Выводы
Литература
© 2005 Горох Алексей Васильевич
По всем вопросам обращайтесь: E-mail: gor@konstant.ac.donetsk.ua