 (1)
(1)| ДонНТУ | Портал магистров | Биография | Автореферат | Библиотека | Ссылки | Отчет о поиске |
Математическое описание химической динамики в дисперсных двухфазных несмешивающихся системах когда распределение размеров частиц дисперсной фазы меняется во времени – многообещающая проблема в инженерии химических реакторов. Проблема сложна не только из-за чрезвычайно большого числа элементов дисперсной фазы, но и из-за различных масштабов времени на разрушение/коагуляцию частиц, механики жидкости реактора, и химической реакции. Хотя в пределах осуществимого лежит явный учет ограниченного числа дисперсных элементов и их разрушения/коагуляции, статистический подход будет более эффективным для большого числа частиц. Такой подход воплощен в кинетике распределения, где гранулометрический состав изменяется во времени (и пространстве) согласно уравнению динамики системы. Наша задача – те модели, которые упрощают и аппроксимируют сложные процессы для понимания базовых аспектов проблемы и помогут в более сложном и детальном моделировании.
Наша цель – исследовать динамику непрерывного реактора идеального смешения, содержащего дисперсную фазу, которая может состоять из пузырьков газа, капель жидкости или твердых частиц распределенных в сплошной жидкой фазе; или капель жидкости или твердых частиц в сплошной газовой фазе. Элементы дисперсной фазы (пузырьки, капли, частицы), в общем называемые частицы, подвергаются и фрагментации, и коагуляции одновременно. Мы предполагаем, что реактор хорошо перемешивается, так что сплошная фаза имеет однородную концентрацию. Концентрация дисперсной фазы также однородна в пределах частицы если массоперенос в частице быстрее скорости реакции, но в целом концентрация реагента в частицах будет различаться. Как мы покажем, большинство таких случаев может быть решено аналитически или численно, и это расширит количество решений в расчетах химических реакторов.
Реальные дисперсные системы имеют распределенные значения размеров частиц и зависят от времени. Управляемое уравнением динамики системы, изменение распределения размеров во времени – фундаментальная тема в химической технологии. Чтобы облегчить представление материального баланса соответствующими уравнениями, мы предлагаем подход, основанный на распределении массы, так что в реакторе идеального смешения распределение размеров частиц – функция массы частицы X и времени t. Объем частицы – это ее масса, деленная на плотность. Из заданного начального состояния распределение размеров частиц изменится к конечному стационарному состоянию. Таким образом, ключевые параметры – свойства дисперсной и сплошной фазы, включая начальное распределение. Особенности перемешивания, связанные с подводом энергии и объемом и геометрией мешалки отражены в коэффициентах скорости фрагментации и коагуляции. В зависимости от начального состояния и значений коэффициентов преобладает коагуляция или фрагментация, пока не будет достигнуто динамическое равновесие. Это конечное динамическое равновесие наступает, когда фрагментация и коагуляция сбалансированы в динамическом равновесии. Ранее было доказано, что такая реверсивная кинетика является более реалистической чем модель, основанная на необратимой фрагментации, которая предполагает, что материальные точки ниже определенного размера никогда не могут фрагментироваться, потому что спектр турбулентности имеет ограниченную энергию, или частицы слишком разрежены, чтобы допустить коагуляцию даже в течение длительного времени после разрыва. Тем не менее двоичная коагуляция увеличится с ростом числа частиц, и поскольку фрагментация увеличивает число частиц в прогрессии, коэффициент коагуляции должен увеличиваться. Динамическое стационарное состояние для гранулометрического состава будет в конечном счете достигнуто. Когда коэффициент скорости фрагментации пропорционален массе и коэффициент скорости коагуляции не зависит от массы, уравнение реверсивной фрагментации-коагуляции системы точно удовлетворяет
Центральная проблема – представление для скорости реакции, или скорости массопередачи, в динамическом реакторе с дисперсной фазой. Мы хотим показать, как концентрация реагента (и продукта) изменяется во времени, когда одновременно протекают фрагментация и коагуляция. Наблюдение за реагентом в дисперсной фазе труднее, чем в сплошной, потому что фрагментация и коагуляция приводят к смешению частиц. Крайний случай – реакция второго порядка между двумя реагентами в любой фазе медленна, и ее скорость зависит только от площади поверхности раздела фаз. Мы покажем, как сформулировать и решить модель, когда концентрации однородны в каждой фазе. Более простые нетривиальные случаи возникают, когда концентрация реагента в любой фазе управляется. Это происходит, когда реакция имеет нулевой порядок по одному из реагентов, например, когда он в большом избытке и его концентрация является константой. Скорость реакции может быть выражена в терминах распределения массы частиц через модели для объема, площади поверхности или механизма, контролируемого диффузией. Они приводят к степенному закону зависимости скорости реакции от массы частицы, и к уравнениям скорости реакции, которые могут быть аналитически решены в закрытой форме. Хотя решения основаны на приближении концентрации реагента в дисперсной фазе, более детальные и описательные модели должны привести к тем же решениям.
Малые концентрации реагентов предполагают, что реакция не изменяет массу дисперсной фазы. Когда фрагментация и коалесценция некоррелированы, реверсивные двоичные процессы могут быть представлены как
 (1)
(1)
где kb(x) и 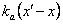 – коэффициенты скорости фрагментации и коалесценции соответственно. PSD определено, так что p(x,t)dx – число частиц в единице объема во время t в диапазоне масс (x, x+dx). Из этого следует, что моменты масс для любого ν:
– коэффициенты скорости фрагментации и коалесценции соответственно. PSD определено, так что p(x,t)dx – число частиц в единице объема во время t в диапазоне масс (x, x+dx). Из этого следует, что моменты масс для любого ν:
 (2)
(2)
Уравнение динамики системы первого порядка для расщепления и второго порядка для слияния
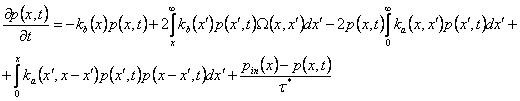 (3)
(3)
где τ* – среднее время пребывания (отношение объема реактора к полному расходу) и pin(x) – распределение входных отверстий. Начальное распределение p(x,t=0)=p0(x), которое по (2) имеет моменты, 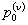 . Уравнение динамики системы (3) уменьшается до чистой фрагментации или чистой агрегации соответственно, когда ka или kb исчезают. Стехиометрическое ядро,
. Уравнение динамики системы (3) уменьшается до чистой фрагментации или чистой агрегации соответственно, когда ka или kb исчезают. Стехиометрическое ядро, 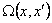 , дает распределение массы продукта для бинарного деления и удовлетворяет условиям симметрии и нормализации. Общее стехиометрическое ядро фрагментации может представить весь диапазон распределений продукта от случайного до среднего деления,
, дает распределение массы продукта для бинарного деления и удовлетворяет условиям симметрии и нормализации. Общее стехиометрическое ядро фрагментации может представить весь диапазон распределений продукта от случайного до среднего деления, 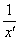 (выбрано здесь) и
(выбрано здесь) и 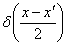 . В общем, коэффициент скорости расщепления kb(x) увеличивается с ростом размеров частиц, например, как xλ. Для хорошо перемешиваемой жидкости коэффициент скорости агрегации должен быть относительно независим от массы слипающихся частиц, таким образом,
. В общем, коэффициент скорости расщепления kb(x) увеличивается с ростом размеров частиц, например, как xλ. Для хорошо перемешиваемой жидкости коэффициент скорости агрегации должен быть относительно независим от массы слипающихся частиц, таким образом, 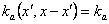 – константа. Более общие коэффициенты скорости могут быть получены решением (3) численно.
– константа. Более общие коэффициенты скорости могут быть получены решением (3) численно.
Рассмотрим необратимую реакцию второго порядка A+B->C с реагентом A в дисперсной фазе и B в сплошной фазе. Реакция медленна относительно быстрой внутрифазной диффузии и таким образом протекает на поверхности раздела фаз. Это ограничение будет использоваться если реагенты растворимы только в своих несмешивающихся фазах. Тогда материальные балансы в концентрациях в дисперсной и сплошной фазах соответственно:
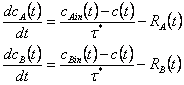 (4)
(4)
где RA=RB – скорость реакции, протекающей на поверхности раздела, здесь записано как скорость потери с отрицательным знаком. Среднее время пребывания τ* для сплошной и дисперсной фазы принято для хорошо перемешиваемого реактора. Для сферической частицы массой X и плотностью ρ ее радиус, площадь и объем равны 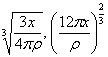 и x/ρ соответственно. Таким образом, для скорости, пропорциональной радиусу, площади и объему частицы мы имеем степенное выражение xν, где ν=1/3, 2/3 и 1 соответственно. Кроме того, мы можем принять скорость независимой от размера частицы (ν=0). Могут быть выбраны различные уравнения реакции, здесь мы принимаем реакцию первого порядка по каждой концентрации, или второго порядка в целом. Реакция происходит на всех частицах, и следовательно получаем интеграл по PSD , если концентрации независимы от массы частицы:
и x/ρ соответственно. Таким образом, для скорости, пропорциональной радиусу, площади и объему частицы мы имеем степенное выражение xν, где ν=1/3, 2/3 и 1 соответственно. Кроме того, мы можем принять скорость независимой от размера частицы (ν=0). Могут быть выбраны различные уравнения реакции, здесь мы принимаем реакцию первого порядка по каждой концентрации, или второго порядка в целом. Реакция происходит на всех частицах, и следовательно получаем интеграл по PSD , если концентрации независимы от массы частицы:
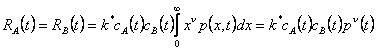 (5)
(5)
Равенство скоростей для А и В – следствие предположения, что реакция независима от размера частиц. Константа скорости k* объединяет факторы химической кинетики и геометрии частиц. Важно понимать, что выражение (5) аппроксимирует общую скорость реакции как среднее между всеми частицами и зависимостью концентрации частиц от массы пренебрегают. Таким образом, концентрации CA и CB являются средними концентрациями между всеми частицами. Эта аппроксимация будет менее точной для коалесценции двух частиц, концентрации которых сильно различаются. Фрагментация, с другой стороны, приведет к двум частицам одинаковой концентрации, если, как мы приняли, концентрация в частице однородна. Модель таким образом менее применима к процессам с сильно различными концентрациями в разных частицах. Как только выражение (3) решено относительно p(x,t), выражение (5) может быть решено и подставлено в (4а) и (4б) для окончательного описания непрерывного реактора идеального смешения. Заметим, что для ν=0 или 1 скорость пропорциональна нулевому или первому моменту соответственно. Особенно интересен частный случай – когда τ*->∞, и мы имеем закрытый нестационарный реактор идеально смешения, который также представляет стационарный трубчатый турбулентный реактор, когда время заменено отношением длины к скорости.
Рассмотрим массообмен химического вещества из дисперсной фазы (вещество C) в сплошную фазу (вещество D):
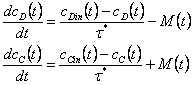 (6)
(6)
Скорость массопередачи M(t) – интеграл (по массе частиц) коэффициента массопередачи и движущей силе разности концентраций:
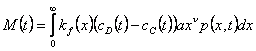 (7)
(7)
Площадь массообмена для частиц с массой в диапазоне от x до x+dx равна 4/3πr3 p(x,t)dx=axν где ν=2/3 и 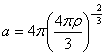 . Мы предполагаем, что концентрации в дисперсной и непрерывной фазах не зависят от размера частицы и поэтому являются функцией только времени. Если коэффициент kf также считать независимым от размера частиц, то скорость массопереноса пропорциональна ν=2/3 моменту:
. Мы предполагаем, что концентрации в дисперсной и непрерывной фазах не зависят от размера частицы и поэтому являются функцией только времени. Если коэффициент kf также считать независимым от размера частиц, то скорость массопереноса пропорциональна ν=2/3 моменту:
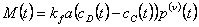 (8)
(8)
Сходство уравнений для скорости реакции и массопереноса ((5) и (8)) и их материальных балансов ((4) и (6)) очевидно. Может быть полезно исследовать другие значения ν, которые можно рассчитать приблизительно для зависимости от размера частицы в коэффициенте массопереноса.
Для любой математической модели физико-химического процесса критично понимание ее предположений и приближений. Когда модель основана на известных научных правилах и представлена систематически, ограничения более очевидны. Главные соглашения текущей модели следующие:
Коэффициент скорости фрагментации kb(x) требует, чтобы зависимость от x была представлена явно. Мы определяем коэффициент скорости фрагментации для частиц массой 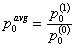 таким, что
таким, что 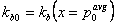 и записываем безразмерные количества:
и записываем безразмерные количества:
 (9)
(9)
где распределения масштабированы с начальными количествами 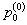 и
и 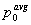 . Выражение (3) становится:
. Выражение (3) становится:
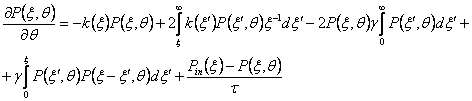 (10)
(10)
ν-ые моменты для масштабированных распределений 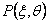 определены как
определены как
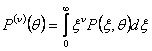 (11)
(11)
Если ν=2/3 момент (11) – мера площади поверхности раздела, и служит мерой смешения дисперсной фазы. Поэтому P(2/3) увеличится, если доминирует разбиение, и уменьшится, если доминирует агломерация (то есть в процессе оседания эмульсии). Когда приведем выражения (4) и (5) к безразмерной форме, получим:
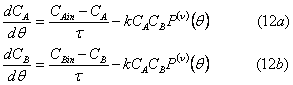
и скорости реакции определяется ν-ым моментом дисперсной фазы. Как упомянуто выше, симметрия выражений (12а) и (12b) – результат усреднения между всеми частицами.
Случай массопереноса из дисперсной в сплошную фазу выраженный в размерности масштабированных концентраций дисперсной и сплошной фазы (вещества D и C соответственно):
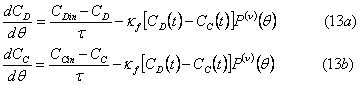
где 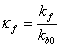 .
.
Моментные операции могут быть применены к выражениям (3) или (10) для того, чтобы получить безразмерные выражения для моментов для целых значений j:
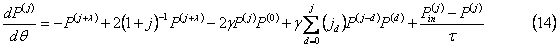
где jd – биноминальный коэффициент. Из выражения (14) моментов для j=1, 2 и 3:
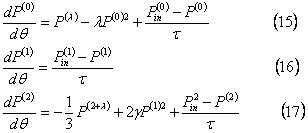
Когда дисперсная фаза не поступает в реактор и не покидает его, τ -> ∞ в выражениях (12а) и (15-17), выражение (16) гарантирует, что масса частицы постоянна во времени, 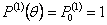 . Решение моментных выражений (15) и (16) может быть полезно, когда λ=0 или 1 в (14), так чтобы получить замыкание иерархии моментов.
. Решение моментных выражений (15) и (16) может быть полезно, когда λ=0 или 1 в (14), так чтобы получить замыкание иерархии моментов.
Большие частицы обычно имеют повышенную тенденцию разрываться под воздействием турбулентности, и коэффициент скорости увеличивается с массой частицы, например, как xλ . Для дисперсной фазы, содержащейся в сосуде, и с коалесценцией и фрагментацией, происходящими одновременно, если λ<>1 развивающееся распределение почти подобной (или экспоненциальной) формы. Но если θ=1 , произвольное начальное распределение развивается к точной форме подобия через некоторое время, которое зависит от отклонения начального распределения от экспоненциального. Также показано, что если начальным состоянием является экспоненциальное распределение, тогда решение всегда экспоненциальное, и может быть записано:
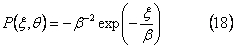
Моменты целого порядка для решения подобия могут быть просто представлены как
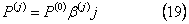
так что полидисперсность 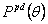 всегда равна 2, и отношение первых и нулевых моментов – средняя масса:
всегда равна 2, и отношение первых и нулевых моментов – средняя масса:
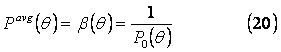
Распределение в этом случае управляется средне массой частицы, β(θ), которая удовлетворяет дифференциальному уравнению
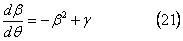
С начальным состоянием 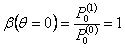 решение уравнения (21) может быть записано как:
решение уравнения (21) может быть записано как:
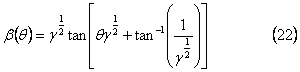
которое имеет асимптотическое поведение при γ=0,
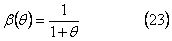
и для γ>>1 при малых β
β(θ)=1+γθ (24)
Таким образом, β-1 изменяется линейно с θ при малых γ и θ, и β изменяется линейно с θ при больших γ. При больших интервалах времени θ->∞, β всегда стремится к пределу γ1/2. Зависимость β от θ (22) показана на рис.1 для различных значений γ.
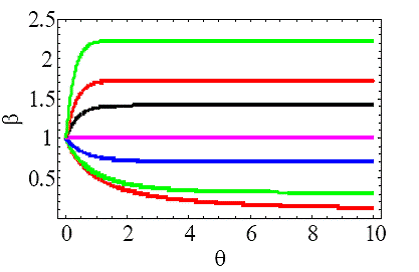
Рис.1 – Развитие 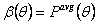 для λ=1 при различных значениях γ=0.01, 0.1, 0.5, 1.01, 2, 3, 5 (снизу вверх)
для λ=1 при различных значениях γ=0.01, 0.1, 0.5, 1.01, 2, 3, 5 (снизу вверх)
Для γ=1 и β(0)=1 в выражении (21) 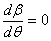 , так что начальное экспоненциальное распределение сбалансировано между фрагментацией и коалесценцией на рис.1, и поэтому не меняется во времени. Когда решение подобия (22) подставляется в определение момента (11), мы получаем простое выражение для любого ν:
, так что начальное экспоненциальное распределение сбалансировано между фрагментацией и коалесценцией на рис.1, и поэтому не меняется во времени. Когда решение подобия (22) подставляется в определение момента (11), мы получаем простое выражение для любого ν:
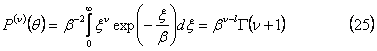
в определениях гамма-функции.
| ДонНТУ | Портал магистров | Биография | Автореферат | Библиотека | Ссылки | Отчет о поиске |