| ДонНТУ | Портал магистров | Биография | Автореферат | Библиотека | Ссылки | Отчет о поиске |
Основным процессом введения нитрогруппы в ароматическое ядро является реакция нитрования, осуществляемая посредством электрофильного замещения водорода бензольного ядра на нитрогруппу. Другие методы прямого введения нитрогруппы (нитрозирование, окислительное нитрование, нитрование в некислых средах и заместительное нитрование) осуществляются в значительно меньших масштабах. Косвенные методы введения нитрогруппы (окисление азотсодержащих групп, замена диазогруппы на нитрогруппу и перегруппировка N-нитраминов в С-нитросоединения) имеют, как правило, чисто препаративное значение.
Прямое введение нитрогрупп в молекулу является одним из главных способов получения нитросоединений. Выбор нитрующих агентов, применяемых для нитрования, зависит от свойств нитруемого соединения и желаемой степени нитрования. Наиболее часто употребляемым нитрующим агентом является азотная кислота или серно-азотная кислотная смесь. Однако в некоторых случаях приходится применять другие нитрующие средства, такие, как смеси азотной кислоты с уксусной кислотой или уксусным ангидридом, соли азотной кислоты, окислы азота.
Реакция нитрования ароматических соединений была открытав 1834 г. Митчерлихом, получившим нитробензол действием азотной кислоты на бензол. Практическое же значение она приобрела в производстве искусственных красителей после открытия знаменитым русским химиком Н. Н. Зининым реакции восстановления нитробензола в анилин (1842 г.). Последний, как известно, является одним из основных исходных продуктов при производстве красителей.
С 1842 г. нитрованием фенола получали пикриновую кислоту, применявшуюся до 1885 г. в качестве красителя для шелка и шерсти, а с 1885 г. — как бризантное ВВ. С этого времени в промышленности стали готовить также и другие полинитропроизводные ароматических углеводородов для использования их в качестве ВВ. Таким образом, реакция нитрования получила чрезвычайно важное практическое значение.
В настоящее время реакция нитрования ароматических соединений применяется очень широко, а при получении ВВ является основной стадией синтеза.
Управление промышленностью должно базироваться на вычислительной технике. Опасность и большие масштабы производства ВВ делают эту задачу особенно актуальной. Использование вычислительной техники для управления технологическими процессами возможно лишь при наличии кинетических уравнений этих процессов, точность которых определяется правильностью представлений о механизме реакций.
Современные представления о реакции нитрования и кинетика ее в гетерогенных условиях (имеющих место в заводской практике) позволяют подойти к более углубленному изучению и количественному описанию этого процесса. Теоретическое исследование процесса нитрования может помочь разрешению ряда технологических трудностей и наметить пути управления этими процессами, исходя из соображений рентабельности и безопасности производства.
В течение длительного времени механизм нитрования ароматических соединений, так же как и других реакций замещения, изучался вне связи со строением реагирующих компонентов и без учета реакций, предшествующих нитрованию. Лишь в последние годы изучение этих реакций позволило представить стройный механизм нитрования, достаточно хорошо объясняющий фактический материал, полученный исследованием этого процесса.
Согласно современным представлениям реакция нитрованияароматических соединений (реакция электрофильного нитрования) в большой степени определяется предшествующим ей процессом образования нитрующего агента. Физико-химический анализ азотной кислоты (и ее смесей) позволил представить ее каксложную систему, являющуюся результатом взаимных превращений молекул и ионов. В зависимости от состояния азотной кислоты она может дать три различных электрофильных нитрующих агента:
нитроний-катион NO2+, который находится в виде сольватированного иона в протонных растворителях (кислотах);
соли нитрония (NO2+•BF4-, NO2+•СlO4- и др.). которые действуют как сольватированная ионная пара в диполярных апротонных растворителях, например в сульфолане;
протежированную форму ацетилнитрата СН3СООNO2Н+, образующегося в смесях азотной кислоты с уксусным ангидридом.
Наибольшей активностью в электрофильном нитровании обладает нитроний-катион, наименьшей — протонированной ацетил-нитрат.
Нитрование также может протекать и посредством нейтральных молекул N2O5 и CH3COONO2, а в присутствии большого количества Н2О, где образование указанных форм исключено, нитрование идет через нитрозирование посредством катиона NO+. В ряде случаев нитрующий агент не установлен.
Однако принятый механизм образования нитросоединения путем электрофильной атаки нитруемого соединения катионом нирония, его солью или протонированной формой ацетилнитрата, несмотря на кажущуюся стройность, является слишком схематичным.
Создать универсальный механизм нитрования вряд ли возможно. Осуществление этой реакции на практике свидетельствует о чрезвычайном разнообразии приемов проведения ее и большой индивидуальности условий при получении каждого отдельного нитросоединения. Механизм нитрования изучали как путем выделения промежуточных продуктов реакции, так и исследованием кинетики реакции. Второй прием наиболее плодотворен, и, что особенно важно, полученные данные могут быть использованы для оптимизации технологических процессов нитрования.
Из всех рассматриваемых далее способов введения нитрогрупп промышленное значение при синтезе ВВ имеют только четыре: нитрование серно-азотной кислотной смесью, нитрование чистой азотной кислотой или в среде уксусной кислоты, в присутствии уксусного ангидрида и замена сульфогруппы на нитрогруппу. Перспективными являются также способы нитрования с отгонкой воды и нитрование в присутствии нитрата ртути.
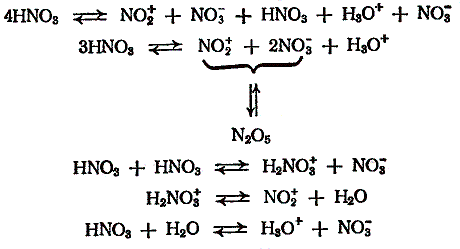
Криоскопические исследования и изучение электрической проводимости чистой азотной кислоты и смесей азотной и серной кислот, проведенные Ганчем, показали, что азотная кислота способна к диссоциации на ионы и в отсутствие воды. На основании этих работ Ганч высказал предположение об амфотерности азотной кислоты. В концентрированной азотной кислоте взаимодействуют две молекулы азотной кислоты, одна из которых выполняет роль кислоты, а другая — основания:
HNO3 + HNO3 <=> H2NO3+ + NO3-
В водных растворах азотная кислота выполняет роль кислоты:
HNO3 + H2O <=> H3O+ + NO3-
В присутствии более сильной кислоты азотная кислота функционирует как основание:
HNO3 + H2SO4 <=> H2NO3+ + HSO4-
Согласно спектроскопическим исследованиям ионизация молекул азотной кислоты различной концентрации происходит по следующим уравнениям, которые приводят к образованию из азотной кислоты катионов нитрония NO2+ и нитроцидия H2NO3+:

Безводная азотная кислота содержит при -40 °С около 3,4% продуктов диссоциации, в том числе 1,2% NO2+ 1,7% NO3- и 0,5% Н2О. Нитроний-катион и нитрат-анион сольватированы каждый двумя молекулами азотной кислоты. При добавлении воды азотная кислота образует вначале за счет водородных связей неионизированные комплексы составаH2O-(HNO3)2 и H2O-HNO3, затем диссоциация усиливается: когда содержание воды достигает 8%, ион NO2+ спектроскопически не обнаруживается. Равновесие реакции диссоциации азотной кислоты по схеме
HNO3 <=> H+ + NO3-
в маловодных растворах сдвинуто в сторону недиссоциированной кислоты. По мере добавления воды состояние HNO3 изменяется. Азотная кислота 50%-ная содержит уже только 5—10% недиссоциированных молекул. Более разбавленные растворы диссоциированы практически полностью:
HNO3 + H2O <=> H3O+ + NO3-
В серно-азотной кислотной смеси происходит взаимодействие серной кислоты с водой (если последняя присутствует) и азотной кислотой по следующим уравнениям:
H2O + H2SO4 <=> H3O+ + HSO4- (1)
HNO3 + 2H2SO4 <=> NO2+ + 2 HSO4- + H3O+ (2)
Более сильная серная кислота превращает азотную кислоту, реагирующую здесь как основание, в катион нитрония. В безводной серной кислоте происходит полное превращение азотной кислоты (при добавлении ее до 10%) по равновесию (2).
Значительная электрическая проводимость серно-азотных кислотных смесей, обнаруженная Сапожниковым и подробно изученная другими исследователями, подтверждает образование ионов при растворении азотной кислоты в серной. При электролизе раствора азотной кислоты в олеуме наблюдается переход ее к катоду, следовательно, азотная кислота находится в таком растворе в виде нитроний-катионов NO2+.
Отсутствие свободной азотной кислоты в серно-азотной смеси, содержащей менее 10% воды, и в безводной смеси подтверждается чрезвычайно низким давлением паров азотной кислоты над этой смесью.
Определением снижения температуры замерзания 100%-ной серной и пиросерной кислот при добавлении азотной кислоты показано, что при этом на каждую молекулу азотной кислоты образуются четыре частицы [см. уравнение (2)].
В настоящее время разработан метод количественного определения иона нитрония, основанный на измерении спектра комбинационного рассеяния. Найдено, что линия 1400 см-1, отвечающая иону NO2+ полностью исчезает в спектре азотной кислоты при содержании в ней 5-6% воды, а в спектре смеси азотной кислоты с серной — при значительно большем содержании воды. Уменьшение содержания, ионов NO2+ с добавлением воды к серно-азотной кислотной смеси объясняется образованием при этом гидроксоний и бисульфат-ионов [см. уравнение (1)], сдвигающих влево равновесную реакцию образования нитроний-катиона (2).
По спектральным данным константа равновесия уравнения (2) составляет 30-42, по кинетическим данным — 31-36. Следовательно, при достаточном избытке серной кислоты и при малом содержании воды азотная кислота практически полностью переходит в нитроний-катион. С увеличением содержания азотной кислоты в смеси степень превращения ее в нитроний-катион уменьшается.
Спектральные исследования водных растворов H2SO4 с небольшими добавками HNO3 показали, что при концентрации H2SO4 до 15% образуются только ионы NO3-, в интервале концентраций H2SO4 15-70% присутствуют ионы NO3- и молекулы HNO3, а при более высокой концентрации H2SO4 преобладает молекулярная HNO3 и в интервале концентраций H2SO4 72-82% — только молекулярная HNO3; при концентрации H2SO4 89% и выше в растворах находятся только ионы NO2+ (рис. 1).
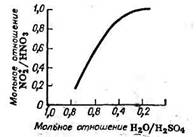
Рис. 1 - Степень превращения HNO3 в NO2+ в водной серно-азотной кислотной смеси
Существование нитроний-катиона подтверждается получением и выделением его солей, представляющих собой белые кристаллические вещества со следующими температурами плавления (в °С):
| NO2+•СlO4- | 135 |
| NO2+•HS2O7- | 105 |
| NO2+•FSO3- | 200 |
| NO2+•BF4- | 170 |
В растворах соли нитрония диссоциированы и хорошо проводят электрический ток. В таких растворителях, как нитрометан, они обнаруживают склонность к образованию ионных агрегатов. Ионное строение солей нитрония надежно установлено физико-химическими методами исследования. Все они содержат линейный трехатомный катион O=N+=O.
Особое место среди солей нитрония занимает азотный ангидрид. В твердом состоянии это ионное соединение — нитрат нитрония. Поведение его в растворах зависит от ионизирующей способности растворителя: в азотной кислоте, например, он диссоциирован на ионы:
N2O5 <=> NO2+ + NO3-
а в четыреххлористом углероде, хлороформе, нитрометане и хлорокиси фосфора находится в виде ковалентно построенных молекул. Соли нитрония образуются при взаимодействии ангидрида азотной кислоты с сильными минеральными кислотами, например
N2O5 +HClO4 <=> NO2+•СlO4- + HNO3
или азотной кислоты с ангидридом другой сильной кислоты:
HNO3 + 2SO3 <=> NO2+ + HS2O7-
Соли нитрония являются активными нитрующими агентами.
С уксусным ангидридом азотная кислота образует ацетилнитрат и азотный ангидрид:
HNO3 + (CH3CO)2O <=> CH3COONO2 + CH3COOH
2HNO3 + (CH3CO)2O <=> N2O5 + 2CH3COOH
Степень образования каждого из них зависит от мольного соотношения компонентов. При содержании HNO3 менее 50% (мол.) в смеси обнаружены лишь ацетил-нитрат и уксусная кислота. Максимальное содержание азотного ангидрида наблюдается в смесях, содержащих 85-90% (мол.) HNO3 и 10-15% (мол.) уксусного ангидрида. Азотный ангидрид существует при этом в виде ковалентных молекул. При содержании HNO3 в смеси более 90% (мол.) азотный ангидрид полностью диссоциирует на ионы. В такой смеси может присутствовать также протонированный ацетилнитрат
HNO3 + CH3COONO2 <=> (CH3COHONO2)+ + NO3-
количество которого заметно возрастает при добавлении даже небольших количеств серной кислоты:
CH3COONO2 + H2SO4 <=> CH3COONO2H+ + HSO4-
Для протонированного ацетилнитрата возможна диссоциация:
CH3COONO2H+ <=> CH3COOH + NO2+
CH3COONO2H+ + NO3- <=> CH3COOH + N2O5
С уксусной кислотой азотная кислота не взаимодействует, происходит лишь разрушение димеров азотной кислоты, существование которых было доказано физико-химическими методами, а затем образование комплекса кислота — растворитель за счет водородной связи:
CH3COOH + HNO3 <=> CH3COOH••• HNO3
Другие органические соединения, например хлорированные углеводороды, ведут себя аналогичным образом.
| ДонНТУ | Портал магистров | Биография | Автореферат | Библиотека | Ссылки | Отчет о поиске |