Авторы: М.В. Пьянков, И.Н.Крутько, Л.И. Рублева
Время и место издания: 15-17 апреля 2005 г., г. Донецк, ДонНТУ. Сборник тезисов, т. 2, с. 156-157
Стерическое влияние орто-алкильных групп при гидролизе аренсульфохлоридов
Алкан- и аренсульфохлориды являются реагентами в процессах обесфеноливания сточных вод ряда производств методом сульфонилирования. В связи с этим исследование их реакционности в водно-органических смесях представляет интерес для выбора оптимальных условий процесса.
С целью получения сведений о влиянии эффектов среды и структуры субстрата на характер переходных состояний в процессах замещения в производных сульфокислот исследована кинетика нуклеофильного замещения у атома серы сульфогруппы в условиях нейтрального гидролиза в водном диоксане различной полярности в интервале температур 303-323 К.
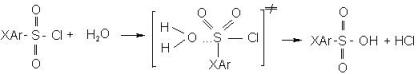 Объекты исследования – ароматические сульфогалогениды общей формулы ХАrSO2Cl, где Х – алкильные заместители в положениях 2-, 2,4- или 2,4,6 – бензольного кольца.
Объекты исследования – ароматические сульфогалогениды общей формулы ХАrSO2Cl, где Х – алкильные заместители в положениях 2-, 2,4- или 2,4,6 – бензольного кольца.
Методы исследования : кислотно-основное титрование, спектрофотометрические измерения.
Выборочные результаты кинетических измерений представлены в таблице.
Таблица 1 - Значения констант скорости kэфф•10-4 (1/с) для гидролиза ХАrSO2Cl в водном диоксане,313 К
| N соединения | X | Растворитель, %(объемн.) диоксана в воде |
| 60 | 50 | 40 | 0,5, 298К |
| I | 2,4,6-iPr3 | 1,15 | 2,98 | 5,63 | 42,5 |
| II | 2,6-Me2-4-t-Bu | 11,7 | 29,5 | 74,1 | 882 |
| III | 2,6-Me2-4-i-Pr | 12,0 | 32,41 | 70,8 | 858 |
| IV | 2,4,6-Me3 | 13,2 | 34,2 | 87,0 | 820 |
| V | 2-Me | 5,01 | 10,7 | 22,9 | 41,7 |
| VI | H | 4,60 | 9,57 | 19,5 | 29,2 |
| VII | 2,4-Br2 | 6,87 | 15,0 | 25,2 | 22,4 |
| VIII | 2-NO2 | 35,1 | 46,3 | 60,1 | 24,8 |
Примечание. Ошибка кинетических измерений не превышает 3%
При увеличении полярных свойств среды ( возрастании содержания протонного компонента смеси) скорость всех исследованных субстратов возрастает, но не в одинаковой мере. Наиболее чувствительны к изменению структуры растворителя соединения, содержащие электронодонорные замещающие группы, наименее – с электроноакцепторными заместителями. Следует отметить, что селективность к составу растворителя особенно ярко выражена для объемных орто-алкильных заместителей, находящихся вблизи реакционного центра.
При дальнейшем увеличении содержания воды в смеси вплоть до 99,5% темп увеличения реакционности субстратов снижается, исключая соединения II-IV (см.табл.1). 4-Br- и 4-NO2 – замещенные соединения демонстрируют даже падение реакционности,причем у (VIII) отношение k40 / k0,5 достигает 2,4 раз. Напротив, для 2,6 -диметилсодержащих сульфохлоридов (II-IV) происходит резкий рост скорости гидролиза более, чем в 10 раз.
Подобная неоднородность во влиянии структурных эффектов субстрата можно отнести к изменению стереоэлектронного состояния молекулы в процессе нуклеофильной атаки. Очевидно, что заместители различной природы по разному влияют на конформационные особенности переходного состояния SN2-типа реакции гидролиза. Кинетические данные табл.1 обработаны по линейным уравнениям.
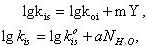 где m – параметр чувствительности реакционной серии к эффектам полярности среды (Y). Индексы i и s относятся к структуре субстрата и среды соответственно, k0 - константы скорости гидролиза в стандартных условиях (80% этанол-водном растворе). N - мольная доля воды в системе, k - гипотетическая константа скорости в чистом диоксане. Результаты приведены в табл.2.
где m – параметр чувствительности реакционной серии к эффектам полярности среды (Y). Индексы i и s относятся к структуре субстрата и среды соответственно, k0 - константы скорости гидролиза в стандартных условиях (80% этанол-водном растворе). N - мольная доля воды в системе, k - гипотетическая константа скорости в чистом диоксане. Результаты приведены в табл.2.
Таблица 2 - Регрессионные параметры уравнений
| N соединения | M | A |
| I | 0,57 | 5,30 |
| II | 0,62 | 4,68 |
| III | 0,60 | 5,53 |
| IV | 0,61 | 5,58 |
| V | 0,45 | 4,35 |
| VI | 0,50 | 4,57 |
| VII | 0,40 | 3,67 |
| VIII | 0,19 | 1,73 |
Примечание. Примечание: s 0,01-0,06 , r 0,99
Субстраты (I-IV) характеризуются повышенной чувствительностью к ионизирующей силе растворителя и, соответственно, большими величинами а по сравнению с n-замещенными производными (табл.2). Известно, что при данных компонентов бинарной смеси структурные особенности растворителя изменяются мало. Отсюда, столь высокое значение а можно отнести за счет повышенной способности к образованию ассоциатов с протонным компонентом среды (Н2О) для алкиларенсульфохлоридов.
По нашему мнению, полученные экспериментальные данные свидетельствуют о сильном специфическом взаимодействии I-IV со смешанным растворителем,а механизм сольватации в этом случае определяется структурными особенностями субстрата.
 Объекты исследования – ароматические сульфогалогениды общей формулы ХАrSO2Cl, где Х – алкильные заместители в положениях 2-, 2,4- или 2,4,6 – бензольного кольца.
Объекты исследования – ароматические сульфогалогениды общей формулы ХАrSO2Cl, где Х – алкильные заместители в положениях 2-, 2,4- или 2,4,6 – бензольного кольца.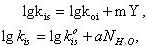 где m – параметр чувствительности реакционной серии к эффектам полярности среды (Y). Индексы i и s относятся к структуре субстрата и среды соответственно, k0 - константы скорости гидролиза в стандартных условиях (80% этанол-водном растворе). N - мольная доля воды в системе, k - гипотетическая константа скорости в чистом диоксане. Результаты приведены в табл.2.
где m – параметр чувствительности реакционной серии к эффектам полярности среды (Y). Индексы i и s относятся к структуре субстрата и среды соответственно, k0 - константы скорости гидролиза в стандартных условиях (80% этанол-водном растворе). N - мольная доля воды в системе, k - гипотетическая константа скорости в чистом диоксане. Результаты приведены в табл.2.