| ДонНТУ>
Портал магистров ДонНТУ
Авторы: К.Ю. Скопин, М.В. Пьянков, Л.И. Рублева
Время и место издания: 11-13 апреля 2004 г., г. Донецк, ДонНТУ. Сборник тезисов, т. 2, с. 162-163
Неоднотипное влияние орто-заместителей в условиях гидролиза аренсульфохлоридов
Для обесфеноливания промышленных стоков методом сульфонилирования перспективно использование сульфохлоридов. Этот метод, в отличие от традиционных, позволяет количественно извлекать фенолы из сточных вод коксохимических производств, что экономически более целесообразно по сравнению с применяемой сейчас методикой.
Выбор реагента обесфеноливания определяется его реакционной активностью в условиях фенолиза в водно-органических средах, где конкурирующим с этим процессом будет гидролиз применяемых аренсульфохлоридов:
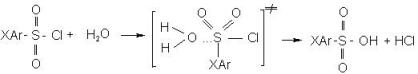 Известно, что изучаемая реакция бимолекулярна по типу Sn2, что соответствует ускорению ее электроноакцепторными заместителями, приводящими к увеличению электрофильной реакционной способности атома серы в сульфогруппе – центра нуклеофильной атаки.
Известно, что изучаемая реакция бимолекулярна по типу Sn2, что соответствует ускорению ее электроноакцепторными заместителями, приводящими к увеличению электрофильной реакционной способности атома серы в сульфогруппе – центра нуклеофильной атаки.
Цель представленной работы: исследование влияния орто-заместителей различной электронной природы на реакционность субстрата в условиях водно-органических сред.
Объект исследования: аренсульфохлориды XArSO2Cl, где Х = 2,4,6-iPr3; 2,4,6-Me3; 2-Me; 2,4-Br2; 2-NO2.
Метод исследования: кислотно-основное титрование., спектрофотометрические измерения.
Условия проведения эксперимента: 70% водный диоксан (объемн.), 303-323К.
Результаты кинетических измерений приведены в таблице.
Таблица - Значения констант скорости kэфф•10-4 (1/с) и термодинамических параметров ПС для гидролиза XArSO2Cl в 70% водном диоксане
| N соединения | X | 303К | 313К | 323К | dН кДж/моль | dS Дж/(моль*К) |
| I | 2,4,6-iPr3 | 0,168 | 0,351 | 0,92 | 66,5 | 70,0 |
| II | 2,4,6-Me3 | 2,02 | 4,47 | 9,46 | 60,2 | 69,6 |
| III | 2-Me | 1,09 | 2,25 | 4,58 | 57,8 | 89,4 |
| IV | 2,4-Br2 | 1,11 | 2,43 | 6,43 | 68,8 | 46,5 |
| V | 2-NO2 | 0,75 | 1,86 | 3,06 | 54,7 | 95,4 |
Примечание. Ошибка кинетических измерений не превышает 3%
Интересным является то, что реакционная способность бром- и нитро-замещенных субстратов меньше аналогичных орто-метил производных, что, казалось бы, вступает в противоречие с подавляющим большинством изученных в литературе процессов замещения у сульфонильной серы и соответствует маловероятному мономолекулярному Sn1 механизму. Однако, исследования процесса гидролиза на аналогичных субстратах XArSO2Cl с м- и п-замещающими группами различной электронной природы подтвердили реакцию, протекающую по типу Sn2. На рисунке показана зависимость lg k от электронной природы заместителя для м- и п-бензолсульфохлоридов (А) и отклонения от нее для соединений I-V.
В ходе активации координационное число атома серы в центре электрофильности возрастает с 4 до 5, поэтому реакции Sn2 характеризуются наличием стерических препятствий: орто-заместители в субстрате должны замедлять скорость замещения. В нашем случае и здесь несоответствие: электроноакцепторные группы (IV, V, таблица) не противоречат этому подходу, электронодонорные, напротив, ускоряют замещение. Возможно, неоднозначность во влиянии заместителей связана с изменением строения реагирующих соединений в пределах реакционной серии. В таком случае подобный факт должен найти отражение в величинах параметров активации переходного состояния (ПС).
 Энтальпия активации с учетом расчетной ошибки изменяется незначительно. Наблюдается тенденция к увеличению активационного барьера при накоплении пространственных препятствий у электрофильного центра. При этом данный факт не снижает реакционность I-III (таблица), напротив, происходит увеличение скорости замещения. 2-Нитробензолсульфохлорид (V) при самом низком в наборе значении энтальпии активации демонстрирует минимум реакционной способности. Очевидно, определяющую роль играют пространственная упаковка ПС, отражающаяся на величинах dS, и соответственно этому, реализация переходных состояний различной структуры в пределах Sn2-типа. Это противоречит сложившимся представлениям о наличии единого тригонально-бипирамидального ПС в условиях бимолекулярного Sn2 механизма.
Энтальпия активации с учетом расчетной ошибки изменяется незначительно. Наблюдается тенденция к увеличению активационного барьера при накоплении пространственных препятствий у электрофильного центра. При этом данный факт не снижает реакционность I-III (таблица), напротив, происходит увеличение скорости замещения. 2-Нитробензолсульфохлорид (V) при самом низком в наборе значении энтальпии активации демонстрирует минимум реакционной способности. Очевидно, определяющую роль играют пространственная упаковка ПС, отражающаяся на величинах dS, и соответственно этому, реализация переходных состояний различной структуры в пределах Sn2-типа. Это противоречит сложившимся представлениям о наличии единого тригонально-бипирамидального ПС в условиях бимолекулярного Sn2 механизма.
Главная страница
 Известно, что изучаемая реакция бимолекулярна по типу Sn2, что соответствует ускорению ее электроноакцепторными заместителями, приводящими к увеличению электрофильной реакционной способности атома серы в сульфогруппе – центра нуклеофильной атаки.
Известно, что изучаемая реакция бимолекулярна по типу Sn2, что соответствует ускорению ее электроноакцепторными заместителями, приводящими к увеличению электрофильной реакционной способности атома серы в сульфогруппе – центра нуклеофильной атаки. Энтальпия активации с учетом расчетной ошибки изменяется незначительно. Наблюдается тенденция к увеличению активационного барьера при накоплении пространственных препятствий у электрофильного центра. При этом данный факт не снижает реакционность I-III (таблица), напротив, происходит увеличение скорости замещения. 2-Нитробензолсульфохлорид (V) при самом низком в наборе значении энтальпии активации демонстрирует минимум реакционной способности. Очевидно, определяющую роль играют пространственная упаковка ПС, отражающаяся на величинах dS, и соответственно этому, реализация переходных состояний различной структуры в пределах Sn2-типа. Это противоречит сложившимся представлениям о наличии единого тригонально-бипирамидального ПС в условиях бимолекулярного Sn2 механизма.
Энтальпия активации с учетом расчетной ошибки изменяется незначительно. Наблюдается тенденция к увеличению активационного барьера при накоплении пространственных препятствий у электрофильного центра. При этом данный факт не снижает реакционность I-III (таблица), напротив, происходит увеличение скорости замещения. 2-Нитробензолсульфохлорид (V) при самом низком в наборе значении энтальпии активации демонстрирует минимум реакционной способности. Очевидно, определяющую роль играют пространственная упаковка ПС, отражающаяся на величинах dS, и соответственно этому, реализация переходных состояний различной структуры в пределах Sn2-типа. Это противоречит сложившимся представлениям о наличии единого тригонально-бипирамидального ПС в условиях бимолекулярного Sn2 механизма.