Отчет о поиске | Индивидуальное задание
ЭЛЕКТРОННАЯ БИБЛИОТЕКА
Д. Г. МАТВИКНКО, Н .Т. ЯРЫМ-АГАЕВ
Система хлорид натрия - диэтиленгликоль - бензол
![]()
![]()
Экспериментально исследована взаимная растворимость в трехкомпонентной системе диэтиленгликоль(ДЭГ) - бензол — хлорид натрия при 25, 145 и 1600 С. Описана простая методика определения растворимости хлорида натрии в смесях ДЭГ - бензол при повышенных температурах.
Добавление к ДЭГ бензола понижает растворимость хлорида натрия. При повышении температуры растворимость хлорида натрия как в ДЭГ, так и в смесях ДЭГ — бензол уменьшается, а растворимость бензола в ДЭГ увеличивается, причем при 145 и 160°С ДЭГ и бензол неограниченно смешиваются в присутствии избытка хлорида натрия. Диэтиленликоль (ДЭГ), который широко используется в промышленности для осушки природного газа и селективного поглощения ароматических углеводородов, хорошо растворяет бензол. Система ДЭГ — бензол при температурах, близких к комнатной, гетерогенна в широкой области составов (при 25° С от 32 до 97 масс.% бензола); повышение температуры ведет к сужению области гетерогенности, и выше 88°С компоненты неогрениченно растворимы друг в друге [1]. Наряду с этим ДЭГ, являющийся полярным растворителем, в заметных количествах растворяет некоторые минеральные соли, в частности, хлорид натрия (4,2 масс.% NаСl при 25° С), и растворимость последнего в ДЭГ падает при повышении темпера туры [2, З]. Хлорид натрия практически нерастворим в таком неполярном растворителе, как бензол. Цель настоящей работы — выяснение влияния хлорида натрия и бензола на их растворимость в ДЭГ при различных температурах. Имеющаяся информация о растворимости в двухкомпонентных системах позволяет наметить общие контуры диаграммы растворимости тройной системы, составленной из ДЭГ, бензола и хлорида натрия, и характер изменения изотермических сечений в зависимости от температуры. На основании этих данных можно полагать, что увеличение содержания бензола в тройной системе и повышение температуры будет приводить к уменьшению растворимости хлорида натрия. Для получения количественных зависимостей было проведено экспериментальное определение растворимости в тройной системе ДЭГ - бензол — хлорид натрия. Из-за летучести бензола экспериментальное исследование растворимости при температурах 25, 145 и 160°С проводили в герметически закрывающихся сосудах. Общая схема установки по определению растворимости приведена на рис. 1. Установка состоит из ультратермостата ТС-15 (1), термостатирующего стакана 2, в который помещали герметически закрывающийся сосуд 3 с ДЭГ, бензолом и хлоридом натрия. Содержимое сосуда 3 перемешивается с помощью магнитной мешалки 4. Температура термостатирующей среды в стакане 2 измеряется нормальным термометром 5. При 25° С в качестве герметически закрывающегося сосуда использовали стеклянные сосуды с притертыми пробками, а при высоких температурах, когда давление насыщенного пара бензола достигает нескольких атмосфер — латунные сосуды с навинчивающейся пробкой, Герметичность достигалась с помощью свинцовых и тефлоновых прокладок При 25° С в системе ДЭГ—бензол—хлорид натрия возможно образование трех конденсированных фаз: двух жидких (бензольной и диэтиленгликолевой) и одной твердой (хлорид натрия). На рис. 2 схематически изображено изотермическое сечение диаграммы этой системы при 25° С. Трехкомпонентная диэтиленгликолевая фаза может образовывать растворы, насыщенные бензолом (рис- кривая АВ), и растворы, насыщенные хлоридом натрия (рис. 2, кривая ВС), а также раствор единственного состава, насыщенный и бенолом, и хлоридом натрия одновременно. Составы растворов, отвечающие точкам на кривой АВ, находили следующим образом. Во взвешенный стеклянный сосуд 3 помещали навеску ненасыщенного при комнатной температуре раствора хлорида натрия в ДЭГ. Рисунок 1 – Общая схема установки по определению растворимости в системе диэтиленгликоль - бензол- хлорид натрия; 1- термостат; 2- термостатирующий стакан; 3 - герметически закрывающийся сосуд; 4 - магнитная мешалка; 5 - термометр Рисунок 2 – Схематическое изображение сечения диаграммы состояния системы диэтиленгликоль - бензол - хлорид натрия при 25° С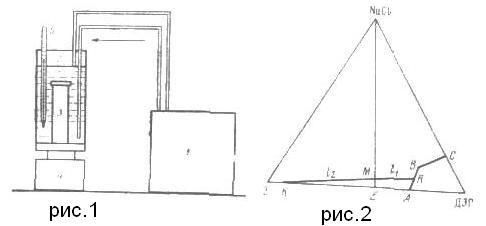
Для определения положения точек на кривой растворимости ВС (рис. 2) в сосуд 3 помещали навески ДЭГ и бензола, а также избыточна количество хлорида натрия. Навеску бензола брали такой, чтобы в присутствии избытка хлорида натрия образовывалась одна жидкая фаза. При термостатировании содержимое сосуда 3 перемешивали до образования трехкомпонентного раствора, насыщенного хлоридом натрия (равновесие устанавливалось в течение 1 ч), затем перемешивание прекращали (происходило оседание твердой фазы при температуре эксперимента) и отбирали пробу раствора для анализа на содержание хлорида натрия.
Как показал эксперимент, содержание хлорида натрия в бензольном растворе, насыщенном ДЭГ и хлоридом натрия, составляет менее 0,01%. поэтому па изотермическом сечении диаграммы точка, соответствующая этому раствору, практически совпадает с точкой бензольного раствора, насыщенного ДЭГ в отсутствие хлорида натрия (рис. 2, точка К).
Отчет о
поиске | Индивидуальное
задание