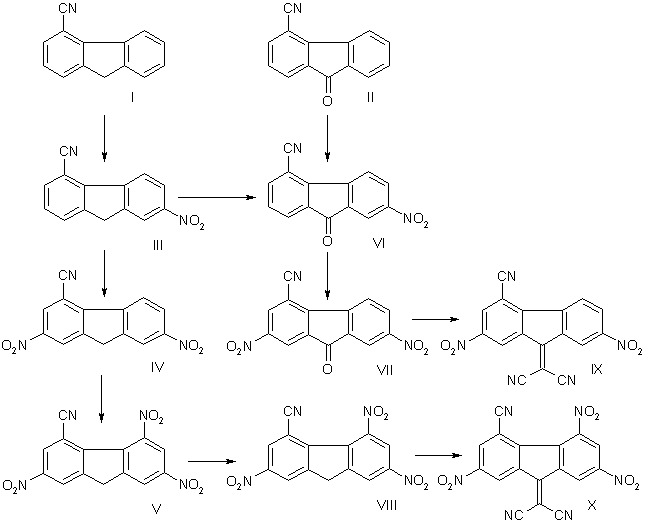
ЛАТВИЙСКИЙ ХИМИЧЕСКИЙ ЖУРНАЛ, 1991 г., №6, с. 727 - 735
УДК 547.678.3:543.2
Д. Д. Мысык, И. Ф. Перепичка, А. С. Эджиня, О. Я. Нейланд
ЭЛЕКТРОНОАКЦЕПТОРЫ ФЛУОРЕНОВОГО РЯДА IV. СИНТЕЗ И ОЦЕНКА ПО РЕДОКСПОТЕНЦИАЛАМ ЭЛЕКТРОНОАКЦЕПТОРНЫХ СВОЙСТВ НИТРОЗАМЕЩЕННЫХ 4-ЦИАНОФЛУОРЕНОВ
Донецкий политехнический институт Рижский технический университет
Полинитрофлуореноны и 9-дицианометиленполинитрофлуорены являются широко известными нейтральными органическими π-кислотами со сродством к электрону (ЕА) порядка 2—2,5 эВ [1]. Они образуют с полиядерными углеводородами устойчивые комплексы с переносом заряда (КПЗ) [2—5], поглощающие излучение в видимой части спектра и обладающие свойствами полупроводников и фотопроводников. Благодаря этому флуореновые акцепторы широко используются в качестве сенсибилизаторов фотопроводимости карбазолсодержащих полимеров при создании электрофотографических и фототермопластических материалов для регистрации оптической информации [6—8].
Цианогруппа является довольно сильным акцепторным заместителем, сопоставимым по силе с нитрогруппой (гамметовские константы σп(CN)=0,66 и σп(N02)=0,778 [9]), и в ряде работ [10—13] были получены и исследованы электроноакцепторы флуоренового ряда, содержащие в бензольных кольцах CN-группы.
Ранее [12] нами был описан синтез полинитро-4-цианофлуоренов и их 9-дицианометиленовых производных, которые являются сильными акцепторами электронов (ЕА≥2 эВ) и представляют интерес для исследования КПЗ, а также в качестве сенсибилизаторов фототермопластических материалов [13]. В развитие этих исследований в настоящей работе наряду с нитро-4-цианофлуоренонами описаны нитро-4-цианофлуорены и их вольт-амперные характеристики, по которым оценены электроноакцепторные свойства молекул.
Синтез нитро-4-цианофлуоренов и нитро-4-цианофлуоренонов осуществлен постадийным нитрованием 4-цианофлуорена (I) и 4-циано-флуоренона (II). Соединения I и II вначале нитруются предпочтительно в 7, а затем в положение 2. Исчерпывающее нитрование 4-цианофлуорена (I) меланжем состава 90% НNО3 и 7,5% Н2S04 при комнатной температуре приводит к образованию 2,5,7-тринитро-4-цианофлуорена (V), тогда как ввести третью нитрогруппу в 2,7-динитро-4-цианофлуоренон (VII) не удается из-за гидролизя цианогруппы при повышенной температуре нитрования [12].
Нитро-4-цианофлуорены (III – V) окисляются хромовым ангидридом в уксусном ангидриде до соответствующих нитро-4-цианофлуоре-нонов (VI – VIII), что подтверждает их строение. Окисление V хромовым ангидридом протекает и в нитрующей среде, что позволило осуществить одностадийный синтез 2,5,7-тринитро-4-цианофлуоренона (VIII) из I.

Полинитрофлуореноны реагируют с малонодинитрилом в присутствии оснований в качестве катализаторов с образованием соответствующих 9-дицианометиленполинитрофлуоренов [4]. Так, конденсация 2,7-динитро-4-цианофлуоренона (VII) с малонодинитрилом, приводящая к 2,7-динитро-4-циано-9-дицианометиленфлуорену (IX), была осуществлена в метаноле в присутствии гексаметиленимина [12] и в диоксане в присутствии анионита марки АБ-17-8 [13]. Нами установлено, что в диметилформамиде конденсация полинитро-4-цианофлуоренонов (VII, VIII) с малонодинитрилом протекает гладко при комнатной температуре даже в отсутствие катализаторов и соответствующие 9-дицианоме-тиленфлуорены (IX, X) образуются с прекрасными выходами.
Спектральные характеристики синтезированных соединений представлены в табл. 1.
Сродство к электрону ряда полинитрофлуоренонов и 9-дицианоме-тиленполинитрофлуоренов было оценено [5] по значениям максимумов длинноволнового поглощения их КПЗ с полиядерными углеводородами и по потенциалам полуволн их полярографического восстановления (Е1/2). Метод полярографии был также использован для определения констант комплексообразования флуореновых акцепторов с полиядерными углеводородами [14].
Для оценки влияния заместителей на электроноакцепторные свойства замещенных 4-цианофлуоренов (II – X) нами были использованы потенциалы их электрохимического восстановления, определенные методом циклической вольтамперометрии. На рис. 1 показана вольт-амперная кривая, типичная для нитрозамещенных флуоренов (кривая 1,а). Первая волна на вольтамперограммах 1, 2 (рис. 1) соответствует одноэлектронному восстановлению замещенных 4-цианофлуоренов с образованием соответствующих анион-радикалов (1):
Fl + e → Fl-, (1)
Таблица 1 ИК- и УФ-спектры 4-цианофлуоренов (1–Х)
| № соединения | ИК-спектр, V, см-1 | УФ-спектр, λmax, нм (ε) |
| I | 2238 (C≡N), 1595, 1465, 1437, 1410, 1350, 1340, 1308, 1270, 1240, 1202, 1180, 1166, 1082, 1040, 1015, 988, 962, 910, 865, 837, 795, 735 | 224(17000), 230(18000), 237,5(17300), 263(16600), 272 пл (14300), 308(11900), 319(13700) |
| II | 2240 (C≡N), 1730 (С=0), 1617, 1588, 1465,1435, 1310, 1260, 1210, 1180, 1167, 1097,970, 862, 832, 782, 742, 690 | 220,5(19900), 258(45900), 268(64000), 291(4320), 302(6340), 318(2870), 332(1170) |
| III | 3120 (С—Н), 3110 (С—Н), 2238 (C≡N), 1627, 1595, 1550 (NO2), 1540 (NO2), 1532, 1450, 1400, 1352 (NO2), 1325, 1295, 1240, 1208, 1198, 1187, 1170, 1142, 1092, 1080, 1015, 992, 960, 925, 892, 852, 822, 795, 780, 742 | 329(23700) |
| IV | 3115, 3100 (С—Н), 2250 (C≡N), 2240 (C≡N), 1610, 1542 (NO2), 1460, 1400, 1330 (NO2), 1260, 1/230, 1202, 1185, 1140, 1102, 1083, 1015, 965, 937, 922, 880, 858, 820, 797, 763, 743, 727 | 221(16300), 307 пл (18200), 334(30200) |
| V | 3110 (С—Н), 2250 (C≡N), 1610, 1560 (NO2), 1550 (NO2), 1460, 1360 (NO2), 1330 (NO2), 1280, 1248, 1230, 1185, 1155, 1110, 1010, 980, 957, 930, 920, 907, 877, 820, 798, 783, 750, 740, 710, 695, 675 | 236 пл (17400), 302(17100), 342(24800) |
| VI | 3120 (С—Н), 3095 (С—Н), 2246 (C≡N), 1743 (С=0), 1625, 1597, 1553 (NO2), 1545 (NO2), 1365 (NO2), 1310, 1280, 1260, 1235, 1175, 1135, 1080, 990, 930, 865, 830, 787, 772, 740 685 | 252,5(23700), 278(29300), 305 пл (10100), 327(7900), 341,5(7050) |
| VII | 3110–3070 (С—Н), 1738 (С=0), 1615, 1595, 1545 (NO2), 1455, 1415, 1355 (NO2), 1320, 1310, 1245, 1173, ИЗО, 1090, 1070, 1030, 995, 955, 938, 900, 865, 835, 795, 745, 740, 720 | 280(39700), 286(40300), 313(11300), 330,5(11000), 345,5(10800) |
| VIII | 3110 (С—H), 3095 (С—Н), 2250 (C≡N), 1748 (С=0), 1628, 1602, 1565 (NO2), 1550 (NO2), 1465, 1360 (NO2), 1313, 1260, 1225, 1210, 1103, 1055, 950, 935, 925, 832, 797, 790, 745, 720, 675 | 232,5(26700), 279 пл (31800), 285(33300), 322(9170), 341(9100) |
| IX | 3125 (С—Н), 3105 (С—Н), 2240 (C≡N), 1610, 1595, 1545 (NO2), 1455, 1418, 1358 (NO2), 1320, 1290, 1220, 1205, 1105, 1030, 960, 930, 915, 905, 855, 810, 783, 760, 735, 715, 670 | 245(20000), 296 пл (48500), 304(50400), 344(21200), 361(19900) |
| X | 3140 (С—Н), 3110 (С—Н), 2250 (C≡N), 2240 (C≡N), 1615, 1600, 1565 (NO2), 1550 (NO2), 1465, 1430, 1410, 1355 (NO2), 1320, 1280, 1240, 1220, 1200, 1120, 1050, 935, 915, 840, 812, 795, 760, 750, 735, 710, 675 | 220(34100), 302(44500), 353(19400), 371(19500) |
В случае нитросоединений наряду с флуореновой системой возможно также восстановление нитрогруппы и протекание последующих химических реакций, о чем свидетельствует большое число пиков на вольт-амперограмме (6 пиков для соединения IX, 2 частично обратимые ступени восстановления для соединения II). Если направление развертки потенциала изменить после второй стадии восстановления (2):
Fl- + e → Fl2-, (2)
то наблюдаются две одноэлектронные, частично обратимые ступени окисления (рис. 1, кривые 1,6, 2).
Результаты вольтамперометрических измерений соединений II—X представлены в табл. 2. Влияние структурных факторов в молекулах 4-цианофлуоренов (II—X) отражается на величине потенциала первой волны циклической вольтамперограммы. Введение нитрогруппы в молекулу флуорена облегчает восстановление на 0,24—0,32 В. Замещение метиленовой группы флуореновой системы на карбонильную облегчает восстановление на 0,27–0,31В, а замена карбонильной группы на дицианометиленовую – на 0,43–0,44 В.
Таблица 2 – Потенциалы электрохимического восстановления и сродство к электрону замещённых 4-цианофлуоренов (II – X)
| № соединения | Eред/окс или Eред/(необр.), B | Сродство к электрону, ЕА, эВ | ||
| 1-ая волна | 2-ая волна | Вычислено по ур-ию (6) | Метод КПЗ [12] | |
| II | -1,14 | -1,63 | 1,38 | |
| III | -1,09 | -1,57 | 1,43 | |
| IV | -0,85 | -1,10 | 1,69 | |
| V | -0,60 | -0,90 | 1,95 | |
| VI | -0,82 | -1,22 | 1,72 | |
| VII | -0,54 -0,45 |
-0,76 -0,63 |
2,02 | 2,00 |
| VIII | -0,30 -0,18 |
-0,57 -0,43 |
2,27 | 2,30 |
| IX | -0,1 0,01 |
-0,70 -0,58 |
2,49 | 2,50 |
| X | 0,13 0,21 |
-0,42 -0.36 |
2.73 | |
Для некоторых флуореновых акцепторов, производных 4-цианофлуоренона, ранее нами были определены значения сродства к электрону по значениям максимумов длинноволнового поглощения их КПЗ с пиреном в диоксане [12]. Однако определить ЕА для всех синтезированных соединений методом КПЗ не представляется возможным ввиду наложения полос переноса заряда с полосами собственного поглощения соединений в случае слабых акцепторов (I—IV, VI).
В связи с этим нами была определена взаимосвязь между потенциалами электрохимического восстановления, измеренными в апротонной среде, и ЕА, определенными методом электронной спектроскопии (рис. 2). Определение подобной взаимосвязи для сильных электроноакцепторов, в том числе нитрозамещенных флуоренов, осуществлено разными исследователями, но эти данные трудно сопоставимы, так как потенциалы электрохимического восстановления измерены в неодинаковых условиях. Так, в работе [15], по данным циклической вольтамперометрии, на ртутном капельном электроде в метиленхлориде получено уравнение (3):
EA=2,1+0,81E1/2, (3)
а согласно данным [16]:
EA=2,49+E1/2, (4)
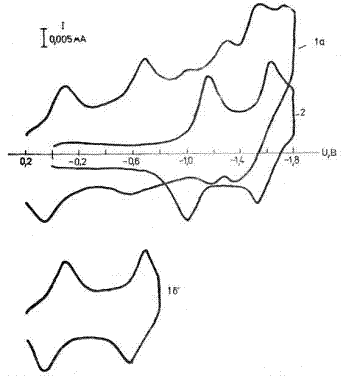 Рис. 1 – Циклические вольтамперограммы 2,7-динитро-4-циано-9-дицианометиленфлуорена (1,а,б) и 4-цианофлуоренона (2) |
 Рис. 2 – Зависимость между сродством к электрону (ЕА), определенным спектроскопически, и потенциалами электрохимического восстановления (E1/2) флуоренов: XI – 2,4,5,7-тетранитрофлуоренон, XII – 2,4,7-тринитро-9-дицианометиленфлуорен, XIII – 2,5,7-тринитро-4-октилоксикарбонил-9-дицианометиленфлуорен, XIV – 2,4,5,7-тетранитро-9-дицианометиленфлуорен |
Нами получена корреляционная прямая, которая описывается уравнением (5):
EA=(2,59 ± 0,01) + (1,06 ± 0,04)*E1/2, (5)
s=0,022 r=0,997 n=7
Это уравнение было использовано для определения ЕА 4-цианофлуоренов, для которых полоса переноса заряда перекрывается собственным поглощением акцептора. Рассчитанные таким образом величины ЕА представлены в табл. 2. Поскольку коэффициент при E1/2 в уравнении (5) близок к единице, влияние заместителей во флуореновой системе на изменения ЕА аналогично влиянию на E1/2, которое обсуждалось выше.
Синтезированный нами 2,5,7-тринитро-4-циано-9-дицианометиленфлуорен (X) является весьма сильным π-акцептором электронов (ЕА=2,73 эВ), уступающим по силе во флуореновом ряду лишь 2,4,5,7-тетранитро-9-дицианометиленфлуорену [19] (ЕА (ДТеФ)=2,77 эВ*, измеренное в тех же условиях, что и X); ΔЕА (ДТеФ – X) =0,04эВ. Соединения IX и X образуют с антраценом темно-зеленые КПЗ состава 1:1, которые могут быть выделены смешением эквимолекулярных ацетонитрильных растворов донора и акцептора (при охлаждении). В ацетонитрильных растворах этих КПЗ наблюдаются полосы переноса заряда при 608 и 664 им, для IX и X соответственно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК-спектры записаны на спектрометре UR-20 (суспензия в вазелиновом масле), УФ-спектры – на спектрофотометре «Specord М-40» в ацетонитриле.
Вольтамперные кривые сняты на потенциостате ПИ-50-1 по трехэлектродной схеме в безводном ацетонитриле относительно насыщенного хлорсеребряного электрода; рабочий электрод – стеклографит (0,27 см2), электрод сравнения – платиновая проволока. Фоновый электролит – 0,1М перхлорат тетрабутиламмония; концентрация деполяризатора – 10-4М. Скорость развертки потенциала – 200мВ/с.
Контроль за ходом реакций и чистотой соединений осуществлялся методом ТСХ на стандартных пластинках «Silufol UV-254», элюент – бензол:диоксан=4:1[17].
Флуорен-5-карбоновая кислота (XV). Смесь 200 г флуоренон-4-карбоновой кислоты [18], 150 г едкого калия и 200 мл 85%-ного гидразингидрата в 1,3 л этилен-гликоля кипятят с обратным холодильником 3 часа. Отгоняют воду и избыток гидразингидрата до тех пор, пока температура в кубе не повысится до 190оС. Остаток выливают в 4 л воды, добавляют 10 г активированного угля и через 2–3 часа фильтруют. Фильтрат подкисляют соляной кислотой до рН 2, осадок отфильтровывают, промывают водой и сушат. Получают 180 г (96%) флуорен-4-карбоновой кислоты, ТПЛ 179 – 183оС. Последовательная кристаллизация кислоты XV из толуола и из уксусной кислоты дает продукт с ТПЛ 192 – 193oС.
Амид флуорен-4-карбоновой кислоты (XVI). 60 г флуорен-4-карбоновой кислоты (XV) и 65 г пятихлористого фосфора в 500 мл сухого ксилола нагревают на масляной бане при температуре 140–150°С в течение 2 часов. Из реакционной массы отгоняют 300 мл ксилола, а остаток выливают при интенсивном перемешивании в 120 мл охлажденного до 0оС 25%-ного водного раствора аммиака. Избыток аммиака и ксилол отгоняют с водяным паром, осадок отфильтровывают, промывают водой и сушат. Получают 59 г (99%) амида XII, ТПЛ 223 – 224,5оС (из диоксана).
Найдено %: С 80.31, 80,25; Н 5,31, 5,32; N 6,57, 6,50. С14Н11NО. Вычислено %: С 80,36; Н 5,30; N 6,69.
4-Цианофлуорен (I). 55 г амида флуорен-4-карбоновой кислоты (XII) и 58 г пятихлористого фосфора в 450 мл сухого толуола нагревают на масляной бане при 120–130°С в течение 4 часов. Массу охлаждают и выливают в 500 мл воды. Толуольный раствор отделяют, промывают 5%-ным водным раствором карбоната натрия, водой и отгоняют толуол. Перегонкой остатка в вакууме получают 34 г (68%) 4-цианофлуорена (I), ТПЛ 78 – 79oС (из этанола).
Найдено %: С 88,05, 87,79; Н 5,15, 5,20; N 7,31, 7,50. С14Н9N. Вычислено %: С 87,93; Н 4,74; N 7,32.
7-Нитро-4-цианофлуорен (III). К нитрующей смеси, состоящей из 15 мл меланжа (d=1,54г/см3, состав: 90% НNО3, 7,5% Н2S04, остальное – вода) и 30 мл уксусной кислоты, при 0oС и интенсивном перемешивании прибавляют 5,73 г (0,03 моль) 4-цианофлуорена (I). Массу перемешивают 30 мин и оставляют на сутки при комнатной температуре. Выкристаллизовавшийся осадок отфильтровывают, промывают уксусной кислотой (3 раза по 10мл), метанолом и сушат. Получают 4,77г (67%) соединения III с ТПЛ 203 – 210oС. Продукт перекристаллизовывают сначала из 110мл толуола, а затем из 70мл диоксана и получают 3,25 г (46%) соединения III, ТПЛ 220 – 222оС.
Найдено %: С 71,61; Н 3,49; N 11,88. C14H8N2O2 Вычислено %: С 71,18; Н 3,40; N 11,86.
2,7-Динитро-4-цианофлуорен (IV). К нитрующей смеси, состоящей из 40 мл меланжа (90% НNО3, 7,5% Н2S04) и 30 мл уксусной кислоты, при температуре 10 – 20oС прибавляют 4,72 г (0,02 моль) 7-нитро-4-цианофлуорена (III), перемешивают до полного растворения и оставляют на сутки. Реакционную массу разбавляют 50 мл уксусной кислоты, через 2 часа осадок отфильтровывают, промывают уксусной кислотой (2 раза по 10 мл), водой и сушат. Получают 4,75 г (85%) соединения IV, ТПЛ 257 – 258oС (из диоксана).
Найдено %: С 59,65, 59,09; Н 2,38, 2,29; N 14,51, 14,63. С14Н7N3O4. Вычислено %: С 59,79; Н 2,51; N 14,94.
2,5,7-Тринитро-4-цианофлуорен (V). а) 2,81 г (0,01 моль) 2,7-динитро-4-цианофлуорена (IV) растворяют в 28 мл меланжа (90% НNО3, 7,5% Н2S04), выдерживают 1 час при комнатной температуре и выливают в воду. Осадок отфильтровывают, промывают водой и сушат. Получают 3,23 г (99%) соединения V с ТПЛ 217 – 230oС (разл.). Продукт перекристаллизовывают сначала из 80 мл ацетонитрила, а затем из 30 мл нитрометана и получают 1,55 г (48%) соединения V с ТПЛ 240 – 241oС (разл.).
б) К 100 мл охлажденного до -10°С меланжа (90% НNО3, 7,5% Н2S04) при перемешивании присыпают 5 г 4-цианофлуорена (I), массу перемешивают 1 час при 0oС и оставляют на сутки при комнатной температуре. Разбавляют смесью 20 мл воды и 200 мл уксусной кислоты, осадок отфильтровывают, промывают водой и сушат. Получают 5,4 г (63%) вещества V, ТПЛ 243 – 244oС, разл. (из нитрометана).
Найдено %: С 51,81, 52,12; Н 2,18, 2,34; N 17,29, 17,45. С14Н6N4O6. Вычислено %: С 51,55; Н 1,85; N 17,17.
7-Нитро-4-цианофлуоренон (VI). а) К смеси 10 мл меланжа (90% НNО3, 7,5% Н2S04) и 5 мл уксусной кислоты при перемешивании при комнатной температуре добавляют 1 г 4-цианофлуоренона (II) [12, 13]. Через 14 часов раствор выливают в воду, осадок отфильтровывают, промывают водой и сушат. После перекристаллизации из 15 мл толуола получают 0,9 г (74%) вещества VI, ТПЛ 230 – 231оС.
б) 1,18 г 7-нитро-4-цианофлуорена (III) суспендируют в 20 мл уксусного ангидрида и при перемешивании небольшими порциями вносят 1,2 г хромового ангидрида. Через двое суток массу выливают в воду. Образовавшийся после гидролиза уксусного ангидрида светло-желтый осадок отфильтровывают, промывают водой и сушат. Выход вещества VI – 1,25 г (100%), ТПЛ 229 – 230oС.
Найдено %: С 67,49, 67,57; Н 2,88, 3,13; N 11,61, 11,82. С14Н6N2O3. Вычислено %: С 67,20; Н 2,42; N 1.1,20.
2,7-Динитро-4-цианофлуоренон (VII). а) К смеси 1 мл меланжа (90% НNО3, 7,5% Н2S04) и 8 мл серной кислоты при перемешивании при комнатной температуре добавляют 0,62 г 7-нитро-4-цианофлуоренона (VI). Раствор выдерживают 2 часа и выливают на лед, осадок отфильтровывают, промывают водой и сушат. Получают 0,70 г (96%) вещества VII, ТПЛ 267,0 – 267,5oС (из диоксана).
б) К суспензии 0,56 г 2,7-динитро-4-цианофлуорена (IV) в 10 мл уксусного ангидрида при перемешивании добавляют 0,48 г хромового ангидрида. Через двое суток массу выливают в воду. Осадок отфильтровывают, промывают водой и сушат. Выход вещества VII – 0,58 г (98%), ТПЛ 267,0 – 267,5oС (из диоксана).
Лит. [112, 13] ТПЛ 265 – 266оС.
2,5,7-Тринитро-4-цианофлуоренон (VIII). а) К 5,3г 2,5,7-тринитро-4-цианофлуорена (V) в 65мл уксусного ангидрида добавляют 4г хромового ангидрида, массу перемешивают при комнатной температуре 2 часа и оставляют на сутки. Выкристаллизовавшийся продукт отфильтровывают, промывают уксусной кислотой, водой и сушат. Получают 4,4г (80%) вещества VIII, ТПЛ 230 – 231oС.
б) К 38 мл охлажденного до -10°С меланжа (90% НNО3, 7,5% Н2S04) при перемешиваниии добавляют 1,91г 4-цианофлуорена (I). Массу выдерживают 1 час при 0°С и 2 часа при комнатной температуре. После этого добавляют 2 г хромового ангидрида, перемешивают 20 часов и выливают в воду. Осадок отфильтровывают, промывают водой и сушат. Получают 3,1г (91%) вещества VIII с ТПЛ 219 – 221оС. После перекристаллизации из 15 мл уксусного ангидрида выход вещества VIII составляет 2,08 г (61%), ТПЛ 230 – 232оС.
Лит. [12] ТПЛ 228,5 – 229,5оС.
9-Дицианометилен-2,7-динитро-4-цианофлуорен (IX). 1,0г 2,7-динитро-4-цианофлуоренона (VII) в 5мл диметилформамида нагревают до 60oС и прибавляют 0,50г малонодинитрила. Массу перемешивают 30 мин при 50 – 60oС и оставляют на 2 часа в холодильнике при 0oС. Отфильтровывают ярко-желтые кристаллы, промывают метанолом и сушат.
Получают 1,05г (90%) вещества (IX), ТПЛ 343 – 346oС. После перекристаллизации из диоксана ТПЛ 346 – 347oС.
Лит. [12, 13] ТПЛ 339 – 340oС.
9-Дицианометилен-2,5,7-тринитро-4-цианофлуорен (X). Растворяют при небольшом подогреве 0,50г 2,5,7-тринитро-4-цианофлуоренона (VIII) в 2мл диметилформамида. К раствору при перемешивании добавляют 0,30г малонодинитрила, массу выдерживают при комнатной температуре 40 мин и разбавляют 15мл метанола. Осадок отфильтровывают, промывают метанолом и сушат. Получают 0,49г (86%) вещества X, ТПЛ 346 – 349оС. Продукт растворяют в 13мл горячего ацетонитрила и разбавляют 50мл метанола. Выход вещества X составляет 0,30г (53%), ТПЛ 361 – 362oС. Повторная кристаллизация из ацетонитрила дает продукт с ТПЛ 363 – 363,5оС.
Найдено %: С 53,10, 51,94; Н 1,17, 1,26; N 21,48, 21,64. C17H4N606. Вычислено %: С 52,59; Н 1,04; N 21,65.
Выводы. Исследовано постадийное нитрование 4-цианофлуорена и 4-цианофлуоренона, а также окисление нитрозамещенных 4-циано-флуоренов до соответствующих флуоренонов.
Методом циклической вольтамперометрии в ацетонитриле определено сродство к электрону нитрозамещенных 4-цианофлуорена и 4-цианофлуоренона по потенциалам первой стадии их электрохимического восстановления.
СПИСОК ЛИТЕРАТУРЫ
D. Misik, I. Perepichka, A. Edgina, О. Neilands
ELECTRON ACCEPTORS OF FLUORENE SERIES IV. SYNTHESIS OF NITROSUBSTITUTED 4-CYANOFLUORENES AND EVALUATION OF THEIR ELECTRON AFFINITY USING REDOX POTENTIAL VALUES SUMMARY
Nitration of 4-cyanofluorene and 4-cyanofluorenone as well as oxidation of nitrosubstituted 4-cyanofluorenes to the corresponding fluo-renones has been studied. Spectral characteristics of the obtained compounds have been determined. The electrochemical reduction potentials have been measured by the cyclic voltammetry method using the glass graphite electrode in acetonitrile solutions. The introduction of the nitro group in the fluorene molecule facilitates the reduction by 0.24—0.32 V; the substitution of methyl group in the fluorene system by the carbonyl group facilitates the reduction by 0.27—0.31 V; but the substitution of carbonyl group by dicyanomethylene group — by 0.43—0.44 V. The potentials of the first stage of the electrochemical reduction of nitrosubstituted 4-cyanofluorenes and 4-cyanofluorenones are used for determination of their electron affinity.