Мисик Д.Д., Борисенко Р.Є.
ПРО НІТРУВАННЯ ПЕРХЛОРАТУ ФЛУОРЕН-9-ІЛ-ПІРИДИНІЮ ТА СТАБІЛЬНІ ФЛУОРЕН-9-ІЛІДИ ПІРИДИНІЮ
Наукові праці Донецького національного технічного університету. Серія: Хімія і хімічна технологія. Випуск 134 (10) – Донецьк: ДонНТУ, 2008. – с.96 – 103
Досліджено нітрування перхлорату флуорен-9-іл-піридинію, в результаті якого синтезовані солі динітро- та тринітрофлуорен-9-іл-піридинію. Катіони динітро- та тринітрофлуорен-9-іл-піридинію проявляють значні кислотні властивості і перетворюються при дії основ в стабільні 2,7-динітро- та 2,4,7-тринтітрофлуорен-9-іліди піридинію.
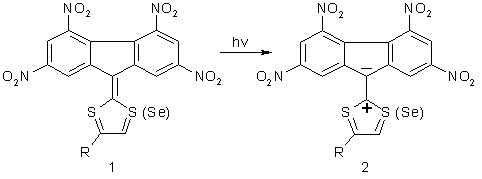
Полінітрофлуоренони привернули увагу дослідників у зв'язку із сенсибілізацією ними електропровідності полімерних напівпровідників, що містять фрагмент карбазолу (полі-N-вінілкарбазол, полі-N-епоксипропілкарбазол) [1]. Такі полімери проявляють електропровідність під дією ультрафіолетового випромінювання. Введення в них добавок три- і тетранітрофлуоренонів призводить у результаті донорно-акцепторної взаємодії з фрагментами карбазолу полімерів до утворення комплексів з міжмолекулярним переносом заряду (КПЗ) і зміщенню електропровідності у видиму область спектру. Інтенсивні дослідження композицій полімерів з добавками полінітрофлуоренонів були спрямовані на розробку функціональних матеріалів для запису, зберігання й відображення оптичної інформації [1, 2]. Створення й дослідження фото-фізичних властивостей органічних композитних матеріалів, які мають напівпровідникові властивості, стимулювало вдосконалювання й розробку синтезу їх компонентів на основі флуорену [3–5]. Серед них особливо активними виявилися 9-дитіоліліден-полінітрофлуорени та 9-селенатіоліліден-полінітрофлуорени 1, поглинання якими електромагнітного випромінювання з довжиною хвилі в районі 630 нм супроводжується переносом заряду з фрагменту гетероциклу на фрагмент флуорену, а їх збуджена форма має структуру, що наближається до структури біполярного іону 2 [6].

Переваги сполук 1 в створенні композитних матеріалів порівняно з КПЗ в їх більшому (на порядок) значенні коефіцієнту молекулярного поглинання та незалежності фото-фізичних характеристик від умов приготування композитних матеріалів [2].
Сполуки з розділеними негативним зарядом на фрагменті флуорену і позитивним на фрагменті гетероциклу, наприклад внутрішньо-іонні флуорен-9-ілиди піридинію 6, в якості сенсибілізаторів не досліджувалися. Відомості про фото-фізичні властивості композитних матеріалів, які містять внутрішньо-іонні флуоренові сполуки у літературі відсутні. Але вони могли б представити певний інтерес у розвиток уявлень про електронні переходи і механізм фото-генерації носіїв заряду в органічних напівпровідникових композитних матеріалах [2].
Метою даної роботи і є розробка синтезу та дослідження властивостей таких сполук. Одним з шляхів, який приводить до таких сполук (6), є алкілування третинних амінів 9-галогенфлуоренами з наступним дегідрогалогенуванням солей 4 основою (В):
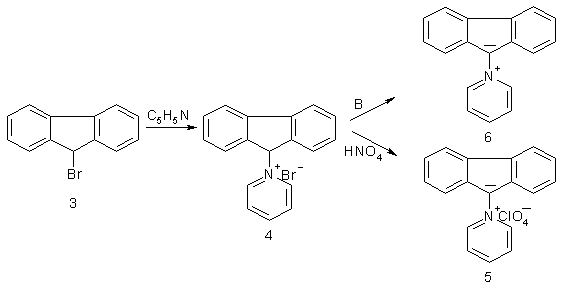
Алкілування піридину 9-бромфлуореном (3) при мольному співвідношенні реагентів близькому 1:1 було здійснено в киплячому ацетоні, але вихід броміду флуорен-9-іл-піридинію (4) не перевищував 40% [7]. Спроба виділити внутрішню сіль 6 дією на сполуку 4 основою (В) не дала бажаного результату в зв’язку з її нестійкістю [7]. Підвищити стабільність внутрішніх солей типу 6 ми спробували введенням електроноакцепторних нітроугрупуваннь.
При синтезі сполуки 4 нами встановлено, що при збільшенні мольного співвідношення між піридином та 9-бромфлуореном більш а ніж в два рази дозволяє підвищити вихід броміду флуорен-9-іл-піридинію (4) майже вдвічі, якщо алкілування проводити при звичайній температурі. Необхідний для дослідження нітрування перхлорат флуорен-9-іл-піридинію (5) синтезували обмінною реакцією броміду 4 з хлорною кислотою, яка легко відбувається при її додаванні до спиртового розчину солі 4.
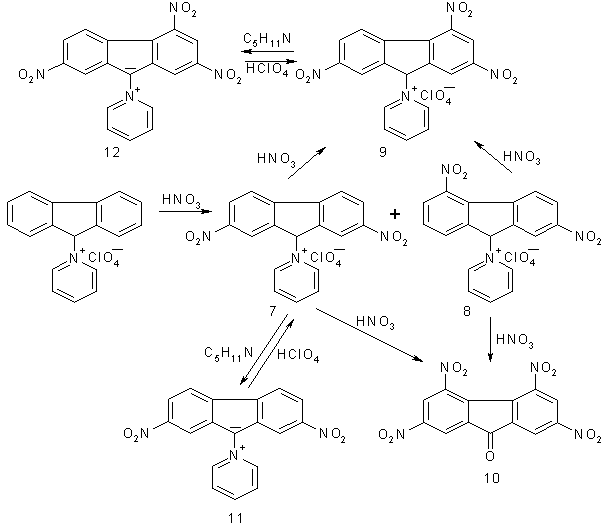
Нітрування перхлорату флуорен-9-іл-піридинію (5) проводили нітратною кислотою (конц.96%) в умовах близьких до нітрування флуорену до тетранітрофлуорену [4], 4-ціанофлуорену до тринітро-4-ціанофлуорену [5] та 2,7-флуорендисульфохлориду до 4,5-динітрофлуорендисульфохлориду [8], яке відбувається в розчині нітратної кислоти при звичайній температурі. В зазначених умовах нітрування перхлорату 5 закінчується на стадії утворення динітросполук 7, 8 з трьома електроноакцепторними замісниками у фрагменті флуорену на відміну від зазначених вище сполук, коли в результаті синтезу досягається введення чотирьох електроноакцепторних замісників. Аналіз рідинною хроматографією в сполученні з мас-спектроскопією 2,7-динітрофлуорен-9-іліду піридинію (11), що утворюється при дії піперидину на перхлорати динітросполук в диметилформаміді, показав наявність до 13% домішки іншої сполуки, ймовірно 2,5-динітроіліду, адже подальше нітрування суміші сполук 7, 8 призводить до утворення солі 2,4,7-тринітрофлуорен-9-іл-піридинію (9).
Дезактивуючий вплив фрагменту піридинію (σI=1,09) проявився сильніше, а ніж нітроугрупування (σI=0,6–0,8), ціаноугрупування (σI=0,6), хлорсульфонільного угрупування (σI=0,8) у відповідності зі значенням індуктивних констант [9]. Але цей ефект повинен бути дещо меншим, оскільки передається через ізолююче угрупування СН 9-го положення. Про це свідчить зменшення індуктивних констант при переході від СН3-NН+2-замісника (σI=0,58–0,86) до H3N+-CH2-замісника(σI=0,25–0,36) [9].
Третє нітроугрупування в перхлорати 7, 8 вдалось ввести дією суміші нітратної та сульфатної кислот при 50–60оС в умовах нітрування флуоренону до 2,4,7-тринітрофлуоренону. Це свідчить про те, що дезактивуючий вплив фрагменту піридинію дещо подібний до впливу карбонілу у флуореноні. Спроба ввести ще два нітроугрупування в перхлорати 7, 8 в умовах нітрування флуоренону до 2,4,5,7-тетранітрофлуоренону [10] не дала позитивного результату. Воно супроводжується не тільки нітруванням але й окисненням, наслідком чого являється утворення тетранітрофлуоренону (10).
Перхлорати 2,7-динітрофлуорен-9-іл-піридинію (7) та 2,4,7-тринітрофлуорен-9-іл-піридинію (9) окиснюються триоксидом хрому в оцтовому ангідриді відповідно до 2,7-динітрофлуоренону та 2,4,7-тринітрофлуоренону, що свідчить про їх будову. Вони проявляють значні кислотні властивості і перетворюються при додаванні до їх розчинів в диметилформаміді аліфатичних амінів в нітрофлуорен-9-іліди піридинію (11, 12). Ці сполуки на відміну від флуорен-9-іліду піридинію (6), який не вдалося виділити в вільному стані через вкрай низьку стійкість [7], є стійкими. Їх розчини в диметилформаміді забарвлені в темно-фіолетовий колір. В хлорній кислоті вони знову перетворюються в безбарвні перхлорати 7, 9.
Окрім хімічних перетворень будова синтезованих сполук доведена фізико-хімічними дослідженнями. В ІЧ-спектрі сполуки 5, записаного в вазеліновому маслі, мається характерна смуга поглинання перхлорат-іону при 1091 см-1, що свідчить про протікання реакції обміну бромід-іону на перхлорат-іон. Можна також констатувати наявність в області 1625–1560 см-1 скелетних коливань С=С зв’язків ароматичних фрагментів, але більш суттєву інформацію про будову перхлорату флуорен-9-іл-піридинію (5) дає спектр ЯМР 1Н. В спектрі перхлорату флуорен-9-іл-піридинію, записаного в дейтеродиметилсульфоксиді з добавкою трифтороцтової кислоти на робочій частоті 500 МГц, протони фрагменту піридинію представлені дублетом при 8,956 м.д. (С2,6-Н) та двома триплетами з центрами при 8,692 м.д. і 8,165 м.д. (С4-Н, С3,5-Н), протони фрагменту флуорену – серією сигналів в районі 8,082–7,411 м.д. Сигнал С9-Н протону фрагменту флуорену знаходиться при 7,145 м.д. Його значний зсув в слабке поле під впливом фрагменту піридинію перевищує вплив декількох електроноакцепторних хлорсульфонільних та нітроугрупуваннь, що знаходяться в бензольних кільцях. Наприклад, у 4,5-динітрофлуорен-2,7-дисульфохлориду сигнал С9-Н протону знаходиться при 4,87 м.д. [8].
Про значні кислотні властивості перхлорату 2,4,7-тринітрофлуорен-9-іл-піридинію (6) свідчать деякі особливості його спектру ЯМР 1Н в дейтеродиметилсульфоксиді. Сигнал С9-Н протону знаходиться при 7,493 м.д. і зникає у дейтеротрифтороцтовій кислоті внаслідок його повного обміну на дейтерій. Цей сигнал відсутній і у спектрі іліду 9. Окрім цього наслідком такого обміну є поява сигналу трифтороцтової кислоти при 16,103 м.д. При цьому дещо спрощується картина сигналів ароматичних протонів.
Введення трьох електроноакцепторних нітроугрупуваннь у фрагмент флуорену викликає зсув сигналу С9-Н протону в слабке поле на 0,08 м.д., що значно менше зсуву, який виникає від дії фрагменту піридинію. Дезекрануючого впливу від нітроугрупування зазнають також ароматичні протони як фрагменту флуорену, так і піридинію. Якщо у перхлорату флуорен-9-іл-піридинію (3) сигнал С2,6-Н протонів знаходиться в районі 8,955 м.д., то у 2,4,7-тринітрофлуорен-9-іліду піридинію (9) – за районом 9.00 м.д. Віднесення інших сигналів хімічних зсувів наведено в експериментальній частині.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Перхлорат флуорен-9-іл-піридинію. До розчину 3,3 г (0,0135 моль) 9-бромфлуорену, виготовленого радикальним бромуванням флуорену як описано в роботі [11], в 15 мл ацетону додавали 3,16 г (0,04 моль) піридину. Розчин залишали при кімнатній температурі на п’ять діб. Осад, що утворився, фільтрували, промивали три рази по 5 мл ацетону. Отримали 3,69 г (84,6% в розрахунку на 9-бромфлуорен) броміду флуорен-9-іл-піридинію з ТПЛ 192–194оC (195оС [7]). Бромід флуорен-9-іл-піридинію розчиняли при нагріванні в 20 мл етанолу. До теплого розчину додавали 5 мл НСІО4 (конц.61%). При стоянні відбувається кристалізація перхлорату флуорен-9-іл-піридинію. Його фільтрували, промивали 15 мл етанолу, 20 мл води. Отримали 3,52 г (75,8% в розрахунку на 9-бромфлуорен). ТПЛ 206–207оС. Спектр ЯМР 1Н (DMSO-d6 + трифтороцтова кислота), δ, м.д.: 8,956 д (2Н, С2,6-Н, С5Н5N) , 8,692 т (1Н, С4-Н, С5Н5N), 8,165 т (2Н, С3,5-Н, С5H5N); 8,079 д (2Н, С1,8-Н, С13Н9), 7,623 т (2Н, С2,7-Н, С13Н9), 7,588 д (2Н, С4,5-Н, С13Н9), 7,426 т (2Н, С3,6-Н, С13Н9), 7,145 с (1Н, С9-Н, С13Н9).
Динітрофлуорен-9-іліди піридинію. До 40 мл охолодженої до –10оС нітратної кислоти (конц.96%) при розмішуванні окремими порціями додавали 4 г перхлорату флуорен-9-іл-піридинію з такою швидкістю, щоб температура не підвищувалася вище 5оС. Розчин залишали на одну добу при кімнатній температурі. Потім його виливали в 700 г води з кригою. Осад, що утворився, фільтрували, промивали розчином 4 мл хлорної кислоти в 40 мл води та 40 мл води. Отримали 4,89 г осаду. Його розмішували в розчині 4 мл хлорної кислоти (конц.61%) в 40мл води. Суміш випаровували на водяній бані. До залишку додавали 20 мл ацетону, фільтрували. Осад промивали 20 мл ацетону. Вихід безбарвних перхлоратів динітрофлуорен-9-іл-піридинію (7, 8) склав 4,4 г (87,2% від теоретичного). ТПЛ 243–245оС. (Даний продукт без додаткової очистки був використаний для подальшого нітрування.)
4,4 г перхлоратів динітрофлуорен-9-іл-піридинію розмішували з 35 мл диметилформаміду, додавали 5 мл піперидину і продовжували перемішування при слабкому нагріванні(t<50оС) протягом 30 хвилин. Забарвлену в фіолетовий колір масу розбавляли водою. Чорний осад динітрофлуорен-9-ілідів піридинію фільтрували, промивали водою. Отриманий осад у кількості 3,38 г (100% в перерахунку на перхлорати) змішували з 50 мл ацетону, нагрівали при кипінні протягом 15 хвилин. Після охолодження масу фільтрували, осад промивали 20 мл ацетону. Вихід динітрофлуорен-9-ілідів піридинію склав 3,18 г (94,15% в перерахунку на взяті перхлорати).
Аналіз рідинною хроматографією в сполученні з мас-спектроскопією показав наявність в 2,7-динітрофлуорен-9-іліді піридинію (11) до 13% 2,5-динітрофлуорен-9-іліду піридинію (див. рис.1,2). Знайдено, %: N – 12,44. C18H11N3O4. Вирахувано, %: N – 12,6. Мас-спектр, m/z: 334,1 [M+], що відповідає складу С18Н11N3O4 (11), 335,1, 297, 270, 271,1.
2,7-Динітрофлуорен-9-ілід піридинію (11) отримали перекристалізацією 0,5 г динітрофлуорен-9-ілідів піридинію з 50 мл диметилформаміду. Вихід чорних кристалів склав 0,25 г. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 9,301 д (2Н, С2,6-Н, С5Н5N), 8,674 с (2Н, С1,8-Н, С13Н6), 8,448 д (2Н, С3,6-Н, С13Н6), 8,335 т (1Н, С4-Н, С5Н5N), 8,203 т (2Н, С3,5-Н, С5Н5N), 7,774 д (2Н, С4,5-Н, С13Н6).
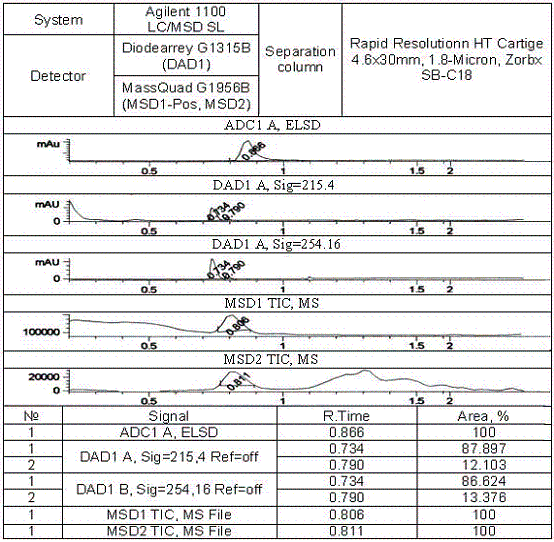
Рисунок 1 – Рідинна хроматограма динітрофлуорен-9-ілідів піридинію
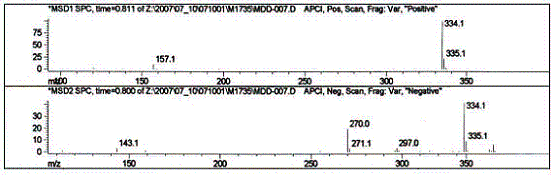
Рисунок 2 – Мас-спектр 2,7-динітрофлуорен-9-іліду піридинію
Перхлорат 2,7-динітрофлуорен-9-іл-піридинію. Розмішували 0,2 г 2,7-динітрофлуорен-9-ілиду піридинію з 3 мл хлорної кислоти (конц.61%) до повного знебарвлення осаду. Потім додавали 6 мл води, фільтрували. Осад промивали 5 мл води та 10 мл ацетону. Отримали 0,25 г (96,1%) солі 7. ТПЛ 245-246оС (з розкладанням).
Знайдено, %: С – 49,60, H – 2,93, N – 9,72, Cl – 8,66. С18Н12ClN3O8. Вирахувано, %: С – 49,86, Н – 2,55, N – 9,66, Cl – 8,17.Спектр ЯМР1Н (DMSO-d6 + трифтороцтова кислота), δ, м.д.: 9,107 д (2Н, С2,6-Н, С5Н5N), 8,748 – 8,495 м.д. (7Н, С13Н7, С5Н5N), 8,198 т (2Н, С3,5-Н, С5Н5N), 7,458 с (1Н, С9-Н, С13Н7).
2,4,7-Тринітрофлуорен-9-ілід піридинію (12). До 30 мл сульфатної кислоти (конц.96%) при розмішуванні додавали 2 г перхлоратів динітрофлуорен-9-іл-піридинію. Продовжуючи перемішування, до розчину по краплям додавали 3,2 мл нітратної кислоти (конц.96%) з такою швидкістю, щоб температура реакційної суміші зберігалась в межах 25–30оС. Температуру підвищували до 50оС і підтримували її в межах 50–60оС протягом години. До холодного розчину додавали 5 мл хлорної кислоти (конц.61%) і виливали його в 400 г криги з водою. Утворюється рихлий білий осад., який фільтрували, промивали водою. Його вихід склав 2,14 г (96,8% в перерахунку на перхлорат тринітрофлуорен-9-іл-піридинію). Сіль в кількості 2,14 г розчиняли в 15 мл диметилформаміду. До розчину додавали 1,5 мл піперидину. Утворюється чорний осад іліду 12. Масу розбавляли водою, фільтрували. Ілід обробляли 20 мл киплячого ацетону. Після фільтрування і промивання ацетоном його вихід склав 1,51 г (89,3%). ТПЛ 232–233оС. Аналіз рідинною хроматографією не виявив домішок інших сполук. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 9,370 д ( 2Н, С2,6-Н, С5Н5N); 8,884 с (1Н, С13Н5); 8,615–7,784 м (7Н, С13Н5, С5Н5). Мас-спектр, m/z: 379,1 [M+], що відповідає складу С18Н10N4O6 (12), 380,1, 315, 285.
Перхлорат 2,4,7-тринітрофлуорен-9-іл-піридинію. До 5 мл хлорної кислоти (конц.61%) при розмішуванні додавали 0,5 г 2,4,7-тринітрофлуорен-9-іліду піридинію. Відбувається швидке розчинення сполуки з утворенням осаду безбарвного перхлорату 9. Масу розбавляли 10 мл води, фільтрували, промивали 6 мл ацетону. Отримали 0,42 г (66,6% від теоретичного) перхлорату з ТПЛ 219-220оС (з розкладанням). Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 7.493 с (1Н, С9-Н, С13Н6)
2,7-Динітрофлуоренон. Суміш 10 мл оцтового ангідриду, 0,72 г перхлорату 2,7-динітрофлуорен-9-іл-піридинію та 0,7 г триоксиду хрому розмішували при температурі 70–80оС. По завершенню окиснення холодну реакційну масу розкладали 10 мл води. Осад, що утворився, фільтрували, промивали розбавленою оцтовою кислотою та водою. Отримали 0,4 г (90%) 2,7-динітрофлуоренону з ТПЛ 294оС, що відповідає літературним даним [12].
2,4,7-Тринітрофлуоренон. Суміш компонентів, що складається з 0,5 г перхлорату тринітрофлуорен-9-іл-піридинію, отриманого нітруванням перхлоратів динітрофлуорен-9-іл-піридинію, 10 мл оцтового ангідриду та 0,5 г триоксиду хрому розмішували при 80оС протягом 40 хвилин. Після охолодження масу розкладали додаванням 25 мл води. Осад фільтрували, промивали розбавленою оцтовою кислотою, водою. Вихід 2,4,7-тринітрофлуоренону склав 0,3 г (91% від теоретичного). ТПЛ 174–175оС, що відповідає літературним даним [13].
2,4,5,7-Тетранітрофлуоренон. До розчину 1 мл нітратної кислоти (конц.96%) в 6 мл сульфатної кислоти (конц.97%) додавали 0,87 г (0,002 моль) перхлоратів динітрофлуорен-9-іл-піридинію (7, 8). Розчин нагрівали на масляній бані при 100–120оС протягом двох годин. Після охолодження виливали розчин в 50 мл крижаної води. Осад фільтрували, промивали водою, кристалізували з 7мл оцтової кислоти і отримали 0,23 г 2,4,5,7-тетранітрофлуоренону з ТПЛ 249–250оС [10, 14]. Змішана проба не показала депресії температури плавлення.
©ДонНТУ Борисенко