Вернуться в библиотеку
Разработка методики расчета этаноламиновой сероочистки коксового газа
Тезисы V Международной научно-практической конференции-выставки «Экологические проблемы индустриальных мегаполисов» - Донецк 2008
Комиссарова О.В., канд. тех. наук А.Ф. Гребенюк
(Донецкий национальный технический университет. Украина)
Суть методики заключается в том, что при заданных значениях концентрации диоксида углерода CCO2
и сероводорода CH2S в поглотительном растворе определяются значения парциальных давлений этих
компонентов в очищаемом газе при равновесии путем совместного решения уравнений равновесия реакций, протекающих в
растворе:
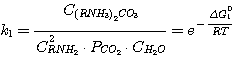
(1)
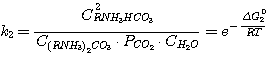
(2)
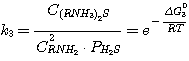
(3)

(4)
где C(RNH3)2CO3, CRNH3HCO3,
C(RNH3)2S, CRNH3HS, CRNH2 - мольные
концентрации соответствующих соединений в растворе при равновесии, кмоль/м3;
Δ G01, Δ G02, Δ G03,
Δ G04 - изменение стандартного изобарного потенциала при протекании указанных выше реакций.
Пренебрегая концентрацией свободного диоксида углерода в растворе, общую концентрацию его в растворе можно представить
как сумму концентраций карбоната и гидрокарбоната этаноламина:
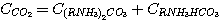
(5)
Аналогично общая концентрация сероводорода в растворе может быть представлена в виде:

(6)
Для решения системы уравнений (1), (2), (3), (4) выразим концентрации
C(RNH3)2CO3, CRNH3HCO3,
C(RNH3)2S и CRNH3HS через общие концентрации диоксида углерода
и сероводорода в растворе:
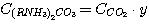
(7)
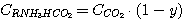
(8)
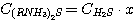
(9)
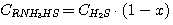
(10)
где у – доля диоксида углерода в растворе, связанного в виде C(RNH3)2CO3;
х - доля сероводорода в растворе, связанного в виде C(RNH3)2S.
Концентрация свободного этаноламина в растворе при равновесии может быть представлена в виде:
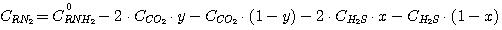
(11)
или

(12)
где С0RNH2 - начальная концентрация этаноламина в растворе, подаваемого в абсорбер.
Тогда уравнения (1), (2), (3), (4) принимают вид:
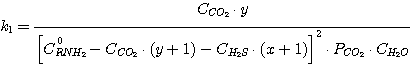
(13)
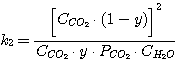
(14)
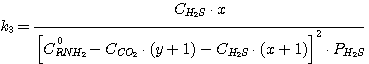
(15)
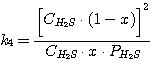
(16)
Решая совместно уравнения (13), (14), (15), (16) при известных значениях констант равновесия k1,
k2, k3, k4 и заданных значениях C0RNH2,
CCO2, CH2S, определяют значения х, у, PH2S и
PCO2.
Результаты расчетов представляют в виде графиков PCO2 - CCO2 и
PH2S - CH2S или в виде эмпирических зависимостей
PCO2 = f1(CCO2),
PH2S = f2(CH2S).
Соотношения между принимаемыми значениями CCO2 и CH2S не могут быть
произвольными, так как они определяются уравнениями рабочих линий процессов абсорбции диоксида углерода и сероводорода.
В соответствии с приведенной на рис. 1 схеме эти уравнения могут быть представлены в виде:
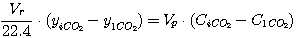
(17)
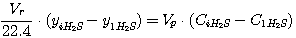
(18)
где Vr - расход газа, нм3/час;
yiCO2, yiH2S - концентрация диоксида углерода и
сероводорода в газе, кмоль/кмоль нм3 газа;
Vp - расход раствора, м3/час;
CiCO2, CiH2S - концентрация диоксида углерода и
сероводорода в растворе, кмоль/м3.
Задаваясь различными значениями yiCO2 и yiH2S в интервале концентраций
от y1 до yn, определяют значения концентраций CiCO2 и CiH2S
в различных сечениях абсорбера. Для получения значений CiCO2 и CiH2S
определяют равновесные давления диоксида углерода и сероводорода в очищаемом газе по рассмотренной методике.

Рисунок 1 – Схема распределения рабочих концентраций СО2 и H2S в газе и растворе по высоте абсорбера
Список литературы
1. Литвиненко М.С. Очистка коксового газа от сероводорода. Харьков: Металлургиздат, 1959. – 307с.
2. Касаткин А.Т. Основные процессы и аппараты химической технологии. М.: Химия, 1973. - 750с.
© ДонНТУ Комиссарова О.В. 2008
|
|
(1) |
|
|
(2) |
|
|
(3) |
|
|
(4) |
Δ G01, Δ G02, Δ G03, Δ G04 - изменение стандартного изобарного потенциала при протекании указанных выше реакций.
|
|
(5) |
|
|
(6) |
|
|
(7) |
|
|
(8) |
|
|
(9) |
|
|
(10) |
х - доля сероводорода в растворе, связанного в виде C(RNH3)2S.
|
|
(11) |
|
|
(12) |
|
|
(13) |
|
|
(14) |
|
|
(15) |
|
|
(16) |
|
|
(17) |
|
|
(18) |
yiCO2, yiH2S - концентрация диоксида углерода и сероводорода в газе, кмоль/кмоль нм3 газа;
Vp - расход раствора, м3/час;
CiCO2, CiH2S - концентрация диоксида углерода и сероводорода в растворе, кмоль/м3.
