Вернуться в библиотеку
УДК 662.764.074.395 Исследование равновесия при абсорбции сероводорода из коксового газа и регенерации поглотительного раствора вакуум-содовой сероочистки
Кокс и химия. 2000. - №9
Канд. тех. наук А.Ф. Гребенюк, Е.Ю.Гармата (ДонГГУ )
и А.В.Милютин (ОАО Авдеевский
коксохимический завод. Украина)
Равновесие в системе «сероводород - раствор воды» изучали многие исследователи [1-5].
Однако до настоящего времени в справочной и учебной литературе отсутствуют надежные данные о
равновесии между фазами при абсорбции сероводорода из коксового газа и регенерации поглотительного раствора
в производственных условиях, необходимые для инженерных расчетов основных аппаратов вакуум-карбонатной сероочистки.
Как известно, расчет этих аппаратов при проектировании выполняют по нормам УХИНа и Гппрококса,
основанным на данных эксплуатации действующих на коксохимических предприятиях установок для очистки коксового газа
от сероводорода. Нами предпринята попытка определить уравнение равновесия для указанных процессов на основе
анализа имеющихся данных исследований в лабораторных и производственных условиях.
По данным лабораторных исследований [6], равновесие в системе H2S - 1 н раствор
Na2CO3 в интервале 20-60°С описывается уравнением:
P*H2S = 5,4(t + 48)CH2S3,04
(1)
где P*H2S - равновесное
давление сероводорода в газовой фазе над раствором, мм. рт.ст.;
CH2S - концентрация сероводорода в растворе, моль/л;
t - температура раствора, °С.
В качестве инертного носителя в лабораторной установке использовали коксовый газ, очищенный от кислых
компонентов и кислорода. В присутствии углекислоты в газе давление сероводорода над раствором увеличивается.
По данным [7], это увеличение может достигать 100% в зависимости от концентрации углекислоты в растворе.
Кроме того, наличие в поглотительном растворе нерегенерируемых (балластных) солей также увеличивает давление
сероводорода над раствором. Поданным [4], зависимость давления сероводорода над раствором, содержащим
0,241 моль/л H2S, от мольной концентрации NaCNS описывается уравнением
ln P*H2S = 0,027t - 0,72CNaCNS - 2,79.
В соответствии с этим уравнением при концентрации балластных солей в поглотительном растворе 150-170 г/л
давление сероводорода увеличивается по сравнению с чистым содовым раствором в 2,7-3 раза.
При концентрации сероводорода в растворе 0,07 моль/л эта зависимость имеет вид:
ln P*H2S = 0,02t + 1,05CNaCNS - 2,96.
Таблица 1
Сечение абсорбера
Концентрация в газе, г/м3
Концентрация в растворе, моль/л
H2S
CO2
HCN
NaHS
NaHCO3
Na2COO3
Верх
3,0
39,0
0,20
0,02678
0,21422
0,39623
1
6,0
39,8
0,46
0,04885
0,24785
0,36722
2
9,0
40,6
0,72
0,07091
0,28139
0,33822
3
12,0
41,4
0,98
0,09297
0,31497
0,30920
4
15,0
42,2
1,24
0,11503
0,34849
0,28018
Низ
18,0
43,0
1,5
0,13709
0,38207
0,25117
Давление сероводорода над поглотительным раствором при укапанном концентрации балластных
солей увеличивается примерно в четыре раза.
По данным авторов [5], при концентрации балластных солей в поглотительном растворе 160-240 г/л давление
сероводорода над ним возрастает в 2,5-4 раза по сравнению с чистым содовым раствором.
С учетом приведенных данных различных исследователей уравнение равновесия в системе «коксовый газ –
сероводород - углекислый газ - поглотительный раствор» можно представить в виде:
P*H2S=17(t+48)CH2S3,04.
(2)
Наш анализ показывает, что при больших концентрациях сероводорода в растворе (≥ 5 г/л) эта зависимость дает
значения, удовлетворительно согласующиеся с производственными данными, тогда как в области малых концентраций
сероводорода в растворе (1-1,5 г/л) расчетные значения P*H2S меньше фактических на
порядок и более. Поэтому при расчете абсорберов сероводорода средняя движущая сила процесса получается в 1,5-2 раза
больше фактической, а необходимая поверхность насадки сильно заниженной против нормативной. Более того, при расчете
необходимого числа ступеней изменения концентрации в регенераторе равновесная линия в соответствии с этим уравнением
пересекается с рабочей линией и проходит выше последней при концентрациях сероводорода в растворе <3,5 г/л, тогда как при
регенерации поглотительного раствора в производственных условиях концентрация сероводорода в нем снижается
до ≤ 1,5-2 г/л.
Близкие к истинным значения давления сероводорода над поглотительным раствором могут быть получены из выражения
константы равновесия химической реакции, протекающей в абсорбере:
Na2CO3 + H2S ↔ NaHCO3 + NaHS.
По результатам исследований [2] значения константы равновесия этой реакции в интервале 25-60 °С
определяются по уравнению изобары:
lgK = 2500/4,576T - 3,16.
(3)
Здесь К = [NaHCO3][NaHS]/[Na2CO3]PH2S - константа
равновесия реакции;
[NaHCO3], [NaHS], [Na2CO3] -
концентрации соответствующих солей в растворе, моль/л;
PH2S - давление сероводорода над раствором при равновесии, мм. рт.ст.;
Т - температура раствора, К.
Отсюда равновесное давление сероводорода над поглотительным раствором данного состава
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
(4)
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000
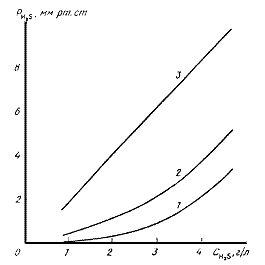
Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции
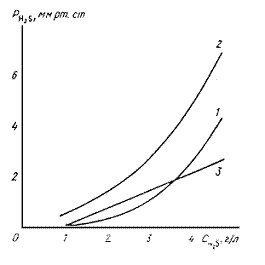
Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
P*H2S = 5,4(t + 48)CH2S3,04
|
где P*H2S - равновесное
давление сероводорода в газовой фазе над раствором, мм. рт.ст.;
CH2S - концентрация сероводорода в растворе, моль/л;
t - температура раствора, °С.
В качестве инертного носителя в лабораторной установке использовали коксовый газ, очищенный от кислых
компонентов и кислорода. В присутствии углекислоты в газе давление сероводорода над раствором увеличивается.
По данным [7], это увеличение может достигать 100% в зависимости от концентрации углекислоты в растворе.
Кроме того, наличие в поглотительном растворе нерегенерируемых (балластных) солей также увеличивает давление
сероводорода над раствором. Поданным [4], зависимость давления сероводорода над раствором, содержащим
0,241 моль/л H2S, от мольной концентрации NaCNS описывается уравнением
ln P*H2S = 0,027t - 0,72CNaCNS - 2,79.
В соответствии с этим уравнением при концентрации балластных солей в поглотительном растворе 150-170 г/л
давление сероводорода увеличивается по сравнению с чистым содовым раствором в 2,7-3 раза.
При концентрации сероводорода в растворе 0,07 моль/л эта зависимость имеет вид:
ln P*H2S = 0,02t + 1,05CNaCNS - 2,96.
Таблица 1
Сечение абсорбера
Концентрация в газе, г/м3
Концентрация в растворе, моль/л
H2S
CO2
HCN
NaHS
NaHCO3
Na2COO3
Верх
3,0
39,0
0,20
0,02678
0,21422
0,39623
1
6,0
39,8
0,46
0,04885
0,24785
0,36722
2
9,0
40,6
0,72
0,07091
0,28139
0,33822
3
12,0
41,4
0,98
0,09297
0,31497
0,30920
4
15,0
42,2
1,24
0,11503
0,34849
0,28018
Низ
18,0
43,0
1,5
0,13709
0,38207
0,25117
Давление сероводорода над поглотительным раствором при укапанном концентрации балластных
солей увеличивается примерно в четыре раза.
По данным авторов [5], при концентрации балластных солей в поглотительном растворе 160-240 г/л давление
сероводорода над ним возрастает в 2,5-4 раза по сравнению с чистым содовым раствором.
С учетом приведенных данных различных исследователей уравнение равновесия в системе «коксовый газ –
сероводород - углекислый газ - поглотительный раствор» можно представить в виде:
P*H2S=17(t+48)CH2S3,04.
(2)
Наш анализ показывает, что при больших концентрациях сероводорода в растворе (≥ 5 г/л) эта зависимость дает
значения, удовлетворительно согласующиеся с производственными данными, тогда как в области малых концентраций
сероводорода в растворе (1-1,5 г/л) расчетные значения P*H2S меньше фактических на
порядок и более. Поэтому при расчете абсорберов сероводорода средняя движущая сила процесса получается в 1,5-2 раза
больше фактической, а необходимая поверхность насадки сильно заниженной против нормативной. Более того, при расчете
необходимого числа ступеней изменения концентрации в регенераторе равновесная линия в соответствии с этим уравнением
пересекается с рабочей линией и проходит выше последней при концентрациях сероводорода в растворе <3,5 г/л, тогда как при
регенерации поглотительного раствора в производственных условиях концентрация сероводорода в нем снижается
до ≤ 1,5-2 г/л.
Близкие к истинным значения давления сероводорода над поглотительным раствором могут быть получены из выражения
константы равновесия химической реакции, протекающей в абсорбере:
Na2CO3 + H2S ↔ NaHCO3 + NaHS.
По результатам исследований [2] значения константы равновесия этой реакции в интервале 25-60 °С
определяются по уравнению изобары:
lgK = 2500/4,576T - 3,16.
(3)
Здесь К = [NaHCO3][NaHS]/[Na2CO3]PH2S - константа
равновесия реакции;
[NaHCO3], [NaHS], [Na2CO3] -
концентрации соответствующих солей в растворе, моль/л;
PH2S - давление сероводорода над раствором при равновесии, мм. рт.ст.;
Т - температура раствора, К.
Отсюда равновесное давление сероводорода над поглотительным раствором данного состава
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
(4)
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
ln P*H2S = 0,027t - 0,72CNaCNS - 2,79.
|
В соответствии с этим уравнением при концентрации балластных солей в поглотительном растворе 150-170 г/л
давление сероводорода увеличивается по сравнению с чистым содовым раствором в 2,7-3 раза.
При концентрации сероводорода в растворе 0,07 моль/л эта зависимость имеет вид:
ln P*H2S = 0,02t + 1,05CNaCNS - 2,96.
Таблица 1
Сечение абсорбера
Концентрация в газе, г/м3
Концентрация в растворе, моль/л
H2S
CO2
HCN
NaHS
NaHCO3
Na2COO3
Верх
3,0
39,0
0,20
0,02678
0,21422
0,39623
1
6,0
39,8
0,46
0,04885
0,24785
0,36722
2
9,0
40,6
0,72
0,07091
0,28139
0,33822
3
12,0
41,4
0,98
0,09297
0,31497
0,30920
4
15,0
42,2
1,24
0,11503
0,34849
0,28018
Низ
18,0
43,0
1,5
0,13709
0,38207
0,25117
Давление сероводорода над поглотительным раствором при укапанном концентрации балластных
солей увеличивается примерно в четыре раза.
По данным авторов [5], при концентрации балластных солей в поглотительном растворе 160-240 г/л давление
сероводорода над ним возрастает в 2,5-4 раза по сравнению с чистым содовым раствором.
С учетом приведенных данных различных исследователей уравнение равновесия в системе «коксовый газ –
сероводород - углекислый газ - поглотительный раствор» можно представить в виде:
P*H2S=17(t+48)CH2S3,04.
(2)
Наш анализ показывает, что при больших концентрациях сероводорода в растворе (≥ 5 г/л) эта зависимость дает
значения, удовлетворительно согласующиеся с производственными данными, тогда как в области малых концентраций
сероводорода в растворе (1-1,5 г/л) расчетные значения P*H2S меньше фактических на
порядок и более. Поэтому при расчете абсорберов сероводорода средняя движущая сила процесса получается в 1,5-2 раза
больше фактической, а необходимая поверхность насадки сильно заниженной против нормативной. Более того, при расчете
необходимого числа ступеней изменения концентрации в регенераторе равновесная линия в соответствии с этим уравнением
пересекается с рабочей линией и проходит выше последней при концентрациях сероводорода в растворе <3,5 г/л, тогда как при
регенерации поглотительного раствора в производственных условиях концентрация сероводорода в нем снижается
до ≤ 1,5-2 г/л.
Близкие к истинным значения давления сероводорода над поглотительным раствором могут быть получены из выражения
константы равновесия химической реакции, протекающей в абсорбере:
Na2CO3 + H2S ↔ NaHCO3 + NaHS.
По результатам исследований [2] значения константы равновесия этой реакции в интервале 25-60 °С
определяются по уравнению изобары:
lgK = 2500/4,576T - 3,16.
(3)
Здесь К = [NaHCO3][NaHS]/[Na2CO3]PH2S - константа
равновесия реакции;
[NaHCO3], [NaHS], [Na2CO3] -
концентрации соответствующих солей в растворе, моль/л;
PH2S - давление сероводорода над раствором при равновесии, мм. рт.ст.;
Т - температура раствора, К.
Отсюда равновесное давление сероводорода над поглотительным раствором данного состава
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
(4)
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
ln P*H2S = 0,02t + 1,05CNaCNS - 2,96.
|
Таблица 1
| Сечение абсорбера | Концентрация в газе, г/м3 | Концентрация в растворе, моль/л | ||||
|---|---|---|---|---|---|---|
| H2S | CO2 | HCN | NaHS | NaHCO3 | Na2COO3 | |
| Верх | 3,0 | 39,0 | 0,20 | 0,02678 | 0,21422 | 0,39623 |
| 1 | 6,0 | 39,8 | 0,46 | 0,04885 | 0,24785 | 0,36722 |
| 2 | 9,0 | 40,6 | 0,72 | 0,07091 | 0,28139 | 0,33822 |
| 3 | 12,0 | 41,4 | 0,98 | 0,09297 | 0,31497 | 0,30920 |
| 4 | 15,0 | 42,2 | 1,24 | 0,11503 | 0,34849 | 0,28018 |
| Низ | 18,0 | 43,0 | 1,5 | 0,13709 | 0,38207 | 0,25117 |
Давление сероводорода над поглотительным раствором при укапанном концентрации балластных
солей увеличивается примерно в четыре раза.
По данным авторов [5], при концентрации балластных солей в поглотительном растворе 160-240 г/л давление
сероводорода над ним возрастает в 2,5-4 раза по сравнению с чистым содовым раствором.
С учетом приведенных данных различных исследователей уравнение равновесия в системе «коксовый газ –
сероводород - углекислый газ - поглотительный раствор» можно представить в виде:
P*H2S=17(t+48)CH2S3,04.
(2)
Наш анализ показывает, что при больших концентрациях сероводорода в растворе (≥ 5 г/л) эта зависимость дает
значения, удовлетворительно согласующиеся с производственными данными, тогда как в области малых концентраций
сероводорода в растворе (1-1,5 г/л) расчетные значения P*H2S меньше фактических на
порядок и более. Поэтому при расчете абсорберов сероводорода средняя движущая сила процесса получается в 1,5-2 раза
больше фактической, а необходимая поверхность насадки сильно заниженной против нормативной. Более того, при расчете
необходимого числа ступеней изменения концентрации в регенераторе равновесная линия в соответствии с этим уравнением
пересекается с рабочей линией и проходит выше последней при концентрациях сероводорода в растворе <3,5 г/л, тогда как при
регенерации поглотительного раствора в производственных условиях концентрация сероводорода в нем снижается
до ≤ 1,5-2 г/л.
Близкие к истинным значения давления сероводорода над поглотительным раствором могут быть получены из выражения
константы равновесия химической реакции, протекающей в абсорбере:
Na2CO3 + H2S ↔ NaHCO3 + NaHS.
По результатам исследований [2] значения константы равновесия этой реакции в интервале 25-60 °С
определяются по уравнению изобары:
lgK = 2500/4,576T - 3,16.
(3)
Здесь К = [NaHCO3][NaHS]/[Na2CO3]PH2S - константа
равновесия реакции;
[NaHCO3], [NaHS], [Na2CO3] -
концентрации соответствующих солей в растворе, моль/л;
PH2S - давление сероводорода над раствором при равновесии, мм. рт.ст.;
Т - температура раствора, К.
Отсюда равновесное давление сероводорода над поглотительным раствором данного состава
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
(4)
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
P*H2S=17(t+48)CH2S3,04.
|
Наш анализ показывает, что при больших концентрациях сероводорода в растворе (≥ 5 г/л) эта зависимость дает
значения, удовлетворительно согласующиеся с производственными данными, тогда как в области малых концентраций
сероводорода в растворе (1-1,5 г/л) расчетные значения P*H2S меньше фактических на
порядок и более. Поэтому при расчете абсорберов сероводорода средняя движущая сила процесса получается в 1,5-2 раза
больше фактической, а необходимая поверхность насадки сильно заниженной против нормативной. Более того, при расчете
необходимого числа ступеней изменения концентрации в регенераторе равновесная линия в соответствии с этим уравнением
пересекается с рабочей линией и проходит выше последней при концентрациях сероводорода в растворе <3,5 г/л, тогда как при
регенерации поглотительного раствора в производственных условиях концентрация сероводорода в нем снижается
до ≤ 1,5-2 г/л.
Близкие к истинным значения давления сероводорода над поглотительным раствором могут быть получены из выражения
константы равновесия химической реакции, протекающей в абсорбере:
Na2CO3 + H2S ↔ NaHCO3 + NaHS.
По результатам исследований [2] значения константы равновесия этой реакции в интервале 25-60 °С
определяются по уравнению изобары:
lgK = 2500/4,576T - 3,16.
(3)
Здесь К = [NaHCO3][NaHS]/[Na2CO3]PH2S - константа
равновесия реакции;
[NaHCO3], [NaHS], [Na2CO3] -
концентрации соответствующих солей в растворе, моль/л;
PH2S - давление сероводорода над раствором при равновесии, мм. рт.ст.;
Т - температура раствора, К.
Отсюда равновесное давление сероводорода над поглотительным раствором данного состава
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
(4)
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
Na2CO3 + H2S ↔ NaHCO3 + NaHS.
|
По результатам исследований [2] значения константы равновесия этой реакции в интервале 25-60 °С
определяются по уравнению изобары:
lgK = 2500/4,576T - 3,16.
(3)
Здесь К = [NaHCO3][NaHS]/[Na2CO3]PH2S - константа
равновесия реакции;
[NaHCO3], [NaHS], [Na2CO3] -
концентрации соответствующих солей в растворе, моль/л;
PH2S - давление сероводорода над раствором при равновесии, мм. рт.ст.;
Т - температура раствора, К.
Отсюда равновесное давление сероводорода над поглотительным раствором данного состава
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
(4)
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
lgK = 2500/4,576T - 3,16.
|
Здесь К = [NaHCO3][NaHS]/[Na2CO3]PH2S - константа
равновесия реакции;
[NaHCO3], [NaHS], [Na2CO3] -
концентрации соответствующих солей в растворе, моль/л;
PH2S - давление сероводорода над раствором при равновесии, мм. рт.ст.;
Т - температура раствора, К.
Отсюда равновесное давление сероводорода над поглотительным раствором данного состава
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
(4)
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
PH2S = [NaHCO3][NaHS]/[Na2CO3]K.
|
Наряду с основной реакцией в абсорбере протекают также реакции поглощения углекислоты и цианистого водорода:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3,
Na2CO3 + HCN ↔ NaHCO3 + NaCN,
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
Na2CO3 + CO2 + H2O ↔ 2NaHCO3, |
сопровождающиеся образованием бикарбоната натрия, концентрация которого в растворе влияет на равновесное давление
сероводорода.
Таким образом, зная начальный состав поглотительного раствора, а также заданную степень улавливания сероводорода,
углекислоты и циановодорода в абсорбере, можно определить состав раствора по уравнениям рабочих линий и химических
реакций для поглощаемых компонентов и равновесное давление сероводорода в газе по уравнению константы равновесия
основной реакции в любом сечении аппарата.
Уравнения рабочих линий могут быть представлены в виде:
(aн - ai) = L(cн - ci),
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
(aн - ai) = L(cн - ci),
|
где aн, ai - концентрации поглощаемого компонента в газе внизу абсорбера и в произвольном
его сечении, г/м3;
cн, ci - то же, внизу абсорбера, г/л;
L - удельный расход поглотительного раствора
в абсорбере (по нормативам УХИНа 3-4 л/м3 газа).
Далее мы представляем результаты расчетов равновесных давлений сероводорода в газе в различных по высоте
абсорбера сечениях при следующих исходных данных.
1. Содержание кислых компонентов в коксовом газе, г/м3:
H2S
CO2
HCN
До абсорбера
18
42
1,5
После абсорбера
3
39
0,2
2. Концентрация активных компонентов в исходном поглотительном растворе, г/л: Na2CO3 - 42;
NaHCO3 - 18; NaHS - 1,5; NaCN - 1.
3. Удельный расход поглотительного раствора 4 л/м3 газа.
4. Давление газа в абсорбере 820 мм.рт.ст.; температура раствора в абсорбере 35 °С.
В табл.1 приведены данные об изменении концентрации поглощаемых компонентов в коксовом газе и активных солей
в поглотительном растворе по высоте абсорбера.
В табл.2 представлены значения равновесного давления сероводорода над поглотительным раствором в выбранных
сечениях по высоте абсорбера, рассчитанные по константе равновесия основной реакции, равной 0,0411 при 35 °С, и
по скорректированной формуле (2), а также парциальные давления сероводорода в газе,
рассчитанные по формуле Дальтона:
PH2S = 22,4aPобщ/1000MH2S,
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
| H2S | CO2 | HCN | |
| До абсорбера | 18 | 42 | 1,5 |
| После абсорбера | 3 | 39 | 0,2 |
PH2S = 22,4aPобщ/1000MH2S,
|
где MH2S - молскулярная масса сероводорода;
Pобщ - обшее давление газа в абсорбере, мм рт.ст.;
а - содержание сероводорода в газе в соответствующем сечении, г/м3.
Как видно из данных табл.2 и рис.1, значения равновесного давления сероводорода над поглотительным раствором,
рассчитанные по степенной зависимости (2) и по формуле (4), различаются между собой на величину,
пропорциональную концентрации сероводорода в растворе, что указывает па необходимость дополнения степенной
зависимости (2) линейной составляющей. В результате обработки приведенных нами данных получена зависимость:
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
P*H2S = 12,3CH2S + 17(t + 48)CH2S
3,04,
|
которая при 35 °С дает значения, практически совпадающие с расчетными значениями по формуле (4).
Аналогичные расчеты провели для процесса регенерации поглотительного раствора. При 60°С значение константы
равновесия но формуле (3) составляет 0,03027. Уравнение рабочей линии процесса регенерации но координатам точек,
соответствующих верху и низу регенератора, имеет вид:
1000(cв - cн) = Vп(aв - aн),
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
1000(cв - cн) = Vп(aв - aн),
|
где cв, cн - концентрация сероводорода в растворе соответственно вверху и внизу регенератора, г/л;
aв, aн - то же, в парогазовой смеси, г/м3;
Vп - расход пара в регенераторе, м3/м3 раствора.
По практическим данным, расход пара в регенераторе 70-90 кг на 1 м3 раствора.
Для расчетов были приняты следующие значения параметров:
Удельный расход пара, м3/м3 раствора
100
Концентрация сероводорода в растворе вверху регенератора, г/л:
вверху регенератора
4,661
внизу регенератора
0,910
Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора,
г/м3
0
Результаты расчетов представлены в табл. 3 и на рис. 2.
Таблица 2
Сечение абсорбера
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,02678
0,911
0,0234
0,352
1,621
1
0,4885
1,661
0,1458
0,802
3,241
2
0,07091
2,411
0,4526
1,435
4,862
3
0,09297
3,161
1,0311
2,304
6,483
4
0,11503
3,911
1,9697
3,481
8,104
Низ
0,13709
4,661
3,3576
5,074
9,724
Таблица 3
Сечение регенератора
Концентрация H2S в растворе
Равновесные давления H2S над раствором
Парциальные давления H2S в газе
моль/л
г/л
формула (2)
формула (4)
Верх
0,13709
4,661
4,3689
6,8892
2,7180
1
0,11503
3,911
2,5629
4,7266
2,1744
2
0,092927
3,161
1,3416
3,1287
1,6308
3
0,07091
2,411
0,5889
1,9490
1,0872
4
0,04885
1,661
0,1896
1,0892
0,5436
Низ
0,02678
0,911
0,0305
0,4783
0,0000

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора:
1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
| Удельный расход пара, м3/м3 раствора | 100 |
| Концентрация сероводорода в растворе вверху регенератора, г/л: | |
| вверху регенератора | 4,661 |
| внизу регенератора | 0,910 |
| Концентрация сероводородав паре, поступающем под нижнюю терелку регенератора, г/м3 | 0 |
Таблица 2
| Сечение абсорбера | Концентрация H2S в растворе | Равновесные давления H2S над раствором | Парциальные давления H2S в газе | ||
|---|---|---|---|---|---|
| моль/л | г/л | формула (2) | формула (4) | ||
| Верх | 0,02678 | 0,911 | 0,0234 | 0,352 | 1,621 |
| 1 | 0,4885 | 1,661 | 0,1458 | 0,802 | 3,241 |
| 2 | 0,07091 | 2,411 | 0,4526 | 1,435 | 4,862 |
| 3 | 0,09297 | 3,161 | 1,0311 | 2,304 | 6,483 |
| 4 | 0,11503 | 3,911 | 1,9697 | 3,481 | 8,104 |
| Низ | 0,13709 | 4,661 | 3,3576 | 5,074 | 9,724 |
Таблица 3
| Сечение регенератора | Концентрация H2S в растворе | Равновесные давления H2S над раствором | Парциальные давления H2S в газе | ||
|---|---|---|---|---|---|
| моль/л | г/л | формула (2) | формула (4) | ||
| Верх | 0,13709 | 4,661 | 4,3689 | 6,8892 | 2,7180 |
| 1 | 0,11503 | 3,911 | 2,5629 | 4,7266 | 2,1744 |
| 2 | 0,092927 | 3,161 | 1,3416 | 3,1287 | 1,6308 |
| 3 | 0,07091 | 2,411 | 0,5889 | 1,9490 | 1,0872 |
| 4 | 0,04885 | 1,661 | 0,1896 | 1,0892 | 0,5436 |
| Низ | 0,02678 | 0,911 | 0,0305 | 0,4783 | 0,0000 |

Рис.1. Равновесная и рабочая линии процесса абсорбции сероводорода содовым раствором: 1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса абсорбции |

Рис.2. Равновесная и рабочая линии процесса регенерации содовго поглотительного раствора: 1,2 - линия равновесия по форме соответственно (2) и (4); 3 - рабочая линия процесса регенерации |
Как видно из рис.2, рабочая линия процесса регенерации поглотительного раствора пересекает кривую равновесных
давлений, рассчитанных по степенной зависимости (2), в точке, соответствующей концентрации сероводорода в
растворе ~3,4 г/л. (При меньших концентрациях проходит выше ее, что противоречит практическим данным о работе
промышленных регенераторов.) Это дает основание считать, что экстраполяция зависимости (1) равновесных давлений
сероводорода над чистым содовым раствором на условия работы вакуум-карбонатных сероочисток неправомерна.
Равновесная кривая, рассчитанная по константе равновесия основной реакции с учетом рабочих линий процесса
десорбции кислых газов, хорошо согласуется с практическими данными. Соответствующее ей число теоретических ступеней
изменения концентрации, как видно из рис.2, равно ~4. Из опыта эксплуатации регенераторов известно, что требуемого
снижения концентрации сероводорода в растворе до 1,2-1,5 г/л можно достичь при наличии 8-10 тарелок.
Представленная на рис.2 равновесная кривая 2 для принятого состава поглотительного раствора при 60 °С
описывается с высокой точностью уравнением:
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
аналогичным уравнению равновесия в абсорбере.
Таким образом, для расчета абсорберов сероводорода из коксового газа и регенераторов поглотительного
раствора можно использовать равновесные кривые на основе константы равновесия реакции сероводорода с карбонатом
натрия и уравнений материального баланса кислых компонентов в абсорбере и регенераторе.
Для учета влияния концентрации балластных солей на равновесие необходимо определить значения константы
равновесия основной реакции при различных составах поглотительного раствора.
Список литературы
1. Егоров H.Н., Дмитриев М.М., Зыков Д.Д. Очистка коксового газа и других горючих газов.
- М.: Госнаучтсхиздат, 1950. -240 с.
2. Литвиненко М.С. Очистка коксового газа от сероводорода. - Харьков: Металлургиздад, 1959. - 308 с.
3. Справочник азотчика. Т.1. Под ред. Е.Я. Мельникова. - М.: Химия, 1967.- 492 с.
4. Мараховский Л.Ф., Собина И.А., Кузнецов В.Д. и др. Равновесие в карбонатных растворах...//Кокс и химия. 1988. № 7.
С.32-34.
5. Ковалев Е.Т., Давиденко И.М. Преимущества и недостатки способов очистки коксового газа от сероводорода//Кокс и
химия. 1990. №6. С.31-34.
6. Литвиненко М.С. Равновесие в системе "сероводород и углекислота - водные растворы карбоната натрия или калия"
//ЖПХ. 1952. T.XXV. №5. C. 5I6-531.
7. Кузнецов М.Д., Ляпная З.Г. Методические указания по определению констант равновесия и коэффициентов массопередачи
для абсорбционных процессов. - Донецк: ДПИ, 1981. - 44 с.
P*H2S = 17,5CH2S + 17(t + 48)CH2S
3,04,
|