Материал взят с: http://www.rosoncoweb.ru/library/congress/09/27.htm
Авторы: С.И. Ткачёв, О.П. Трофимова, З.П. Михина, А.В. Назаренко, С.М. Иванов"Роль лучевой терапии в органосохраняющем лечении новообразований"
Клиническая онкология сегодня, как и на протяжении всей своей истории, продолжает развиваться и совершенствоваться.
Развиваются и совершенствуются три её основные составляющие – хирургия, химиотерапия и лучевая терапия. Быстрыми темпами прогрессирует технологическое обеспечение основных методов лечения, пересматриваются и подвергаются коррекции многие идеологические принципы и концепции построения противоопухолевого лечения. Идёт постоянное критическое осмысление совокупного отечественного и мирового опыта клинической и экспериментальной онкологии, корректирующее или изменяющее стандарты противоопухолевого лечения.
Коррективы в тактику противоопухолевого лечения вносят перемены, происходящие в лучевой терапии, особенно связанные с изменениями в технике и технологии лучевого воздействия. Использование при подготовке к облучению современных спиральных КТ, МРТ, ПЭТ в сочетании с компьютерными программами позволили создать объёмное ЗД планирование – основу для совершенствования контактных и особенно дистанционных видов лучевой терапии. Появление линейных ускорителей с многолепестковыми коллиматорами в сочетании с объёмным ЗД планированием, математическими программами прямого и особенно обратного расчёта поглощённых доз радиации, тщательной фиксацией и постоянной верификацией точности выполнения каждого этапа лучевого лечения позволили развить лучевую терапию до выполнения современного конформного лучевого воздействия и облучения с модулированной интенсивностью (IMRT). Реализацией этого направления явилось выявление реальных границ опухоли и создание максимального по величине градиента дозы на границе «опухоль - здоровая ткань». Внедряемая сегодня в клиническую практику новая передовая технология радиотерапии IGRT (Image Guided Radiation Therapy) позволяет визуально контролировать точность в режиме реального времени в процессе проведения каждого сеанса лучевого воздействия из-за совмещенного с линейным ускорителем киловольтного источника излучения. IGRT, по сравнению с другими высокими технологиями, позволяет за счёт постоянно контролируемой позиции больного на лечебном столе ЛУЭ (линейного ускорителя электронов) и контроля за смещением изодозного распределения на экране монитора уменьшить риск ошибок, связанных с движением опухоли во время дыхания и постоянно происходящего смещения ряда органов.
Использование технологий лучевого лечения на основе ЗД планирования (конформное, IMRT, IGRT) делает реальной возможность увеличить суммарные очаговые дозы мелкофракционного лучевого воздействия от 74 до 90 Гр без увеличения частоты лучевых повреждений нормальных тканей, повышая вероятность контроля над опухолью.
Лучевая терапия (ЛТ) — крайне техноемкая отрасль медицины, основная задача которой состоит в подведении к опухоли тумороцидной дозы при минимально возможной лучевой нагрузке на прилежащие здоровые органы и ткани, так как повышая эффективность лечения онкологических больных, лучевое лечение сопровождается развитием лучевых осложнений со стороны окружающих опухоль здоровых тканей. Поэтому как ни одна другая отрасль медицины лучевая терапия требует максимальной точности на всех этапах ее проведения.
Согласно заключению экспертов ВОЗ, успех лучевой терапии примерно на 50% зависит от радиочувствительности опухоли, на 25% — от аппаратного оснащения и на 25% — от выбора рационального плана лечения и точности его воспроизведения от сеанса к сеансу облучения.
Поэтому предлучевая подготовка является крайне важным этапом в проведении лучевого лечения онкологическим больным. Ошибка, допущенная при подготовке к облучению, ведет к систематическому отклонению, повторяемому при каждом сеансе лечения.
Задача планирования лучевой терапии заключается в том, чтобы с учетом индивидуальной анатомо-топометрической информации, радиобиологических параметров и допустимых уровней нагрузок на критические органы выбрать из множества возможных условий облучения их оптимальную комбинацию. Расчет дозного распределения в объеме тканей, подвергаемых облучению, необходим для определения дозы, получаемой в процессе лечения окружающими опухоль здоровыми тканями и критическими органами. Выбор параметров облучения производится с учетом уровней толерантности окружающих нормальных тканей.
В идеальном варианте объем, подвергаемый лечебному воздействию, должен быть максимально близок к планируемому, но большее или меньшее совпадение этих объемов зависит от анатомической локализации опухоли, качества излучения и используемого радиотерапевтического оборудования.
Появившееся в последние годы современное радиотерапевтическое оборудование позволяет реализовать эту задачу на практике. Использование трехмерного планирования (3D), позволяющего перейти от применяемых ранее расчетов распределения доз по одноплоскостным сечениям-срезам тела на уровне середины мишени к объемному планированию, дает возможность создать необходимые распределения дозы по всему объему мишени с максимумом в зоне опухоли и снизить до минимума дозовые нагрузки в зоне окружающих нормальных тканей.
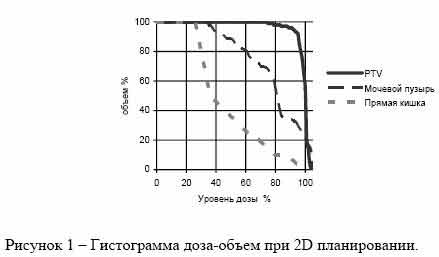
На рис. 1 и 2 представлены гистограммы доза–объем (DVH) для планируемого объема мишени (PTV) при раке предстательной железы и критических органов (мочевой пузырь, прямая кишка) для 2D- и 3D- планирования. Объемное (3D) планирование позволяет получить лучшее распределение дозы для мишени-опухоли (гистограмма имеет форму прямоугольника) и уменьшить лучевую нагрузку на мочевой пузырь.

В процессе диагностики и подготовки к лучевому лечению важное значение имеют максимально точное определение распространенности опухолевого процесса: локализации, размеров и конфигурации опухолевых очагов, являющихся мишенью радиотерапевтического воздействия, а также оценка состояния находящихся рядом критических органов. При этом обязательным является использование максимально возможной информации, получаемой при привлечении современных диагностических (рентгенологических, ультразвуковых, радиоизотопных) методов исследования.
Для получения данных, необходимых для планирования лучевой терапии, следует соблюдать условия, идентичные условиям проведения в дальнейшем лучевой терапии.
Результатом планирования является выбор программы облучения с последующей проверкой на симуляторе правильности выбора направлений пучка излучения и размеров полей (моделирующее устройство).
Лучевая терапия на сегодняшнем этапе развития онкологии может быть использована при органосберегающем лечении в нескольких вариантах. При ряде локализаций и стадий распространения злокачественных опухолей можно рассматривать лучевую терапию, особенно при использовании современных технологий (конформного, IMRT, IGRT), в сочетании с брахитерапией, радиомодификаторами как альтернативу хирургическому лечению. К таким ситуациям относятся рак предстательной железы, плоскоклеточный и базальноклеточный рак кожи лица, десмоидные опухоли мягких тканей, рак тела и шейки матки, трахеи.
При значительном числе локализаций комбинация последовательного или одновременного лучевого и лекарственного видов лечения позволяет получить наиболее высокие онкологические результаты при консервативном органосберегающем характере лечения. Этому способствовало появление новых высокоэффективных противоопухолевых препаратов и применение современных технологий лучевого воздействия, а высокие результаты достигаются даже при некоторых новообразованиях, ранее считавшихся крайне радиорезистентными (остеосаркома).
Значительное место лучевая терапия занимает в сочетании с экономными органосберегающими операциями как часть комбинированного лечения или компонент комплексного лечения. К облучению при таком варианте органосберегающего лечения предъявляются требования обеспечения надёжности онкологических результатов. Лучевое воздействие после парциальных резекций молочной железы, мочевого пузыря, прямой кишки, позволяет получить результаты, аналогичные таковым после радикальных операций с удалением органа.