Источник: Охорона навколишнього середовища та раціональне використання природних ресурсів / Збірка доповідей VIІІ Міжнародної наукової конференції аспірантів і студентів. Т. 2 - Донецьк: ДонНТУ, ДонНУ- 2009, с. 108-109.
В настоящее время наиболее распространенным обеззараживающим агентом является хлор. Ранее установлено, что возможно получение газообразного хлора в ходе самораспространяющегося взаимодействия (СРВ) в системах безводные хлорсодержащие соли – пероксидные соединения натрия, например, Mg(ClO4)2 - Na2O2, Cu2Cl2 - NaO2. Одним из преимуществ получения газообразного хлора в ходе СРВ является возможность использовать тепло реакции без подвода энергии извне. Другим достоинством является возможность использования в процессе солей тяжелых металлов, являющихся отходами ряда производств. Поэтому изучение реакций, способных протекать в режиме СРВ с целью получения газообразных обеззараживающих агентов представляет значительный интерес.
Целью данной работы является изучение взаимодействия компонентов системы CoCl2 - NаСlО3, в частности, количества и состава образующихся газообразных продуктов с целью возможного их дальнейшего использования в качестве обеззараживающих агентов.
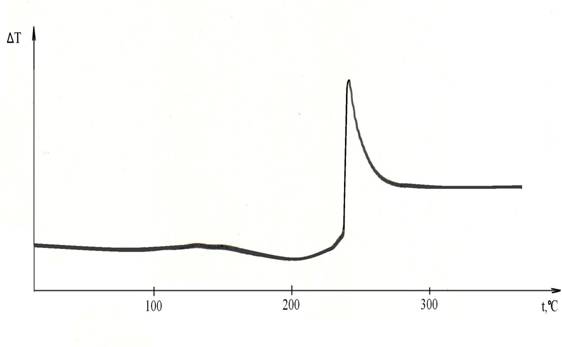
При проведении термического анализа смесь хлорида кобальта с хлоратом натрия с мольным соотношением компонентов соответственно 3:2 нагревалась от комнатной температуры до 500°С со скоростью 14 град/мин. При этом на кривой ДТА (рис. 1) при температуре 240°С фиксируется экзотермический эффект. Потеря массы при этом составила 23,01 %.

Рисунок 1 - Кривая ДТА для системы CoCl2 : NаСlО3 при мольном соотношении компонентов 3:2
Согласно литературным данным, хлорат натрия разлагается в соответствии со схемой:
Т.е. единственным газообразным продуктом является кислород. Однако при введении в систему солей тяжелых металлов наряду с кислородом в газовую фазу выделяется хлор. Максимальное выделение хлора можно ожидать при соотношении компонентов 3:1 – уравнение (2) – со следующей схемой реакции:
Возможно протекание побочных процессов, например, согласно литературным данным, окисление образовавшегося в ходе реакции (2) оксида кобальта СоО при нагревании на воздухе выше 390°С до Со3О4. С учетом процесса (4) реакция (3) преобразуется в суммарное уравнение (5), которое имеет следующий вид:
Теоретическая потеря массы в соответствии с уравнением реакции (5) составляет 23%. При проведении термического анализа потеря массы составила 23 %, а при проведении СРВ – 22 %.
Анализ содержания газообразного хлора в газообразных продуктах взаимодействия осуществлялся йодометрическим методом. Для этого образовавшуюся после взаимодействия хлорида кобальта с хлоратом натрия с мольным соотношением соответственно 3:2 газовую смесь отбирали, а затем прокачивали через подкисленный раствор йодида калия.
В результате проведенного анализа газообразных продуктов СРВ установлено, что хлор выделяется в количестве 0,5325 г на 5 г исходной смеси, что соответствует 23% от количества хлора, содержащегося в первоначальной смеси в виде хлорид- и хлорат - ионов. Содержание хлора в газообразных продуктах составляет 45 %об.
Ранее установлено, что при взаимодействии компонентов системы СоCl2 - NaO2 при мольном соотношении 3:2 количество выделяющегося газообразного хлора составляет 7,1•10-3 г на 5 г смеси, что соответствует 0,3% от количества хлора, содержащегося в первоначальной смеси в виде хлорид-ионов. Содержание хлора в газообразных продуктах составляет 0,4%.
Сравнение результатов, полученных при исследовании взаимодействия хлорида кобальта с супероксидом натрия и с хлоратом натрия, показывает, что в последнем случае эффективность получения газообразного хлора по всем показателям практически на два порядка выше.
Таким образом, данные факты подтверждают, что существует возможность получения газообразного хлора в ходе самораспространяющегося взаимодействия в системе хлорид кобальта – хлорат натрия, а также данный процесс может протекать в соответствии с приведенным уравнением реакции (5). Дальнейшее изучение процессов, протекающих в системе CoCl2 - NаСlО3, может быть перспективным для получения газообразного хлора.