Важность изучения равновесия в металлургических процессах вытекает из того, что равновесное состояние ограничивает предел
реакции всякого процесса и мы в состоянии управлять завершением желаемой реакции, контролируя факторы, влияющие на
равновесие.
Примером равновесия, хорошо известного в сталеплавильном производстве, может служить реакция окисления марганца:
[Mn]+[O]→(MnO) (1)
Если химическая реакция протекает в одну стадию, то непосредственно из уравнения химической реакции может быть
получено дифференциальное уравнение, описывающее изменение концентрации реагентов.
В общем виде уравнение химической реакции можно представить в таком виде:
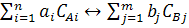 (2)
(2)
где ai и bj - порядок прямой и обратной реакции; CAi и CBj - концентрация
исходных веществ и продуктов реакции.
Скорость химической реакции, протекающей в одну стадию, равна:
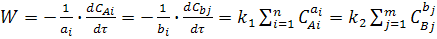 (3)
(3)
где k1 и k2 - константы скорости прямой и обратной реакции (2).
Концентрации исходных веществ (CAi) и продуктов реакции (CBj) связаны между собой соотношением:
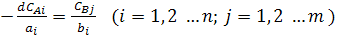 (4)
(4)
В интегральном виде уравнении (3) можно представить как
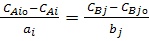 (5)
(5)
где CAiо и CBjо - начальные концентрации исходных веществ и продуктов реакции.
Обычно начало протекания реакции проходит при отсутствии продуктов реакции, т.е. CBjо = 0.
Пусть 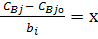 где х – параметр, который характеризует полноту протекания реакции. Он равен нулю в начальный момент времени
и увеличивается по мере накопления продуктов реакции.
где х – параметр, который характеризует полноту протекания реакции. Он равен нулю в начальный момент времени
и увеличивается по мере накопления продуктов реакции.
Из соотношения (5) через параметр х можно определить концентрации
всех исходных веществ и продуктов реакции.
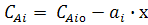
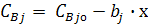 (6)
(6)
Производная х по времени будет характеризовать скорость химической реакции. Следовательно уравнение (3) можно записать
в виде:
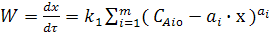 (7)
(7)
В уравнении стехиометрические коэффициенты aMn = aO = 1. Если обозначить через СMn = CO cоответственно концентрацию
марганца и кислорода в металле, то уравнение (7) для скорости окисления марганца можно записать в таком виде:
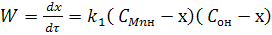 (8)
(8)
где k1 - константа скорости прямой реакции; СMnн и COн - начальные или исходные реакции концентрации Mn и O в металле.
После разделения переменных х и τ и интегрирования при начальных условиях при τ = 0 х = 0, получим:
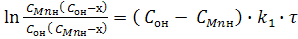 (9)
(9)
Решая уравнение (9) относительно х, получим:
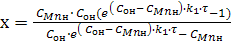 (10)
(10)
Если в уравнении (10) провести замену х согласно уравнения (6) на СMnн - СMn или на COн - CO, то после несложных
преобразований получим:
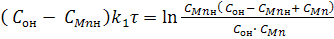 (11)
(11)
Введем новые переменные:
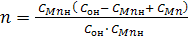
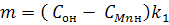
Тогда уравнение (10) запишем в таком виде:
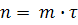 (12)
(12)
Из которого следует, что параметр n линейно зависит от времени τ. В координатах n, τ тангенс угла наклона прямой m•τ
оси абсцисс (τ) будет равнятся m в уравнении (12).
Из выражения 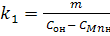 определяем константу скорости прямой реакции окисления марганца (1).
Кажущуюся энергию активации реакции (1) можно определить из уравнения Аррениуса:
определяем константу скорости прямой реакции окисления марганца (1).
Кажущуюся энергию активации реакции (1) можно определить из уравнения Аррениуса:
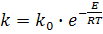 (13)
(13)
где k и ko - константы скорости химической реакции соответственно при температурах Т и Т→∞ ; Е – кажущаяся энергия активации химической реакции.
Т.е. ko - параметр, независящий от температуры и является постоянной величиной для конкретной химической реакции.
Для определения энергии активации (Е) необходимо определить значения константы скорости химической реакции при двух температурах Т1 и Т2:
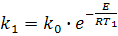 или
или 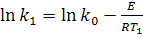 (14)
(14)
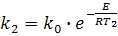 или
или 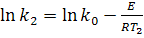 (15)
(15)
Из выражения lnk1 - lnk2 получим:
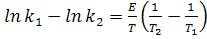 (16)
(16)
Из полученного выражения определяем параметр E:
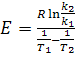 (17)
(17)
Определив значение кажущейся энергии активации (Е) можно определить параметр ko из выражения:
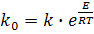 (18)
(18)
Таким образом можно определить параметр ko при различных температурах. По этому параметру можно судить о погрешности
принятой методики. Параметр ko должен быть одинаковой величиной при любой температуре. По среднеквадратическому отклонению
этой величины можно определить погрешность эксперимента.
Литература
- Астарита Дж. Массопередача с химической реакцией. Изд-во «Химия», 1971, стр. 224.
- Е.Т. Туркдоган Физическая химия высокотемпературных процессов Пер. с англ. М,: Металлургия, 1985, с.299-305.
- Дымнич А.Х., Троянский А.А. Вопросы тепломассообмена в сталеплавильных процессах - Киев; Донецк: Головное изд-во, 2009, с.25-27.
- Фізико-хімічні процеси позаагрегатного рафінування металу: Навчальний посібник / Зборщик О.М. – Донецьк: ДонНТУ, 2001, с.115-118.
- Конвертерный процесс с долнным дутьем. Арсентьев П.П., Квитко М.П., М.: Металлургия, 1983, 128с, с.35-39.
- Аналитическая химия. Проблемы и подходы: В 2 т: Пер. с англ. / Под ред. Р. Кельнера, Ж.-М. Мерме, М. Отто, Г.М. Видмер. - «Мир»: ООО «Издательство АСТ», 2004, с.412-418.
|

