ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ И ЭНЕРГИИ АКТИВАЦИИ РЕАКЦИИ ОКИСЛЕНИЯ МАРГАНЦА
Кривобоков А.В.
Донецкий национальный технический университет
Источник: Металлургия и обработка металлов
(выпуск 9) / Материалы научно-технической конференции. - Донецк: ДонНТУ, 2009. - 39-41.
До настоящего времени в научной и технической литературе отсутствуют данные о константах скорости протекания основных
сталеплавильных реакций: окисление Si, Mn, P и других.
Отсутствие этих параметров не позволяет рассчитывать скорость окисления примесей в металлической ванне, определять
лимитирующие стадии физико-химических процессов, сопровождающих рафинировочные реакции и другие явления.
Рассмотрим прямую реакцию окисления марганца:
[Mn]+[O]→(MnO) (1)
Эту реакцию можно рассматривать как реакцию второго порядка по реагентам марганца и кислорода.
Для реакции второго порядка скорость ее протекания можно определить из уравнения:
 (2) (2)
где W - cкорость прямой реакции, кг/м3*с; k - константа скорости прямой реакции (1), (м3*кг)/с;
aMn и aO - стехиометрические коэффициенты, aMn = aO = 1; CMnн и
COн - начальные концентрации марганца и кислорода в металле, кг/м3; х – параметр, характеризующий
полноту протекания реакции.
Параметр х равен нулю в начальный момент времени и увеличивается по мере накопления продуктов реакции (MnO).
После разделения переменных х и τ и интегрирования при начальных условиях при τ = 0 х = 0, получим:
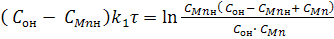 (3) (3)
Введем новые переменные:
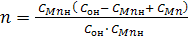 (4) (4)
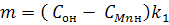 (5) (5)
Тогда получим:
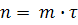 (6) (6)
Из выражения следует, что параметр n линейно зависит от времени τ. В координатах n, τ тангенс угла наклона прямой m•τ
оси абсцисс (τ) будет равнятся m в уравнении (12).
Из выражения 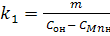 определяем константу скорости прямой реакции окисления марганца (1). определяем константу скорости прямой реакции окисления марганца (1).
Кажущуюся энергию активации реакции (1) можно определить из уравнения Аррениуса:
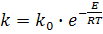 (7) (7)
где k - константа скорости прямой реакции, (м3*кг)/с; ko - параметр, независящий от
температуры, (м3*кг)/с; Е – энергия активации реакции, Дж/кг; R - универсальная газовая постоянная, Дж/кг*К;
Т - абсолютная температура, К.
Для определения энергии активации (Е) необходимо определить значения константы скорости химической реакции при
двух температурах Т1 и Т2:
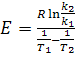 (3) (3)
Зная величину (Е) можно определить параметр ko:
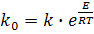 (9) (9)
Этот параметр должен быть одинаковой величиной при любой температуре. Следовательно, по среднеквадратическому отклонению
этой величины можно оценивать погрешность эксперимента.
Литература
- Аналитическая химия. Проблемы и подходы: В 2 т: Пер. с англ. / Под ред. Р. Кельнера, Ж.-М. Мерме, М. Отто, Г.М.
Видмер. - «Мир»: ООО «Издательство АСТ», 2004, с.421-424.
- Дымнич А.Х., Троянский А.А. Вопросы тепломассообмена в сталеплавильных процессах - Киев: Донецк: Вища шк.
Головное изд-во, 2009, с.15-18.
|