Е.С. Жулькова, Н.Ю. Ильясова, А.В. Куприянов
Институт систем обработки изображений Российской академии наук
Самарский государственный аэрокосмический университет
Источник информации: http://www.smr.ru/IPSI/research/publication/KO/PDF/KO31-2/KO312211.pdf
В работе представлена технология выделения лейкоцитов на изображениях препаратов кро-ви на основе представления изображения в цветовом пространстве HSL. Описаны результаты экспериментальных исследований качества технологии в зависимости от различных искажений на эталонных и реальных изображениях.
Общеклиническое исследование крови до сих пор остается одним из важнейших диагностических методов. Этот анализ тонко отражает реакцию кроветворных органов на воздействие различных физиологических и патологических факторов [1]. Однако необходимость обнаружения и классификации в ручную большого числа клеток делает этот анализ длительным и трудоемким. Поэтому актуальной становится задача автоматизации проведения общеклинического анализа крови.
В понятие «общеклиническое исследование крови» входят: определение концентрации гемоглобина, подсчет количества эритроцитов, цветового показателя лейкоцитов, скорости оседания эритроцитов (СОЭ) и процентное соотношение каждого из типов лейкоцитов (лейкоцитарной формулы) [1]. В данной работе представлена технология выделения лейкоцитов на изображениях препаратов крови, которая является основным этапом решения задачи автоматического расчета лейкоцитарной формулы.
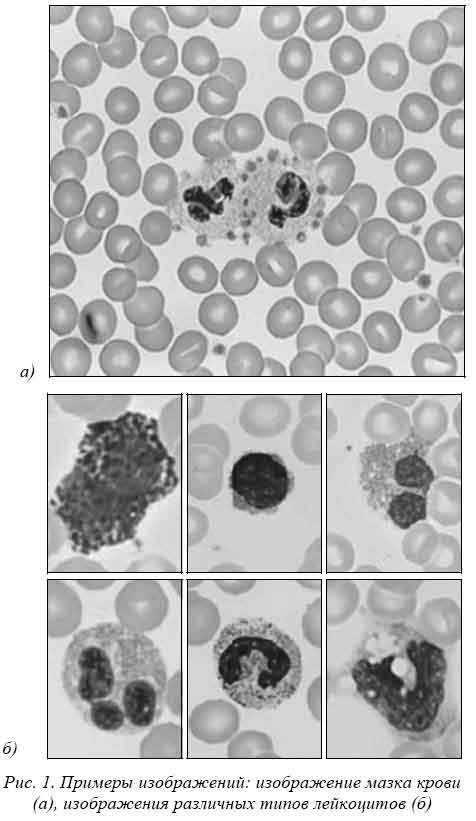
Изображение препарата крови, получаемое при проведении общеклинического обследования крови, представлено на рис.1а. На изображении присутствуют различные форменные элементы крови - клетки крови. Лейкоциты выделяются по внешнему виду, это самые крупные клетки.
У каждого лейкоцита пространство клетки разбивается на две области ядро и цитоплазму. На изображении ядро лейкоцита представляет собой оптически плотное образование, цвет которого, в зависимости от типа лейкоцита, варьируется от светло-малинового до темно-фиолетового (см. рис. 1б). Цитоплазма оптически менее плотная, чем ядро, часто содержит включения (гранулы). Цвет цитоплазмы зависит от типа лейкоцита и варьируется от пурпурного до фиолетового.
Подробный обзор и характеристика основных методов выделения лейкоцитов приведены в работе [6]. Дадим краткое описание основных классов методов.
Автоматические методы [2, 3] выделения элементов не предполагают участия оператора компьютера (врача-лаборанта) при работе. Задача создания автоматических методов является весьма сложной с математической точки зрения. Это связано как с высокой вариабельностью клеток и клеточных структур, так и с высоким уровнем шумов и помех, частичной утратой информации в плоских изображениях по сравнению с трехмерным оригиналом, неравно-мерностью условий окраски в процессе приготовления образцов и т. д. Результаты работы автоматических алгоритмов часто требуют корректировки.

Полуавтоматические методы [4, 5] предполагают интерактивное общение с оператором или ручное задание некоторых параметров алгоритма. Появление методов этого класса обусловлено низкой эффективностью автоматического выделения элементов в условиях малоконтрастных границ и зашумленного изображения. Результаты работы таких методов, как правило, близки восприятию человека, но скорость обработки изображений существенно ниже.
Методы, учитывающие физическую природу клетки [3], разработаны на основе знаний о ее строении и физических особенностях, что обуслав-ливает их высокую эффективность. К сожалению, методы этого класса сложны в разработке и требуют совместной работы специалистов из разных облас-тей знаний.
Методы, не учитывающие физическую природу клетки [2, 4, 5], получили наиболее широкое распространение, они сравнительно просты в разработке и реализации.
Основными недостатками существующих методов являются их слабая адаптивность к различным условиям съемки и вариациям окраски диагностических препаратов, низкое качество выделения границ.
Представленный в данной работе метод решения задачи выделения лейкоцитов на изображениях препаратов крови, основан на анализе изображений в цветовом пространстве HSL. Использование данной технологии для выделений лейкоцитов на изображении препаратов крови позволяет уменьшить влияние вариабельности окраски мазка и зависимости от условий съемки.
Предлагаемая технология состоит из следующих основных этапов: предварительной обработки изображения, преобразования цветового пространства, алгоритмов выделения ядра и цитоплазмы лейкоцитов.
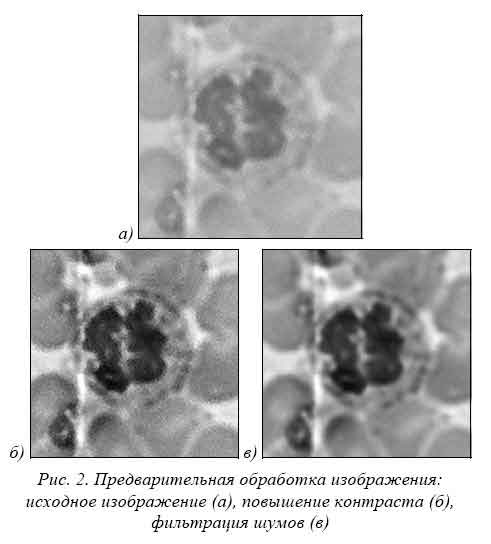
Предварительная обработка. Получение высококачественных снимков препарата крови требует наличия высокоразрешающего микроскопа, хорошей фотокамеры и особых условий съемки. Для большинства клинических лабораторий это означает полную замену используемого оборудования и удорожание стоимости анализа. Изображения препарата крови, получаемые с помощью среднестатистического микроскопа и фотокамеры, как правило, малоконтрастные и зашумлены. Для устранения этих нежелательных факторов или уменьшения их влияния перед непосредственным анализом производится улучшение качества изображения - повышение контраста и фильтрация шумов (см. рис. 2).
Выбор цветового пространства. При анализе изображений препаратов крови цвет является одним из главных факторов, на основе которых возможно выделение и классификация элементов (рис. 3), поэтому работу с изображениями необходимо проводить в том цветовом пространстве, которое наиболее соответствует цветовосприятию человека.
Восприятие цвета человеком является субъективным и большое влияние на восприятие оказывают внешние условия: освещенность, соседство других цветных объектов, в зависимости от которых цвет объекта может показаться нам ярче или тусклее, приобрести определенный оттенок. При предварительно проведенных исследованиях [7] было получено, что к цветовосприятию человека наиболее близки цветовые модели YUV, HSL, RGB. Цветовые модели RGB и YUV базируются на ограничениях, накладываемых аппаратным обеспечением (мониторами и сканерами в случае с RGB и некоторыми типами видеосистем с YUV).

Представление цвета в виде тона, насыщенности и яркости является интуитивным способом описания цвета (система HSL - тон, насыщенность, освещенность). Тон представляет собой конкретный оттенок цвета, отличный от других: красный, зеленый, голубой и т. п. Насыщенность цвета характеризует его относительную интенсивность (или чистоту). Уменьшая насыщенность, например, красного, мы делаем его более пастельным, приближаем к серому. Яркость (или освещенность) цвета показывает величину черного оттенка, добавленного к цвету, что делает его более темным. Система HSL имеет перед другими системами важное преимущество: она больше соответствует природе цвета и хорошо согласуется с моделью восприятия цвета человеком. Поэтому для работы выбрана именно эта модель.
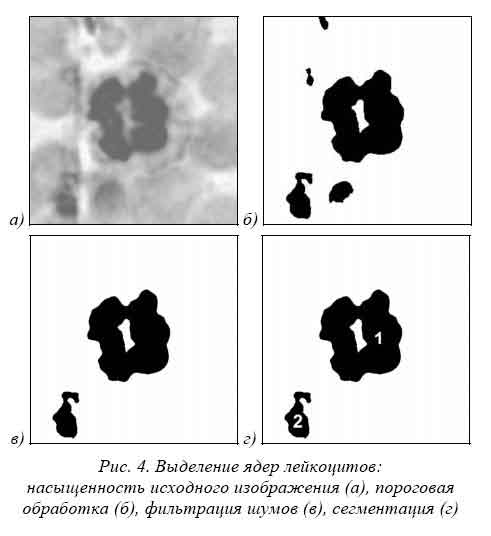
Выделение ядер лейкоцитов.Алгоритм выделения ядер лейкоцитов можно разбить на несколько этапов. На первом этапе выполняется пороговая обработка компоненты S (насыщенность) цветового пространства HSL на основе алгоритма автоматического выбора порогового значения. Это позволяет выделить на изображении наиболее насыщенные элементы. На изображениях препаратов крови, такими элементами являются только ядра лейкоцитов.
На втором этапе на полученном бинарном изображении определяются и удаляются шумовые включения двух видов: пыль и царапины. Пыль по размерам существенно меньше ядра лейкоцита, что позволяет по площади элементов на бинарном изображении судить об их шумовой природе. Царапины представляют собой тонкие протяженные объекты, что позволяет отличить их от ядер по протяженности. В результате получен бинарный препарат ядер лейкоцитов.
На заключительном этапе все множество ядер на бинарном препарате сегментируется. Результат выделения ядер лейкоцитов см. рис. 4.
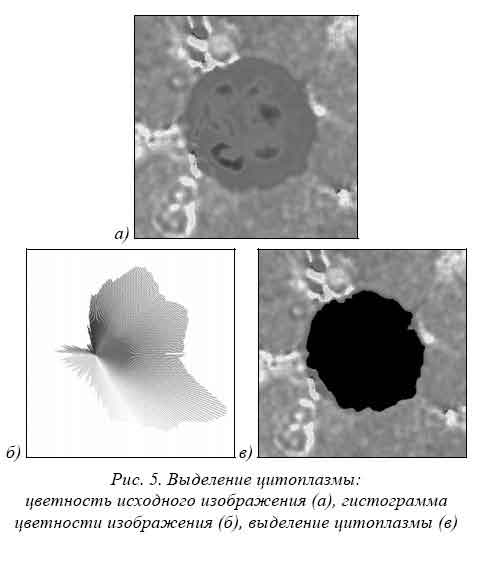
Выделение цитоплазмы лейкоцитов. Используя полученную на этапе выделения ядер информацию об их положении, по гистограмме цветности определяем интервал, в котором лежит цветность ядер. Учитывая, что цветность цитоплазмы близка цветности ядра, задаем отклонение цветности для цитоплазмы, и определяем ее положение (рис. 5). В силу неравномерности окраски цитоплазмы и наличия в ней дополнительных включений, полученное бинарное изображение цитоплазмы имеет выколотые области и неравномерные края. Для устранения этих эффектов предлагается использовать ранговую фильтрацию бинарного изображения с различными параметрами.
Полученный препарат ядер и цитоплазм лейкоцитов анализируем на основе некоторого набора признаков, рассчитываемых на основе полученных маркированных изображений ядер и цитоплазм лейкоцитов. В данной работе производится расчет следующих широко распространенных геометрических признаков, инвариантных к сдвигу, масштабу и повороту: коэффициент аспекта (характеризует вытянутость объекта), коэффициент формы (характеризует извилистость объекта), два коэффициента площади. Подробное описание этих признаков представлено в работе Н.Ю. Ильясовой [8].
Основные сложности при разработке методов выделения лейкоцитов создают различные условия съемки препаратов, вариации окраски препаратов крови и вариации окраски среди различных типов лейкоцитов, шумы ПЗС-матрицы фотокамеры.
Для исследования влияния этих факторов на ошибку оценивания параметров лейкоцитов было проведено определение зависимостей ошибки от
следующих величин: от аддитивного шума на интенсивности изображения, от аддитивного шума на цветности изображения, от сдвига цветности изображения. Исследования выполнены для изображений препаратов крови двух типов: эталонных и реальных [1, 9]. Проведенные исследования показали, что ошибка при определении признаков для шумов интенсивности и сдвига цветности изображения не превышает погрешности вычисления признаков, вносимой дискретизацией изображения. Можно считать, что интенсивность шума и сдвиг цветности изображения на выделении элементов не сказывается.

Аналогичные исследования для влияния шума цветности показали, что он вносит существенные искажения при выделении цитоплазмы лейкоцитов. Удовлетворительные результаты получены для значений дисперсии шума 100 (см. рис. 6).
Для демонстрации работы технологии и выбранных признаков были проведены исследования на реальных изображениях. По стандартной технологии общего анализа крови [10] была получена выборка из 100 фрагментов изображений, содержащих лейкоциты. Априорно был определен тип каждого лейкоцита. Произведено выделение лейкоцитов на изображении и расчет признаков по каждому лейкоциту. На рис. 7 представлен вид распределения классов лейкоцитов в нескольких признаковых пространствах.

Результаты показывают, что для классификации лейкоцитов рассмотренных типов лейкоцитов достаточно классификаторов, основанных на построении линейной разделяющей границы.
В работе предложена технология выделения лейкоцитов на изображениях препарата крови в задаче автоматизации общеклинического анализа крови. Проведен обзор и анализ существующих технологий выделения лейкоцитов на изображениях препаратов крови, произведена классификация и выделены основные недостатки и достоинства методов. Произведен выбор цветового пространства для работы. Разработана технология выделения ядер и цитоплазмы лейкоцита (результат работы технологии см. рис. 8).

Проведены исследования разработанной технологии на влияние различных типов шумов и искажений изображения.
В перспективе, технологию можно усовершенствовать: например, выбрать другой критерий при выделении цитоплазмы, разработать цветояркостные и текстурные признаки для дальнейшего анализа клеток, выработать иной подход к вопросу выделения цитоплазмы и использовать адаптивный порог для выделения ядер лейкоцитов. Разработанная технология может применяться для выделения лейкоцитов на изображениях препаратов, а также для дальнейшей разработки комплекса программ для прове-дения автоматизированного анализа крови.
1. W. Kern. PDQ Hematology. - B.C. Decker. Pub-lished October 2002. - 440 Pages.
2. Автоматизация выделения лейкоцитов на изо-бражениях препаратов крови// Воробьев И.А., Никитаев В.Г., Проничев А.Н. и др. Научная сес-сия МИФИ-2004. М., 2004. - Т.1. - С. 251-252.
3. Патент RU 2132061 С1. Способ адаптивной ав-томатической сегментации и распознавания кле-ток на изображениях цитологических препаратов / Медовый В.С., Медовый Вл.С., Балабуткин В.А. и др. Заявл. 19.02.1997. Опубл. 20.06.1999. [Электронный ресурс] www.fips.ru.
4. Выделение клеток при автоматическом анали-зе микроскопических изображений // Никита-ев В.Г., Проничев А.Н., Хоркин В.А. и др. Научная сессия МИФИ-2006. М., 2006. – Т.1. – С. 282-283.
5. Патент RU 2121714 С1. Способ автоматизиро-ванной сегментации изображения цитологиче-ского препарата / Медовый В.С., Медовый Вл.С., Балабуткин В.А. и др. Заявл. 19.02.1997. Опубл. 10.11.1998. [Электронный ресурс] www.fips.ru.
6. Жулькова Е.С.Методы и алгоритмы цветморфо-логического анализа изображении препаратов крови. – Самара. 2007. – 79 с.
7. Экспериментальное исследование цветовых мо-делей в задачах автоматизированного анализа изображений / Никитаев В.Г., Бердникович Е.Ю., Комаров В.В. и др. // Научная сессия МИФИ-2004.М., 2004. – Т. 1. – С. 253-254.
8. Ильясова Н.Ю. Методы и алгоритмы оценивания геометрических параметров диагностических изображений: Диссертация на соискание ученой степени кандидата технических наук. – Самара, 1997. – 155 с.
9. Луговская С.А., Почтарь М.Е. Гематологический атлас. – Москва–Тверь: ООО «Издательство «Триада», 2004. – 259 с.
10. Лабораторные методы исследования в клинике: Справочник / Под ред. В.В.Меньшикова. – М.: Медицина, 1987. – 366 с.