Глава 1. Общие сведения о катализе и катализаторах
Источник: Технология катализаторов/И.П.Мухленов, Е.И.ДОбкина, В.И.Дерюжкина, В.Е.Сороко
ОСНОВНЫЕ ПОНЯТИЯ
Катализом называют увеличение скорости химических реакций или возбуждение их в присутствии катализаторов, которые участвуют в реакции, вступая в промежуточное химическое взаимодействие с реагентами, но восстанавливают свой химический состав при окончании каталитического акта. Обычно катализатор многократно вступает в такое взаимодействие, повышая скорость химической реакции в течение длительного времени и образуя продукты реакции, масса которых может превосходить массу самого катализатора в тысячи раз.
Если процессы катализа рассматриваются применительно к производственной практике, то используют термин «промышленный катализ». В теории катализа описывается механизм и кинетика каталитических реакций на молекулярном и ионном уровне (микроуровне), в промышленном же катализе, который здесь излагается, изучается макрокинетика, т. е. кинетика каталитических процессов, включающих собственно химическую реакцию и стадии подвода реагентов в зону реакции и отвода продуктов (диффузионные процессы).
Катализ может нарушиться в результате изменения состава и структуры катализатора, происшедшего из-за побочных химических реакций или механических и температурных воздействий. При возбуждении разветвленных цепных реакций, в частности реакций, приводящих к взрыву, возможно в принципе и однократное участие катализатора в химической реакции.
Энергия Гиббса катализатора до акта катализа и после него неизменна. Поэтому в одномаршрутных обратимых реакциях катализатор ускоряет достижение равновесия, но не смещает его.
Константа равновесия К любой химической реакции определяется изменением энергии Гиббса ?g при данной абсолютной температуре Т:

Ускоряющее действие катализаторов весьма специфично и сильно отличается по эффективности и механизму воздействия от влияния других параметров процесса. Как известно, скорость технологического процесса можно повышать, изменяя температуру, давление, концентрацию реагентов, применяя перемешивание реагирующих масс и катализаторов.
Скорость процесса и выражают изменением количества продукта Gn, его концентрации Сц и степени превращения х основного исходного вещества во времени ?. Соответственно уравнение скорости процесса в проточных реакторах для процессов, протекающих при незначительном осевом (продольном) перемешивании реагентов с продуктами реакции, будет иметь вид:

Движущую силу процесса можно увеличить, повышая концентрации реагентов С и давление Р до оптимальных значений. Перемешивание приводит к увеличению k только в случаях медленной диффузии реагентов в зону реакции. Температура — наиболее универсальное средство интенсификации технологических процессов, повышение ее ускоряет химические реакции и в меньшей степени диффузию. Однако рост температуры ограничен термостойкостью материалов и в обратимых экзотермических процессах приводит к уменьшению АС. Таким образом, интенсифицирующее действие всех параметров технологического режима, за исключением действия катализаторов, возможно лишь до определенного предела.
Катализаторы могут неограниченно повышать k, не влияя на АС. Применение катализаторов — наиболее эффективный прием интенсификации химических процессов. Однако в отличие от действия температуры катализаторы не влияют на скорость диффузии. Поэтому во многих случаях при значительном повышении скорости реакции суммарная (общая) скорость остается низкой из-за медленного подвода компонентов в зону реакции.
Каталитический процесс представляет собой совокупность каталитических реакций на поверхности катализатора с процессами подвода реагентов в зону реакции и отвода продуктов реакции.
В общем случае катализ на твердых пористых катализаторах складывается из следующих элементарных стадий:
- Эффективная внешняя диффузия реагирующих веществ из ядра потока к поверхности зерен катализатора. При этом коэффициент эффективной диффузии D3 является функцией коэффициентов нормальной (молекулярной) диффузии D и турбулентной (конвективной) диффузии D?. Последний называют также коэффициентом перемешивания, так как D? действительно выражает конвективный перенос вещества, вызванный турбулентным движением потока в слое катализатора.
- Эффективная внутренняя диффузия в порах зерна катализатора. В зависимости от соотношения размеров пор и молекул газов внутренняя диффузия может проходить по нормальному молекулярному механизму или в стесненном движении по механизму Кнудсена. Она может быть функцией D и коэффициента диффузии Кнудсена DK.
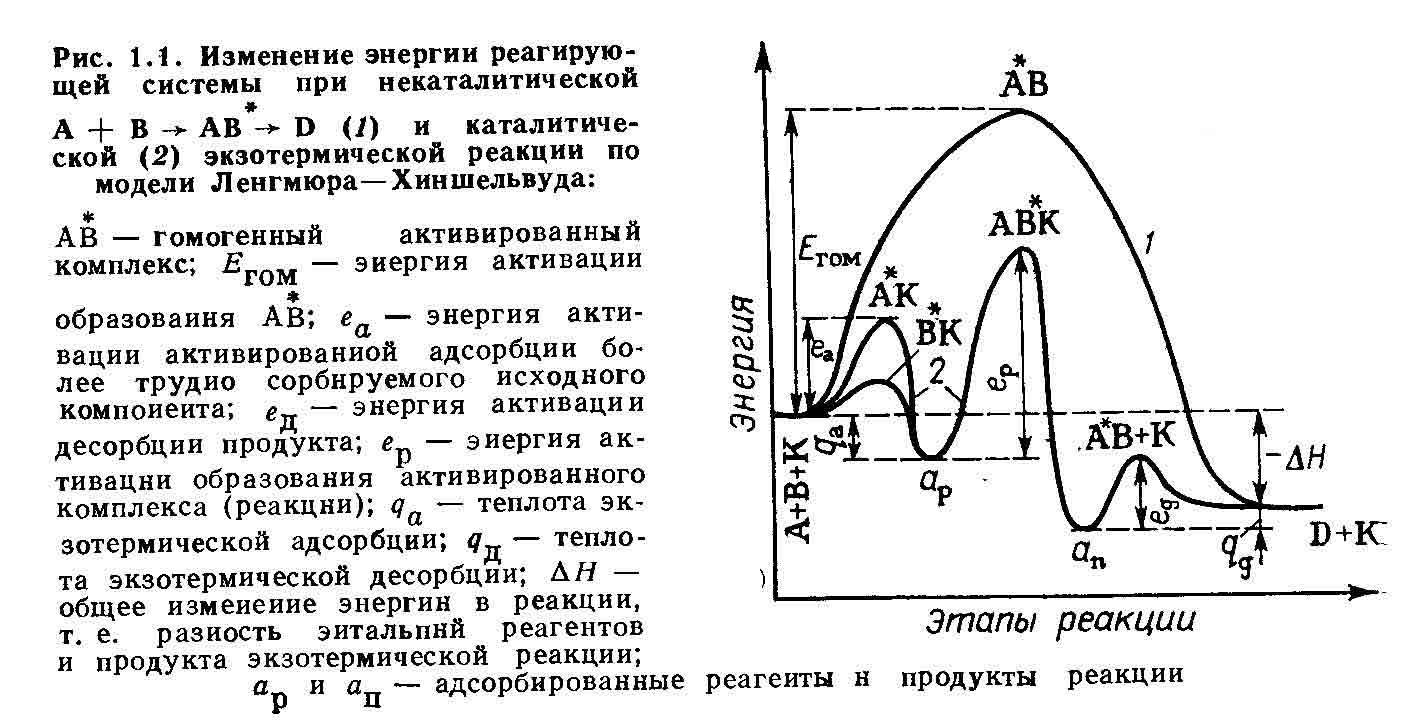
- Активированная (химическая) адсорбция одного или нескольких реагирующих компонентов на поверхности катализатора с образованием поверхностного химического соединения (рис. 1.1).
- Перегруппировка атомов с образованием поверхностных комплексов продукт-катализатор.
- Десорбция продукта катализа (регенерация активного центра катализатора).
- Диффузия продукта в порах зерна катализатора.
- Диффузия продукта от поверхности зерна.
Каждая из стадий каталитического процесса должна обладать энергией активации е, значительно меньшей, чем энергия активации гомогенной реакции Егом. В противном случае протекание процесса каталитическим путем может оказаться энергетически невыгодным.
<<Назад в библиотеку