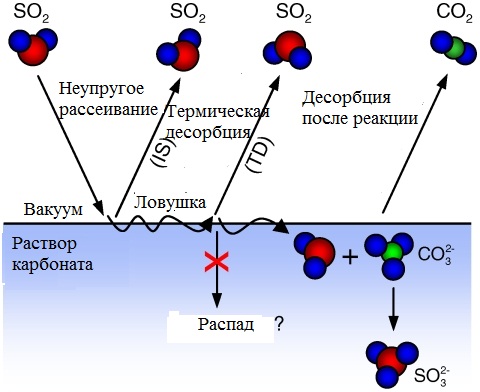
Для исследования реакции взаимодействия SO2 на поверхности извести при температуре 683 К был использован метод молекулярных пучков. Мы считаем, что две трети молекул SO2, которые термализовались на поверхности расплава преобразуются до газообразного CO2 по реакции SO2(г) + CO2-3(ж) → CO2(г) + SO2-3. Вероятность протекания реакции в диапазоне температур между 683 и 883 К не изменяется, что приводит к повышение реактивности при более высоких температурах и снижению времени нахождения SO2 на поверхности фаз Результаты демонстрируют высокую эффективность протекания реакции SO2 → CO2 вследствие высокой реакционной способности извести по сравнению с сухим карбонатом кальция или мокрой суспензией, которые обычно используется для сероочистки дымовых газов на электростанциях.
Атмосферное окисление диоксида серы, который образуется при сжигании ископаемых видов топлива является источником кислотных дождей и мелких дисперсных частиц, которые оказывают негативное влияние на здоровье человека [1-3]. При сжигании угля на электростанциях образующиеся (75-98)% SO2 удаляются в результате реакции с влажной или сухой известью, которая преимущественно состоит из CaCO3[4]. По реакции[5]:
В результате многочисленных механических [6-8] и кинетических [9,10] исследований этой реакции с использованием сухой извести были установлены значения энергии активации в пределах от 10 до 150 кДж моль-1 [9,10]. Такой скачок, вероятно, вызван различиями в составе и пористости частиц, наличием или отсутствием водяного пара, а также накоплением примесей [9]. Преобразование SO2 → CO2 на поверхности CaCO3 происходит посредством физической адсорбции от O-2от до молекулы SO2[8].
Ольденкамп и Марголин разработали альтернативный метод для удаления SO2 из дымовых газов за счет использования расплавленной эвтектической смеси Li2CO3, Na2CO3 и K2CO3 [11]. Этот реагент позволяет избежать различий в условиях и может использоваться для твердых известняков [11, 12]. При использовании раствора карбоната и температуре 800 К, почти 100% SO2 за 0,05 с [12]. На практике эффективность поглощения может быть на несколько порядков выше, чем для твердых CaCO3. Однако ван Houte и Delmon предполагают, что лишь 10-5% SO2 поглощается за 0,05 с, отчасти потому, что окисление продукта CaSO3 образует твердый слой сульфата, который препятствует газовому потоку к карбонату [10].
Необычная реакционная способность раствора карбоната и его низкое давление пара обеспечивает возможность исследовать преобразование SO2в CO2 на атомном уровне с проведением газо-жидкостных экспериментов. Рисунок 1 иллюстрирует различные пути, которые могут возникнуть у молекул SO2 молекулы при попадании на поверхность раствора карбоната.
Если молекула имеет более высокую энергию, чем тепловая энергия жидкости, то она может неупруго рассеиваться с поверхности в результате одного или нескольких столкновений, при этом сохранив значительную часть своей первоначальной энергии во время столкновения [13].
Кроме того, входящие молекулы могут полностью рассеять избыток кинетической энергии за счет многократных столкновений и оказаться ненадолго неподвижными на поверхности раствора.
Исследования рассеяния обеспечивают детальную картину событий описанных выше и доказывают, что SO2 легко превращается в СО2 в пределах 10-6 с

В точке тройной эвтектики карбонат состоит из Li2CO3 (44 % молей), Na2CO3 (31% молей), K2CO3 (25% молей) где плавится при температуре 672 К [14]. При этой температуре вязкость смеси составляет 40 сП, а ее поверхностное натяжения – 240 дин см-1( 16 ). В растворе происходит диссоциация карбонат иона по схеме: [17,18]
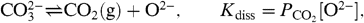
Для исследования процесса термолизации реакции диоксида углерода с раствором карбоната контролировалась энергия столкновений от 16 до 240 кДж моль-1 и температура 683-883 К Оба спектра были записаны для измерения потока диоксида серы (в качестве реагента) и диоксида углерода (в качестве продукта реакции).
Из первого эксперимента столкновения молекул диоксида серы с энергией равной 16 кДж моль-1, которая на 50% больше, чем средняя тепловая энергия газа при Т = 683 К на рисунке 2 видно, что рассеяные молекулы диоксида на зеленом и красном спектрах не реагируют на столкновение. Два спектра имеют одинаковую форму, и каждый хорошо подходит на распределение Максвелла-Больцмана (МБ) при Т = 683 К. Это означает, что низкоэнергетические молекулы диоксида серы рассеивают избыток поступающей энергии изменяя термическое равновесие, при столкновении происходит десорбция в газовой фазе.
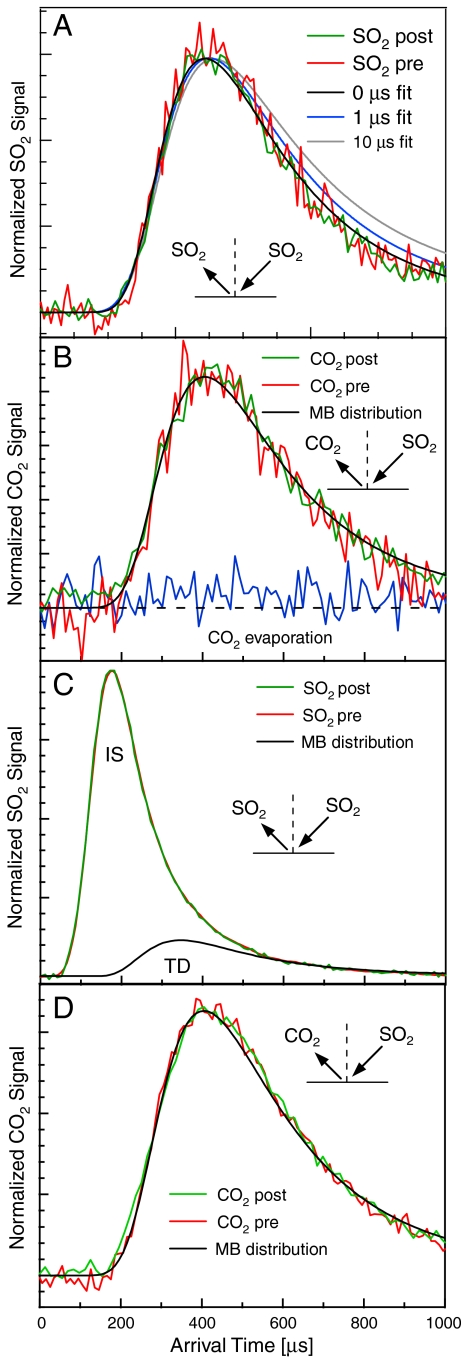
Перекрытие между спектрами предполагает, что время пребывания непрореагировавших молекул диоксида серы в смеси карбоната менее 10-1с [22]. Время пребывания можно получить, используя поток баланса на газо-жидкостной границе, а также решив уравнение диффузии. В этой модели, τ – это время, в котором исходящий поток газа достигает 57% от входящего потока, когда жидкость насыщается газом [13,22]:
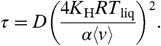
Д и КН – это диффузии и физическая растворимость диоксида серы в растворе. Рисунок 2 является самым важным результатом и показвает, что молекулы диоксида углерода десорбируются из раствора при воздействии энергии при воздействии 16 кДж моль-1 и температуре эвтектике 683 К. Спектры диоксида углерода имеют одинаковую форму и каждый подходит под распределение Максвелла-Больцмана при температуре эвтектики 683 К. Это означет что молекулы диоксида углерода находятся в тепловом равновесии до процесса десобции продукта из раствора. Пересечение между спектрами показывает, что в результате комбинированной реакции диоксида серы и диоксида углерода в объемной фазе время пребывания должно быть меньше чем 10-6 с. Отметим, что все спектры были неизменными в течение нескольких часов эксперимента, подразумевая, что поверхность расплавленного карбоната оставалась свежей и не покрываются твердой оболочкой сульфита.
Фактическая доля молекул, которые вступают в реакцию при столкновении с раствором может быть измерена двумя способами: путем наблюдения за образованием диоксида углерода и мониторинга исчезновения диоксида серы. Первый метод основан на сравнении потоков термической десорбции диоксида серы и молекул диоксида углерода. Предполагается, что термически десорбирующиеся классы имеют одинаковые угловые распределения, вероятно в форме косинуса [13,26]. Таким образом, соотношение потоков десорбции при угле наблюдения 55° равное. Отношение потоков проинтегрированная по всем углам выхода. Вероятность реакции расчитывается:
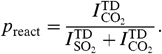
Эта вероятность имеет доверительный интервал 0,68 ± 0,04 (95% доверительный интервал).
Вероятности реакции могут быть также получены с помощью метода Кинга и Уэльса, основаном на контроле поглощения диоксида серы, а не диоксида углерода.Во втором методе, вероятность поглощения имеет вид:
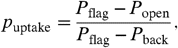
Вероятность реакции может меняться в зависимости от температуры раствора, времени пребывания диоксида серы на поверхности или в растворе. Чтобы измерить эти зависимости реакция измерялась в 50 интервалах от 683 К до 883 К. Спектры были измерены в последовательности 683 →733 → 783 К и 683 → 833 → 883 К, а затем последовательности были повторены. Каждый эксперимент начинался в диапазоне температур 683 K для испарения диоксида углерода. Данные рисунка 3 показывают, что система газ-жидкость не изменяется с температурой.
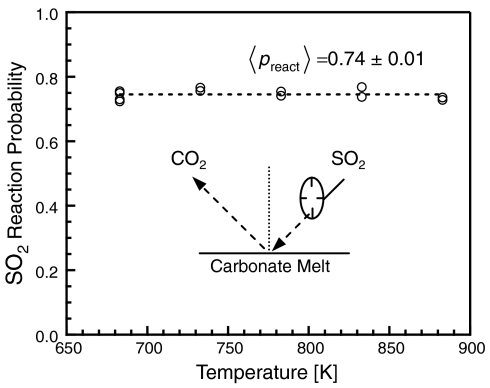
Эксперименты по рассеянию показывают, что диоксид серы легко реагирует межфазной области раствора карбоната, намного быстрее чем на поверхности сухого известняка или же в водной суспензии извести. Измерения имели стационарный режим и вероятность поглощения составила 0.60-0.74.
Большая вероятность протекания реакции с карбонатом должна возникать из-за высокой плотности и подвижности щелочных ионов, которые окружают молекулы диоксида серы в межфазной области. Рисунок 5 показывает что при вероятности реакции остается постоянным в диапазоне температур от 683 до 883 К. С практической точки зрения, нечувствительность к температуре может быть выгодна, так как предполагает, что эффективное удаление диоксида серы не ограничивается температурами, близких к точке эвтектики.