Источник: Сайт проекта SWorld
http://www.sworld.com.ua/index.php/en/component/content/article/27-electrical-engineer-radiotrician-telecommunication-and-electronics/2686-sagaydak-astarasyuk-vp
Сагайдак А.С.,Тарасюк В.П.
ОПРЕДЕЛЕНИЕ РАСТВОРЕННОГО КИСЛОРОДА В ВОДЕ
Донецкий национальный технический университет
В данном докладе рассматриваются оксиметры-приборы для измерения растворенного кислорода в воде, а также методы, с помощью которых реализуют работу этих приборов.
Ключевые слова: кислород, концентрация, оксиметр, полярографический метод.
This report examines the oximeters, devices for measuring dissolved oxygen in water, and the methods by which the work of implementing these devices.
Key words: ultra-high-level language, the development of, oxygen, concentration, oksymetr, polarographic method.
Актуальность. Конец ХХ века характеризуется мощным рывком научно-технического прогресса, ростом социальных противоречий, резким демографическим взрывом, ухудшением состояния окружающей человека природной среды.
Вода характеризиется рядом физическо-хиических свойств, одним из которых является кислоро. Вода-бесцветная жидкость, простейшее химическое соединение водорода с кислородом. Природная вода всегда содержит растворенные в ней соли различных химических элементов, большое количество взвешенных веществ минерального и органического происхождения, от которых зависит степень ее прозрачности.
Современное состояние водной среды не отвечает санитарно-гигиеническим нормам. Но уровень автоматизации современных приборов позволяет обеспечить оперативный контроль этих параметров в различных средах. Также существует проблема и необходимость контроля растворенного кислорода в реках, озерах, а также в водах, не пригодных для использования.
Физико - химических свойства неводных растворителей и растворов на их основе имеют важное значение в связи с тем, что они играют большую роль практически во всех природных и технологических процессах.
Растворённый кислород – один из важнейших показателей качества воды. Контроль его содержания проводится как в природных незагрязнённых водах, так и в одах прошедших очистку. Прежде всего, растворённый кислород в водоёмах важен для живых организмов, обитающих в водной среде. Изменение его концентрации может быть вызвано как естественными факторами, так и антропогенными.
Постановка задачи. Исследовать кислород как элемент атмосферы с точки зрения измерения и автоматизированного контроля , проанализировать существующие раззработки в области измерения концентрации кислорода в воде.
Основная часть. Объктом исследования являеться вода реки Кальмиус.
Кислород является одним из важнейших растворенных газов, постоянно присутствующих в поверхностных водах, режим которого в значительной степени определяет химико-биологическое состояние водоемов. Доказано,что в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твёрдой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50 % их общей массы. Главными источниками поступления кислорода в поверхностные воды являются процессы абсорбции его из атмосферы и продуцирование в результате фотосинтетической деятельности водных организмов. Растворенный кислород в поверхностных водах находится в виде молекул О2. Его растворимость растет с понижением температуры минерализации и повышением давления. Насыщение воды кислородом, соответствующее нормальной концентрации, принимается равным 100%.
Разностороннее использование кислорода обусловлено его свойствами: нетоксичен, не взрывоопасен, не горюч, не имеет цвета, вкуса и запаха. Относится к окислителям, обеспечивая тем самым горение различных материалов. Высокая прочность химической связи между атомами в молекуле О2 приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен.
В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л и подвержено значительным сезонным и суточным колебаниям. Концентрация кислорода определяет величину окислительно - восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений [4].
Как правило, изменение концентрации кислорода при сбросе вызывается его расходованием на окисление легкоокислимых веществ, присутствующих в сточных водах. Однако, нерастворимые в воде маслянистые вещества, нефтепродукты создают на поверхности воды плёнку, которая препятствует растворению кислорода, вызывая снижение его концентрации.
В связи с этим, все сточные воды, участвующие в технологическом процессе, проходят очистку [3].
Процесс очистки любых сточных вод сопровождается постоянным контролем концентрации растворённого кислорода, так как он является одним из показателей качества воды.
В результате разнообразных процессов окисления кислород постоянно переходит из свободного состояния в связанное. Однако количество свободного кислорода остаётся практически неизменным, так как убыть его компенсируется жизнедеятельностью растений.
Методы химического анализа основываются либо на свойствах воды, изменяющихся с изменением концентрации кислорода в ней и на свойствах растворённого кислорода. К ним относятся: объемные: иодометрические, колориметрические и фотометрические, электрохимические (амперо-, вольтамперометрические, полярографические, кулонометрические, кондуктометрические (радио-метрические, хроматографические, масспектрометрические и т. д.). Эта классификация довольно условна так как большинство методов переплетаются между собой.
Среди электрохимических методов наибольшее распространение получили амперометрические и полярографические методы с использованием полупроницаемых мембран, отделяющих электроды в растворе электролита от исследуемой воды. Мерой содержания кислорода служит величина диффузионного тока восстановления его на твердых электродах. В качестве анодов чаще всего используется серебро, кадмий, цинк, железо, катоды изготовляют из серебра, золота, платины, палладия, родия. В качестве материала для полупроницаемых - полимерные полиэтиленовые и фторопластовые пленки, обладающие высокой химической и термической стойкостью [5].
Полярографический метод основан на поляризации погруженного в электролит индикаторного электрода при подаче напряжения от внешнего или внутреннего источника. Напряжение E, приложенное к цепи, распределяется в ней по закону Ома, то есть в каждый данный момент значение налагаемого на электроды напряжения равно сумме скачков потенциала на аноде и катоде , а также падению напряжения в растворе электролита (1):
E=φa-φk+I·r (1)
где - I ток, проходящий через полярографическую ячейку; r - сопротивление раствора электролита.
Если поляризуется анод, то плотность тока сравнительно велика на катоде и очень мала на аноде. В этом случае потенциал анода φa равен нулю и он служит началом отсчета для потенциала катода. Тогда равенство (1) записывают таким образом (2):
E=-φk+I·r (2)
При силе тока приблизительно в 10А, протекающего через полярографическую ячейку, и сопротивлении раствора электролита не больше нескольких кОм, падение напряжения в растворе будет составлять несколько мВ. Поэтому выражение (2) будет иметь вид (3):
E=-φk (3)
Если обеспечить малое сопротивление раствора, то можно считать, что числовое значение поляризующего напряжения равно потенциалу поляризующего электрода.
Если катод не поляризуется, то плотность тока сравнительно велика на аноде и очень мала на катоде. В этом случае потенциал катода φk считают нулем и он служит началом отсчета для потенциала анода. При анодной поляризации (4):
E=φa (4)
т.е. потенциал анода зависит от напряжения, поданного на полярографическую ячейку.
График зависимости тока от напряжения называют поляризационной кривой или полярограммой. Эта характеристика описывается видоизмененным уравнением Нернста (5):
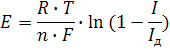 (5)
(5)
где E - разность между равновесным потенциалом и потенциалом поляризованного электрода; R - газовая постоянная; T - абсолютная температура; n - число электронов, участвующих в суммарной электрохимической реакции; F - число Фарадея; I - ток, проходящий через полярографическую ячейку; Iд - диффузионный ток.
Схема полярографа (рис.1) состоит из : 1 - анода (слой ртути на дне ячейки); 2 - электролита; 3 - катода (ртутного капельного электрода); 4 - микроамперметра; 5 - реостата; 6 – источника питания.
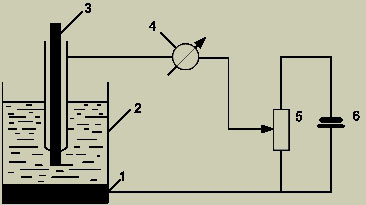
Рис. 1. Схема полярографа
Полярограмма раствора (рис. 2) содержит определяемый компонент. При наложении на электроды разности потенциалов, увеличивающейся в течении времени, через электролит, с растворенным в нем определяемым компонентом пробы, протекает небольшой ток. Но при поляризации индикаторного электрода ток быстро увеличивается и достигает предельного значения, не зависящего от потенциала электрода.
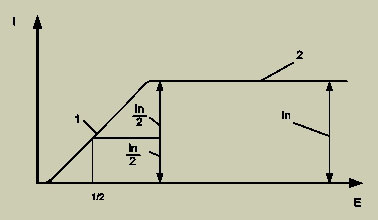
Рис. 2. Полярограмма раствора
Химические методы не требуют специальной аппаратуры, кроме лабораторной посуды. Но они требуется большое количество разнообразных химических реактивов, которые бывают ядовитыми. Также большую сложность представляет удаление веществ искажающих результаты измерений.
Электрохимические методы не имеют недостатков описанных выше. Современные датчики, сконструированные на основе электрохимических методов компактны, точны, просты в использовании. Эти датчики используются как на партитивных, так и на стационарных анализаторах.
Многие фотометрические и люминесцентные методы являются очень точными. Но основным их недостатком является то, что для проведения анализа необходимы реактивы и вещества сложные для синтеза. Люминесцентные и хемилюминесцентные методы требуют очень сложной аппаратуры и громоздких фотоумножителей.
С целью определения раствореного кислорода в воде разработаны специальные приборы - анализаторы кислорода (оксиметры), предназначенные для измерения концентрации растворенного кислорода с помощью полярографического метода. На данный момент существует множество модификаций оксиметров: портативные и стационарные, специальные модели для промышленности, лабораторные анализаторы. Но все они имеют небольшой диапазон измерений и малый порог чувствительности. Важным параметром является продолжительность анализа, линейность и повторяемость в процентах от диапазона измерений. Некоторые анализаторы кислорода имеют механизмы компенсации мешающих элементов (элементов, вступающих в реакцию с кислородом, и препятствующих точной оценке его концентрации в данной субстанции).
Все оксиметры смогут формировать унифицированные сигналы с дальнейшей их передачей по стандартизированным протоколам к контроллеру и на операторские пульты. Также будут разрабатываться использование микропроцессорных технологий для реализации передачи записей в память результатов измерений, соединения с другими устройствами, а также мониторинга и анализа процесса.
Проведенный анализ показал ,что наиболее приемлемым для данного бекта является полярографический метод. На основании этого метода разработана структурная схема анализатора кислорода (рис.3):
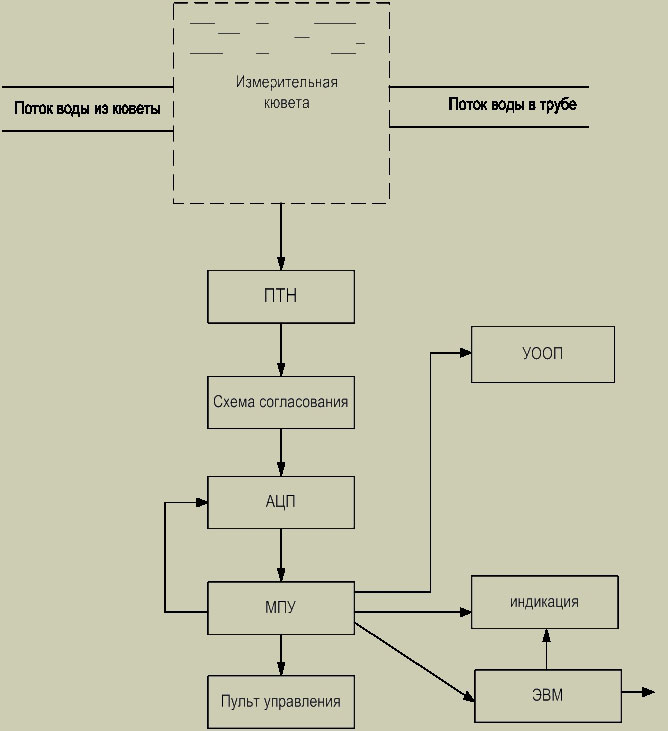
Рис. 3. Структурная схема анализатора кислорода
На рисунке 3 обозначено: ПТН - преобразователь "ток - напряжение ", УООП- устройство отбора ,обработки проб, МПУ- микропроцессорное устройство.
Выводы
Проведенный анализ показал,что контроль за состоянием содержания кислорода необходим в режиме экспресс-анализа.
Наиболее оптимальным методом определения кислорода в воде является порлярографический метод. На основании этого метода была разработана структурная схема анализатора кислорода, которая отличается от существующих принципом действия основанным на экспресс- анализе без дополнительных пробоотборов и может быть включена в контур автоматического контроля управления параметрами экосистемы реки Кальмиус.
Литература
-
http://www.lib.ua-ru.net/diss/cont/145890.html
-
http://www.ecounit.ru/artikle_67.html
Муравьев А.Г. Руководство по определению показателей качества воды полевыми методами. 2-е изд., перераб. и дополн. СПб.: "Крисмас 1999.-232с.
Степанюк И.А. Океанологические измерительные преобразователи / И.А. Сте- панюк - Л.: Гидрометеоиздат, 1986. - 269 с.
Агасян П.К. Основы электрохимических методов анализа. М.: Химия, 1984. 168 с.
Фомин Г.С. Вода. М.: Протектор, 2000 848 с.
Стромберг А.Г. Физическая химия. М.: Высшая школа, 1988. 496 с.