Анализ путей окисления метана до уксусной кислоты, катализируемой Pd2+ в серной кислоте, с помощью теории функционала плотности
Шаи Чемпах Алексис Т. Белл
Доклад Отдела Химической инженерии , Калифорнийского университета,
Беркли, Калифорния 94720-1462
22 августа 2005; E-mail: bell@cchem.berkeley.edu
перевод Андриевского А.П. 94720-1462
Реферат Теория функционала плотности была использована, чтобы исследовать термодинамику и барьер активации реакции прямого окисления метана до уксусной кислоты, катализируемой катионом Pd2+ в растворе окруженного двумя анионами бисульфата и одной или двумя молекулами серной кислоты. Окисление метана инициируют внедрением СН4 через одну из связей Pd-O бисульфатного лиганда до формы Pd(HSO4)(CH3)(H2SO4)2. Еще одной разновидностью является реакция с СО до образования Pd(HSO4)(CH3СО)(H2SO4)2. Наиболее вероятным путём образования конечных продуктов является из Pd(HSO4)(CH3)(H2SO4)2 и Pd(HSO4)(CH3СО)(H2SO4)2образование форм Pd(2-HSO4) (HSO4)2(CH3)(H2SO4) и Pd(2-HSO4) (HSO4)2(CH3СО)(H2SO4) соответственно. CH3HSO4 илиCH3СОHSO4 являются продуктами восстановительного элиминирования последних двух разновидностей, а CH3СООН – продукт гидролиза CH3СОHSO4. Переход Pd2+ из раствора в Pd0 или палладиевую чернь возможно происходит с сокращением СО. Этот процесс смещается повторным окислением палладия или H2SO4 или O2.
Введение Прямое преобразование метана в другие химические вещества является предметом устойчивого интереса. Одним из продуктов, которых может быть получен таким образом, является уксусная кислота, товарный химикат, широко используемый в химической промышленности. Периана и др. сообщили, что катионы Pd2+ в 96% серной кислоте будет катализировать прямое окисление метана при 453К до уксусной кислоты, с образованием бисульфата (предшественника метанола) и двуокиси углерода как единственными побочными продуктами. Тем не менее, в течение реакции восстановленныйPd2+ осаждается из раствора как палладиевая чернь, приводя к потере катализатора. Авторы отмечают, что H2SO4 может окислить палладиевую чернь до Pd2+ , однако уровень при котором проходит реакция недостаточен, чтобы обеспечить содержание Pd в растворе. Зрелла и Белла подтвердили эти результаты и показали, что удержанием Pd2+ в растворе управляет баланс между окислительно-восстановительными потенциалами реакционной системы. Эти исследователи сообщали, чтодобавляя кислород к подаче метана и управляя давлением реагентов, фактически все Pd2+ могут быть сохранены в растворе. Эти условия также приводят к повышению выхода уксусной кислоты относительно того, что наблюдалось в отсутствие O2.
Понимание элементарных процессов, входящих в активацию и окисление метана, катализируемого катионами Pt и Au в серной кислоте, было получено с помощью квантово-химических исследований. Циглер и соавторы изучили механизм активации и функционализации метана с помощью Pt2+ в серной кислоте и заключили, что активация метана происходит предпочтительно через окислительное присоединение. Их вычисления также подтвердили, что Pt2+- CH3 может быть окислен до Pt4+- CH3SO3. Годдард и соавторы изучили ту же систему и исследовали влияние различных лигандов на стабильность и поведение катализатора. Они показали, что активация связи С-Н может происходить через электрофильное замещение или окислительное присоединение, в зависимости от лигандов на платиновом центре. Джонс и др. получали экспериментальные и теоретические данные для преобразования метана в метанол смесью селеновой и металлическим золотом в 96%-ной серной кислоте. Их исследования показывают, что метан подвергается реакции электрофильного замещения и что каталитический цикл включает Au+-Au3+ или пары Au2+-Au4+ . Активация метана включает отщепление протона группой бисульфата и характеризуется барьером активации 28,1 ккал/моль.
Здесь мы сообщаем результаты квантово-химических исследований, нацеленных на выявление критических стадий, включаемых в окисление метана до уксусной кислоты, катализируемого катионами Pd2+ находящимися в концентрированной серной кислоте.
Эти вычисления были произведены с использованием теории функционала плотности (DTF).
Влияния растворителя, серной кислоты были описаны и явно и неявно. Наши цели состояли в том, чтобы определить формы в которых Pd2+стабилизированв концентрированной серной кислоте и вычислить изменения во внутренней энергии и свободной энергии элементарных процессов, которые включены в активацию метана и формирование бисульфата метила и уксусной кислоты. Энергии активации и свободные энергии были также определены для всех основных стадий. На основе нашего анализа путей реакции мы предполагаем, что октаэдрическим образом координированныйPd4+ сформировался в течение реакции и что разновидности значительно влияют на формирование метилового бисульфата и уксусной кислоты. Была также исследована термодинамика стабилизации Pd2+ в растворе.
Теория Электронные энергии реагента, продукта и переходных состояний были определены с помощью теории функционала плотности(DFT).Функция B3LYP была использована для описания электронного обмена и корреляции, а базисный комплекс 6-31G использовался для оптимизации стандартного состояния и структуры переходного состояния. Эффективный основной потенциал LANL2DZ использовался, чтобы описать атом Pd. Вся оптимизация геометрии была сделана, используя Gaussian 03. Бесплатное программное обеспечение Molden использовалось для визуализации конфигураций и вибрационных частот. После оптимизации специфических молекулярных структур встационарных точках (переходное состояние или минимальная энергетическая структура), их энергия была далее уточнена с более высоким уровнем точности, используя LACV3P ** ++ базисный комплекс, который был использован в программном обеспечении Ягуар. Структуры палладия были обработаны, используя эффективные основные потенциалы в пределах базисного комплекса LACV3P ** ++. Все стационарные состояния были найдены на основе вычислений газовой фазы, и затем их энергия в растворе была вычислена, используя Poisson-Boltzmanncontinuum (PBC) модель, которая доступна с Ягуаром. Метод "растущей последовательности", разработанный Петерсом и другими [11], использовался, чтобы определить геометрию переходного состояния, соединяющего две минимальных энергетических структуры. В этом методе минимальный энергетический путь, соединяющий реагент и изделие, оценен без проведения начальнойоценки пути реакции. Состояние с наивысшей энергией на реакционном пути является переходным. Это состояние далее переходит к «седловой точке».Алгоритм расчета переходного состояния осуществлен в пакете Gaussian 03. Все переходные состояния, были проверены наналичие только одной воображаемой частоты. Минимальные энергетические пути и частоты всех переходных состояний даны в сопутствующей информации. Свободные энергии были определены в пределах твердого ротора, приближения гармонического осциллятора. Стандартные свободные энергии были вычислены с учетом, вращательных и вибрационных функций разделения. Матрица Гессе, требуемая для вибрационного анализа, была рассчитана с помощью базисаLANL2DZ/6-31G*. Детали относительно вычислений свободных энергий в жидкой фазе - даны в сопутствующей информации, так же как оценки.
Статьи Оптимизация геометрии в жидкой фазе может также быть сделана, используя модель сольватации КОСМО, осуществленную в пакете программного обеспечения TURBOMOLE v.5.6 [12], но не используя другие квантовые коды. Для случаев, которые рассматривают, различия в энергии сольватации для структур, оптимизированных в газовых и жидких фазах, было незначительно. Например, для Pd - (HSO4)2(H2SO4) энергия сольватации составляет-31.25 ккал/моль для структуры, оптимизированной в газовой фазе и-32.04 ккал/моль для структуры, оптимизированной в жидкой фазе. Эти вычисления были сделаны с SV (P) базисный комплект, осуществленным в TURBOMOLE наряду с моделью сольватации КОСМО.
Сольватация палладия. Экспериментальные исследования реакции окисления метана до уксусной кислоты, катализируемой катионами Pd2+ в концентрированной серной кислоте (обычно 96 % мас), полученных растворением PdSO4 или PdCl2 (1,2)в 70-100%-ной H2SO4.В растворе в основном присутствуют H2SO4, H2O, H+ и HSO4-. Концентрация ионных разновидностей является малой, pKaконцентрированной серной кислоты низка (10-4).[13,14].
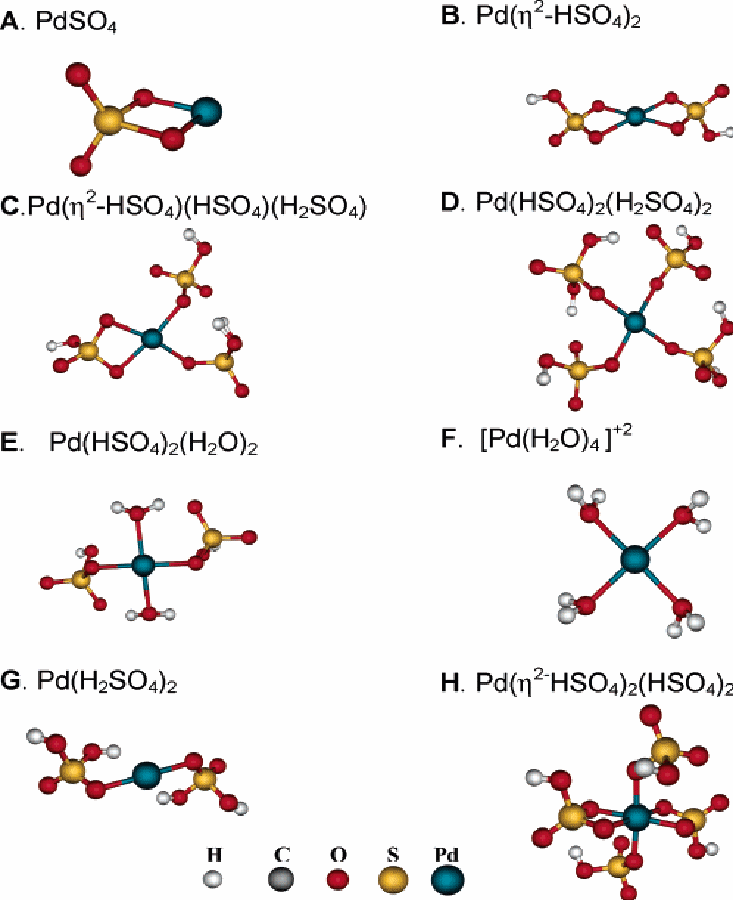
Возможные структуры для Pd2+растворенного в серной кислоте показаны на рисунке 1. PdSO4 может объединиться с молекулой H2SO4 в формуPd(η2-HSO4)2, в которой анионы бисульфата – бидентатные лиганды (то есть η2-связи). В дальнейшем молекулы растворителя могут присоединяться к Pd(η2-HSO4)2, содержащий четырехскоординированный катион Pd2+. В растворе серной кислоты устойчивая форма - бисульфат палладия сольватированный одной или двумя молекулами растворителя. Расчетные изменения во внутренней энергии и стандартной свободной энергии даны ниже для реакций сольватации. Как упомянуто ранее, ∆G° определен для 453 K, как представительной температуры реакции.
PdSO4 + H2SO4 ↔ Pd(η2-HSO4)2
∆Е=- 7.0 ккал/моль, ∆Go =-7.2 ккал/моль (1)
Pd(η2-HSO4)2+H2SO4 ↔ Pd(η2-HSO4)(HSO4) (H2SO4)
∆Е=- 5.2 ккал/моль, ∆Go =-2.5 ккал/моль (2)
Pd(η2-HSO4)(HSO4) (H2SO4)+ H2SO4 ↔ Pd(HSO4)2(H2SO4)2
∆Е=- 4.3 ккал/моль, ∆Go =-6.0 ккал/моль (3)
Все разновидности Pd2+ являются четырехкоординированным плоским квадратом. Если дополнительные молекулы принесены выше или ниже плоскости, они не соединяются с центром атома Pd. Это верно для всех разновидностей Pd2+, изученных здесь.
Таблица 1
|
№ |
реакция |
∆Е |
∆Go |
|
Сольватация Палладия |
|||
|
1 |
PdSO4 + H2SO4 ↔ Pd(η2-HSO4)2 |
-7,0 |
-7,2 |
|
2 |
Pd(η2-HSO4)2 + H2SO4 ↔ Pd(η2-HSO4)(HSO4)(H2SO4) |
-5,2 |
-2,5 |
|
3 |
Pd(η2-HSO4)(HSO4)(H2SO4) + H2SO4 ↔ Pd(HSO4)2(H2SO4)2 |
-4,3 |
-6,0 |
|
4 |
Pd(η2-HSO4)2 + 2H2O ↔ Pd(HSO4)2(H2O)2 |
-23,3 |
+5,6 |
|
5 |
Pd(HSO4)2(H2O)2 + H2O ↔ [Pd(HSO4)(H2O)3]+ + HSO4- |
-2,1 |
-0,4 |
|
6 |
[Pd(HSO4)(H2O)3]+ + H2O ↔ [Pd(H2O)4]2+ + HSO4- |
-2,0 |
-4,5 |
|
Активация метана |
|||
|
7 |
Pd(η2-HSO4)(HSO4)(H2SO4) + CH4 → Pd(η2-HSO4)(HSO4)(CH3)(H)(H2SO4) |
+30.4 |
+44.0 |
|
8 |
Pd(η2-HSO4)2 + CH4 → Pd(η2-HSO4)(CH3)(H2SO4) |
+2.9 |
+13.7 |
|
9а |
Pd(η2-HSO4)(HSO4)(H2SO4) + CH4 → Pd(HSO4)(CH3)(H2SO4)2 |
-4.6 |
+8.6 |
|
9b |
Pd(η2-HSO4)(HSO4)(H2SO4) + CH4 → Pd(HSO4)(CH3)(H2SO4)2 |
+5.5 |
+18.3 |
|
10 |
Pd(HSO4)2(H2SO4)2 + CH4 → Pd(HSO4)2(H2SO4)(CH4) + H2SO4 |
+15.3 |
+28.8 |
|
Внедрение СО |
|||
|
11 |
Pd(η2-HSO4)(HSO4)(H2SO4) + СО ↔ Pd(η2-HSO4)(HSO4)(СО) + H2SO4 |
-13,1 |
+2,1 |
|
12 |
Pd(HSO4)2(H2SO4)2 + СО ↔ Pd(HSO4)2(H2SO4)(СО) + H2SO4 |
-8,9 |
+6,0 |
|
13 |
Pd(HSO4)(CH3)(H2SO4)2 + CO ↔ Pd(HSO4)(CH3)(CO)(H2SO4) + H2SO4 |
-24,5 |
+14,4 |
|
14 |
Pd(HSO4)(CH3)(CO)(H2SO4) + H2SO4 → Pd(HSO4)(CH3CO)(H2SO4)2 |
+8,0 |
+14,0 |
|
Формирование продуктов |
|||
|
15 |
Pd(HSO4)(CH3)(H2SO4)2 → Pd(H2SO4)2 + CH3HSO4 |
+35,5 |
+17,0 |
|
16 |
Pd(HSO4)(CH3CO)(H2SO4)2 → Pd(H2SO4)2 + CH3COHSO4 |
+28,7 |
+7,7 |
|
17 |
Pd(HSO4)(CH3)(H2SO4)2 + H2O → Pd(HSO4)(H)(H2SO4)2 + CH3OH |
+21,3 |
+23,4 |
|
18 |
Pd(HSO4)2(H2SO4)2 + H2SO4 + 1/2O2 → Pd(η2-HSO4)(HSO4)3(H2SO4) + H2O |
+25,3 |
+27,0 |
|
19 |
Pd(HSO4)(CH3)(H2SO4)2 + H2SO4 + 1/2O2 → Pd(η2-HSO4)(HSO4)2(CH3)(H2SO4) + H2O |
-11,8 |
-8,6 |
|
20 |
Pd(HSO4)(CH3CO)(H2SO4)2+H2SO4+1/2O2 → Pd(η2-HSO4)(HSO4)2(CH3CO)(H2SO4)2+H2O |
-14,3 |
-14,0 |
|
21 |
H2SO4 → H2O + SO2 + 1/2O2 |
+19,5 |
-4,7 |
|
22 |
Pd(η2-HSO4)(HSO4)2(CH3)(H2SO4) → Pd(η2-HSO4)(HSO4)(H2SO4) + CH3HSO4 |
-38,1 |
-53,7 |
|
23 |
Pd(η2-HSO4)(HSO4)2(CH3CO)(H2SO4) → Pd(η2-HSO4)(HSO4)(H2SO4)+CH3COHSO4 |
-19,2 |
-35,6 |
|
24 |
Pd(η2-HSO4)(HSO4)(H2SO4) + CO + H2O → Pd(H2SO4)2 + CO2 + H2SO4 |
-3,6 |
-11,5 |
|
25 |
Pd(HSO4)2(H2SO4)2 + CO + H2O → Pd(H2SO4)2 + CO2 +2H2SO4 |
-2,9 |
-31,2 |
|
26 |
CH3HSO4 + H2SO4 → CO + H2O + 2H2SO3 |
-39,0 |
-70,5 |
|
27 |
Pd(H2SO4)2 + H2SO4 → Pd(η2-HSO4)2 + SO2 + 2H2O |
-48,2 |
-76,3 |
|
28 |
Pd(H2SO4)2 + 1/2O2 → Pd(η2-HSO4)2 + H2O |
-67,7 |
-71,6 |
96% (масс.) H2SO4 содержится на 16% (моль), необходимо рассмотреть структуры в которых H2О действует как лиганд. Две альтернативы представлены на Рисунке 1(структуры Е и F). Изменение энергии для процессов, в которых вода заменяет анионы бисульфата или серной кислоты даны ниже:
Pd(η2-HSO4)2 + 2 H2О ↔ Pd(HSO4)2 (H2О)2
∆Е=- 23.3 ккал/моль, ∆Go =-5.6 ккал/моль (4)
Pd(HSO4)2 (H2О)2 + H2О↔[ Pd(HSO4)(H2О)3]+ + HSO4-
∆Е=- 2.1 ккал/моль, ∆Go =-0.4 ккал/моль (5)
[ Pd(HSO4)(H2О)3]+ + H2О ↔ [ Pd(H2О)4]2++ HSO4-
∆Е=- 2.0 ккал/моль, ∆Go =-4.5 ккал/моль (6)
Сравнение
значений ∆G° для примеров 1-3 и 4-6 показывает, что
замещение H2SO4
или HSO4
как лигандов H2O
является термодинамически невыгодно в концентрированной серной
кислоте. Оценки относительных долей различных видов Pd2
+
сведены в Таблицу 2 для растворов, содержащих 70-100 % (мас) H2SO4.
Результаты, о которых сообщают в этой таблице, основаны на
экспериментальных величинах для концентраций H2O,
H2SO4,
и HSO4-и
значения ∆G ° сообщали здесь (см. пример 1-6). Таблица 2
демонстрирует, что доминирующей форма растворенного Pd2+
вероятнее всего является Pd(HSO4)2(H2SO4)2,
тогда как Pd(η2-HSO4)(HSO4)(H2SO4)
и Pd(η2-HSO4)2
присутствуют на намного меньших концентрациях.

Рисунок 1 Структуры Pd , растворенного в серной кислоте : A-F – структуры содержащие Pd2+, G- Pd0, H – Pd4+
Работы Казанского и соавторов [13,14] свидетельствуют, что концентрированная серная кислота (~ 96% мас.) содержит более низкую концентрацию протонов чем разбавленный раствор H2SO4 в воде. Причиной этого явления является то, что H2SO4 менее эффективна в сольватации протонов чем H2O. Как следствие константа диссоциации H2SO4 в безводной кислоте составляет 10-4. Последующие вычисления показали, что диссоциация H2SO4 до HSO4- или H3SO4+ энергетически выше (∆Е=+19.8 ккал/моль, ∆Go= +21.2 ккал/моль).
Таблица 2
|
мас. % H2SO4 |
мол. % Н2О |
[Pd(H2O)4]2+ |
Pd(η2-HSO4)2 |
Pd(η2-HSO4) (HSO4)(H2SO4) |
Pd(HSO4)2 (H2SO4)2 |
|
74,6 |
47,6 |
0,2547 |
0,6231 |
0,0336 |
0,0885 |
|
79,7 |
41,4 |
0,0096 |
0,0590 |
0,0329 |
0,8985 |
|
85,5 |
34,7 |
0,0001 |
0,0016 |
0,0056 |
0,9927 |
|
89,8 |
28,5 |
0 |
0,0005 |
0,0031 |
0,9964 |
|
90,7 |
27,0 |
0 |
0,0004 |
0,0028 |
0,9968 |
|
93,6 |
21,9 |
0 |
0,0002 |
0,0021 |
0,9977 |
|
95,1 |
18,6 |
0 |
0,0002 |
0,0018 |
0,9980 |
|
96,7 |
14,3 |
0 |
0,0001 |
0,0016 |
0,9983 |
|
97,5 |
11,7 |
0 |
0,0001 |
0,0015 |
0,9983 |
|
98,0 |
9,9 |
0 |
0,0001 |
0,0015 |
0,9984 |
|
99,0 |
5,3 |
0 |
0,0001 |
0,0013 |
0,9986 |
Мы также рассматривали возможность присоединения протона реагентами или продуктами. Например протонирование реагента в примере 9а, для Pd(η2-HSO4)(HSO4)(H2SO4) необходима энергия +14,6 ккал/моль для перехода в форму [Pd(η2-HSO4)(H2SO4)2]+. Также для присоединения протона к продукту Pd(HSO4)(СН3)(H2SO4) с образованием [Pd(СН3)(H2SO4)3]+ требуется энергия +18,8 ккал/моль. Эти значения вычислены, предполагая, что одна молекула H2SO4 реагирует с различными формами палладия, чтобы создать протонированный продукт и HSO4-. Таким образом соединения с присоединенными протонами скорее всего не будут найдены в нашей реакционной смеси.
Активация метана. Добавление метана к структурам B, C, и D (рисунок 1) ведут во всех случаях к формированию связей Pd -CH3. Только те реакции, в которых CH3 присоединяется к Pd и протон присоединяется к атому кислорода группы HSO4 - , были термодинамически выгодны. К примеру в реакции 7, окислительное присоединение CH4 к Pd2 и получение октаэдрическим образом скоординированного продукта чрезвычайнонеблагоприятно термодинамически.
Pd(η2-HSO4)(HSO4)(H2SO4) + CH4 → Pd(η2-HSO4)(HSO4)(CH3)(H)(H2SO4)
∆Е=30,4 ккал/моль, ∆Go =44,0 ккал/моль (7)
Pd(η2-HSO4)2 + CH4 → Pd(η2-HSO4)(CH3)(H2SO4)
∆Е=2,9 ккал/моль, ∆Go =13,7 ккал/моль (8)
В отличие от этого, реакция 8, которая включает переход протона от метана к бисульфатному лиганду, является более благоприятной. Структуры реагента, переходных состояний и состояния продуктов представлены на Рисунке 2. Барьер активации для реакции 8 ∆Еа=27,8 ккал/моль и свободная энергия активации ∆Gа=38,1 ккал/моль.
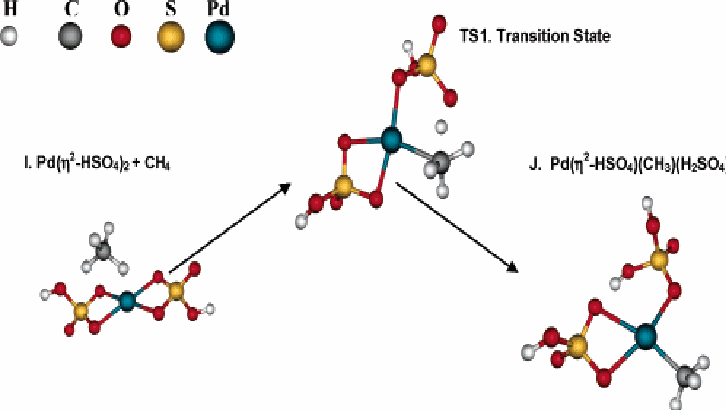
Рисунок 2 Активация метана с помощью Pd(η2-HSO4)2 с образованием связи Pd -CH3
Pd(η2-HSO4)(HSO4)(H2SO4) + CH4 → Pd(HSO4)(CH3)(H2SO4)2 (9)
Как представлено на Рисунках 3 и 4, существует два пути протекания реакции. Они соответствуют примерам 9а и 9b соответственно Рисункам 3 и 4. Переходные и конечные состояния для этих реакций не являются эквивалентными. Как показано на Рисунке 3, первая реакция 9а, включает переход протона от СН4 к атому кислорода лиганда η2-HSO4 таким способом, что в конце реакции протон присоединяется к одному из двух атомов О, который не соединен с Pd. По этому механизму ∆Е=-4,6 ккал/моль и ∆Go =8,6 ккал/моль, а энергия активации и свободная энергия ∆Еа=27,9 ккал/моль и ∆Gа =41,5ккал/моль. На рисунке 4 показано, что во втором случае (путь 9 b), СН4 адсорбируется в форме σ-аддукта заменяя одну из связей Pd – О бидентатного лиганда (∆Е=12,5 ккал/моль и ∆Go =25,3 ккал/моль). Протон присоединяется к одному из кислородрв связанных с Pd.(см. рис. 4; ∆Е=-7,0 ккал/моль и ∆Go =-7,0 ккал/моль). Барьер активации для этого протонного перехода составляет ∆Еа=23,2 ккал/моль и свободная энергия активации - ∆Gа =24,5 ккал/моль. Отмечается, что протонный переход заканчивается различными положениями при прохождении реакции по двум возможным механизмам. Конечный продукт реакции 9b может перегруппироваться в форму с низшей энергией (структура L, Рис. 3), которая является конечным продуктом реакции 9а (∆Е=-10,1 ккал/моль и ∆Go =-9,8ккал/моль).

Рисунок
3 Активация метана
Pd(η2-HSO4)(HSO4)(H2SO4),
механизм 1. СН4
присоединяется
на место одной из бидентатных связей, превращая бидентат HSO4
в лиганд H2SO4
(Реакция 9a: Pd(η2-HSO4)(HSO4)(H2SO4)
+ CH4
→ Pd(HSO4)(CH3)(H2SO4)2;
∆Е=-4.6
ккал/моль,
∆Go
=+8.6ккал/моль)
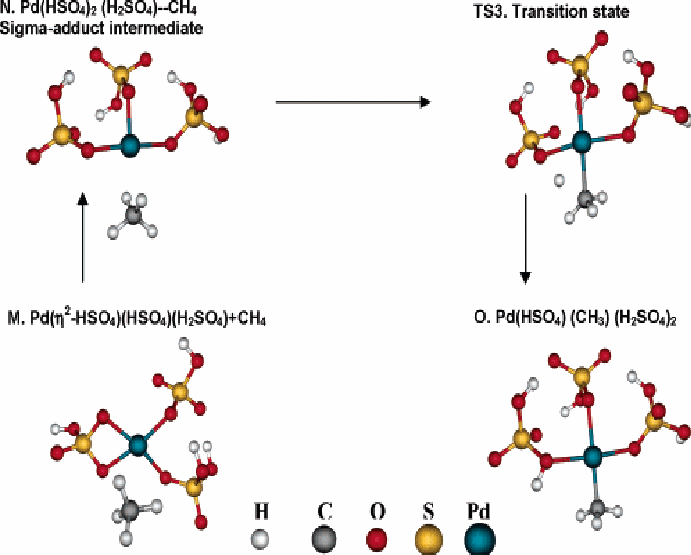
Рисунок 4 Активация метана, которая проходит с образованием промежуточного σ-аддукта. Разновидность в нижнем правом углу (структура О) подвергается дальнейшим преобразованиям до структуры L рисунка 3 (Реакция 9b: Pd(η2-HSO4)(HSO4)(H2SO4) + CH4 → Pd(HSO4)(CH3)(H2SO4)2; ∆Е=5,5 ккал/моль, ∆Go =+18,3ккал/моль)
Присоединение метана к Pd (HSO4)2(H2SO4)2 , структура D на рисунке 1, происходит подобно пути показанному на рисунке 4. Как показано в примере 10, реакция начинается заменой одного из лигандов H2SO4 молекулой СН4 , которая формирует σ-аддукт с катионом Pd , эта структура идентична N на рисунке 4. Последующие шаги пути реакции идентичны показанным на рисунке 4.
Pd(HSO4)2(H2SO4)2 + CH4 → Pd(HSO4)2(H2SO4)(CH4) + H2SO4
∆Е=15,3 ккал/моль, ∆Go =28,8 ккал/моль (10)
Таблица 2 показывает, что в 96%(мас) серной кислоте, катионы Pd2+ присутсвуют прежде всего в виде Pd(HSO4)2(H2SO4)2 и в меньшей степени - Pd(η2-HSO4)(HSO4)(H2SO4). Однако, результаты представленные выше, предполагают, что основной путь активации метана проходит по механизму 9а, который включает Pd(η2-HSO4)(HSO4)(H2SO4). Причиной исключения механизма 10 и аналогичного 9b, является термодинамическая невыгодность формирования σ-аддукт метана или с Pd(HSO4)2(H2SO4)2 или Pd(η2-HSO4)(HSO4)(H2SO4). Кроме того полный барьер активации метана по схеме 10 и 9b составляет 53,3 ккал/моль, тогда как для механизма 9а барьер – 41,5 ккал/моль. Разница в 11,8 ккал/моль компенсируется тем, что свободная энергия Pd(HSO4)2(H2SO4)2 является ниже чем Pd(η2-HSO4)(HSO4)(H2SO4) на 6,2 ккал/моль (см. реакцию3). Далее отмечается, что активация метана проходит по механизму 8, в котором СН4 реагирует с Pd(η2-HSO4)2 ниже чем для механизма 9а на 3,4 ккал/моль. Эта разница компенсирует факт того, что свободная энергия Pd(η2-HSO4)2 ниже чем у Pd(η2-HSO4)(HSO4)(H2SO4) на 2,5 ккал/моль.
Внедрение СО. Периана и др. [1] предположили, что атом углерода связывается с карбоксильной группой уксусной кислоты формируется введением СО в комплексное соединение Pd – СН3 после активации СН4. Совсем недавно, Зерелла и Белл [2] установили, что СО формируются через окисление метилового бисульфата, промежуточного звена во время окисления СН4. И источник СО и его роль в формировании карбоксильной группы уксусной кислоты были подтверждены в экспериментах, используя 13С – маркированного бисульфата метила (произведеный реакцией 13СН3ОН и H2SO4) и 13СО. Эти эксперименты подтвердили, что 13С присутствует только в 13СН3ОН. Следствием из результатов исследований является предположение, что окисление СН3 HSO4 серной кислотой или кислородом до формы СО и связывание продуктов очень благоприятно.
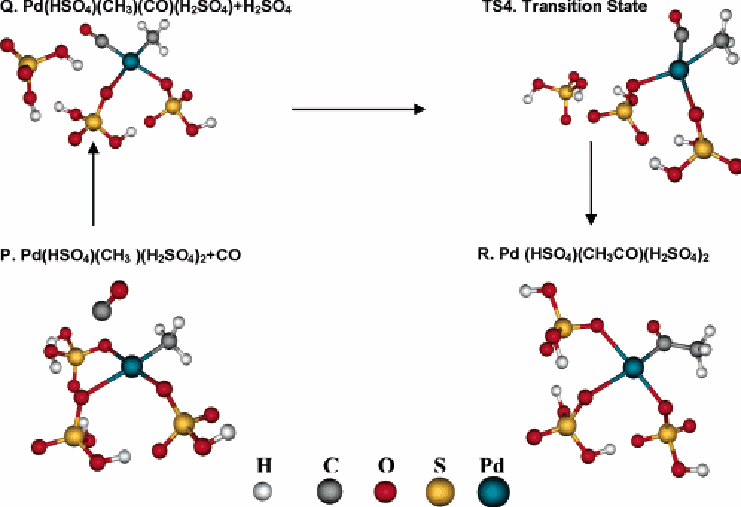
Рисунок 5 Иллюстрация процессов формирования уксусной кислоты
В ходе данного исследования определялся путь по которым СО взаимодействует с комплексным соединениями Pd – СН3. Эти вычисления показывают, что СО может вытеснить молекулу H2SO4 с образованием формы Pd(η2-HSO4)(HSO4)(CO), даже когда СН3 не является лигандом, как в реакциях 11 и 12.
Pd(η2-HSO4)(HSO4)(H2SO4) + СО ↔ Pd(η2-HSO4)(HSO4)(СО) + H2SO4
∆Е=13,1 ккал/моль, ∆Go =2,1 ккал/моль (11)
Pd(HSO4)2(H2SO4)2 + СО ↔ Pd(HSO4)2(H2SO4)(СО) + H2SO4
∆Е=-8,9 ккал/моль, ∆Go =6,0 ккал/моль (12)
Энергия активации и свободная энергия активации составляют ∆Еа=8,2 ккал/моль и ∆Gа =15,0 ккал/моль для механизма 11. В случае разновидности СН3 – содержащей, Pd(HSO4)(СН3)(H2SO4)2, ∆Е=-24,5 ккал/моль, ∆Go =-14,4 ккал/моль и этот путь реакции не содержит активационного барьера.
Pd(HSO4)(CH3)(H2SO4)2 + CO ↔Pd(HSO4)(CH3)(CO)(H2SO4) + H2SO4
∆Е=-24,5 ккал/моль, ∆Go =-14,4 ккал/моль (13)
Адсорбированный СО может внедряться в связь Pd – СН3 с формированием арила (см. Рис. 5).
Pd(HSO4)(CH3)(CO)(H2SO4) + H2SO4 → Pd(HSO4)(CH3CO)(H2SO4)2
∆Е=8 ккал/моль, ∆Go =14 ккал/моль (14)
Энергия активации и свободная энергия активации для реакции 14 составляют ∆Еа=15,1 ккал/моль и ∆Gа =14,7 ккал/моль. Мы также рассмотрели добавление СО сначала к Pd-катализатору, а далее активация метана. Барьер активации СН4 Pd(η2-HSO4)(HSO4)(CO) имеет значение в 27 ккал/моль, подобно механизму 8.
Формирование СН3HSO4 и СН3СООН. Периана и др.[1] и Зрелла и др. [18] предложили, что бисульфат метила и смешанный ангидрид уксусной кислоты СН3СОHSO4 фоормируются с помощью внутримолекулярных процессов (реакций 15 и 16). С количеством воды, присутствующей в 96%(мас.) H2SO4 , смешанный ангидрид гидролизуется с образованием уксусной кислоты и серной кислоты, тогда как бисульфат метила стабилен к гидролизу. Обе группы авторов предположили, что нуль-валентные атомы Pd формируются во время получения продуктов (реакции 15 и 16).
Pd(HSO4)(CH3)(H2SO4)2 → Pd(H2SO4)2 + CH3HSO4
∆Е=35,5 ккал/моль, ∆Go=17,0 ккал/моль (15)
Pd(HSO4)(CH3CO)(H2SO4)2 → Pd(H2SO4)2 + CH3COHSO4
∆Е=35,5 ккал/моль, ∆Go=17,0 ккал/моль (16)
Когда данные вычисления показывают, что термодинамика для этих процессов является неблагоприятной, образование палладиевой черни (по механизму Pd → 1/6 Pd6, ∆Е=-32,6 ккал/моль, ∆Go=-23,4 ккал/моль) делает эти реакции термодинамически возможным. Однако, реакции 15 и 16 вряд ли продолжиться, так как барьер активации для этих реакций очень велик, и нет возможности определить путь, по которому эти реакции могли бы возобновить приемлемый барьер. Например, в случае реакции 15 предполагаемый барьер активации [19] составляет 49 ккал/моль.
Так как 96% (мас) серная кислота содержит ~ 16%(мол.) воды, это приемлемо для прохождения гидролиза Pd-(CH3)- и Pd-(CH3CO)-содержащих соединений, в процессе возможно формирование метанола и уксусной кислоты соответственно. Метанол, полученный в первой реакции, немедленно бы реагировал с H2SO4 с образованием бисульфата метила. Примером такой реакции, для которой гидрид палладия является одним из продуктов, представлен в реакции 17. Очевидно, что изменение свободной энергии Гиббса для этой реакции относительно высоко, поэтому, прохождение этого процесса кажется маловероятным.
Pd(HSO4)(CH3)(H2SO4)2 + H2O →Pd(HSO4)(H)(H2SO4)2 + CH3OH
∆Е=21,3 ккал/моль, ∆Go=23,4 ккал/моль (17)
Гидролиз Pd-CH3CO до уксусной килоты является термодинамически выгодным, но барьер активации составлял бы приблизительно 80 ккал/моль. Следовательно, этот процесс вряд ли будет основным путем образования уксусной кислоты.
Как альтернатива реакциям 15-17, была исследована возможность окисления соединений Pd2+ до соединений Pd4+, и что бисульфат метила и смешанный ангидрид уксусной кислоты и серной кислоты, полученных в результате внутримолекулярных процессов в соединениях Pd4+. Подобные процессы исследовали Ксу и др.[20] и Христов и Зеглер [4], в которых метан катализированный Pt2+ в серной кислоте. Окисление соединений Pd2+ до соединений Pd4+ мало рассмотрено, сообщалось об устойчивых октаэдрических комплексах Pd4+, некоторые из которых содержат лиганды метил и этил.[21-23]
Окисление соединений Pd2+ до Pd4+ предположительно протекает по реакциям с H2SO4 и О2 (примеры 18-20). Отмечено, что у октаэдрических соединений Pd4+ в правой стороне всегда есть бидентатный лиганд η2-HSO4. Замена одного лиганда η2-HSO4 комбинацией лигандов HSO4 и H2SO4 является невыгодным, потому что присутствие двух лигандов вместо одного ведет к уплотнению вокруг атома Pd.
Pd(HSO4)2(H2SO4)2 + H2SO4 + 1/2O2 → Pd(η2-HSO4)(HSO4)3(H2SO4) + H2O
∆Е=25,3 ккал/моль, ∆Go=27,0 ккал/моль (18)
Pd(HSO4)(CH3)(H2SO4)2 + H2SO4 + 1/2O2 → Pd(η2-HSO4)(HSO4)2(CH3)(H2SO4) + H2O
∆Е=-11,8 ккал/моль, ∆Go=-8,6 ккал/моль (19)
Pd(HSO4)(CH3CO)(H2SO4)2+H2SO4+1/2O2 → Pd(η2-HSO4)(HSO4)2(CH3CO)(H2SO4)2+H2O
∆Е=14,3 ккал/моль, ∆Go=14,0 ккал/моль (20)
Очевидно, что термодинамика окисления Pd2+ до Pd4 + не благоприятна для реакции 18. Однако, когда в состав комплекса Pd2+ входит CH3 или CH3-СО, окисления Pd2+ до Pd4 + становится возможным. Это - прямой результат стабилизации Pd4 + алкил- или арил- лигандами. В реакциях 18-20 источник O2 внешний, во время окисления Pd2 + к Pd4 + может также всстанавливаться серная кислота, действующая как окислитель. Изменения свободной энергии для таких процессов получены, добавлением значения ∆G ° для реакции 21 к аналогичному показателю для реакций 18, 19, или 20.
Элементарные реакции, которые приводят к окислению Pd2 + к Pd4 +, могут включать участие двух или больше молекул серной кислоты. Мы не пытались найти переходные состояния для этих реакций, потому что эти вычисления требуют очень больших расходов вычислительных ресурсов. Способность H2SO4 или H2SO4/O2 к окислению металлического Pd до Pd2 + была продемонстрирована в нашей лаборатории [2] и является приемлемой, а значит, окисление Pd2 + к Pd4 + в серной кислоте происходит по подобному механизму, предложенному для окисления Pt2+ до Pt4+ в тех же условиях.[4,6] Термодинамические расчеты представленные для реакций 19 и 20 показывают, что окисление Pd(HSO4)(CH3)(H2SO4)2 и Pd(HSO4)(CH3CO)(H2SO4)2 является термодинамически выгодным.
H2SO4 → H2O + SO2 + 1/2O2
∆Е=19,5 ккал/моль, ∆Go=4,7 ккал/моль (21)
Получение продуктов из комплексов Pd4 + является термодинамически выполнимым и не содержит высоких барьеров активации. Уравнение 22 иллюстрирует формирование CH3HSO4.
Pd(η2-HSO4)(HSO4)2(CH3)(H2SO4) → Pd(η2-HSO4)(HSO4)(H2SO4) + CH3HSO4
∆Е=-38,1 ккал/моль, ∆Go=-53,7 ккал/моль (22)
Энергия активации и свободная энергия активации для примера 22 составляют ∆Еа=26,9 ккал/моль и ∆Gа =27,5 ккал/моль. Подобная реакция формирования СН3СОНSО4 представлена в примере 23.
Pd(η2-HSO4)(HSO4)2(CH3CO)(H2SO4) → Pd(η2-HSO4)(HSO4)(H2SO4) + CH3COHSO4
∆Е=-19,2 ккал/моль, ∆Go=-35,6 ккал/моль (23)
Энергия активации и свободная энергия активации для примера 23 составляют ∆Еа=3,3 ккал/моль и ∆Gа =3,3 ккал/моль
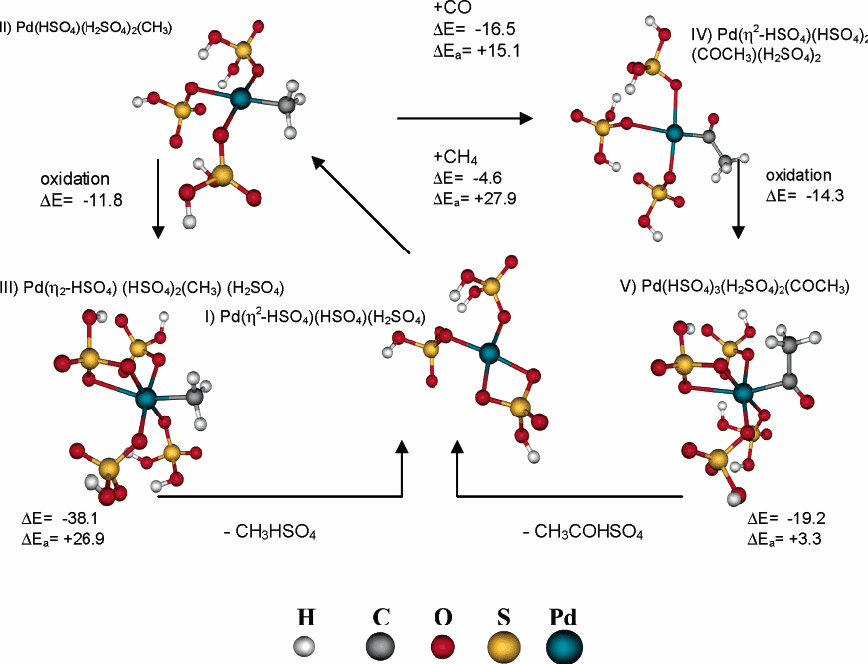
Рисунок 6 Полный путь реакции для формирования CH3HSO4 и CH3COHSO4
Полный каталитический цикл показан на рисунке 6 и изменение свободной энергии вдоль представленного пути дано на рисунке 7. Каталитический цикл, показанный на рисунке 6, приближенно напоминает предложенный Зереллом и Беллом на основе экспериментальных данных[2]. Эти авторы продемонстрировали, что источник СО, требуемый для формирования карбоксильной группы в уксусной кислоте – окисление CH3HSO4, основного побочного продукта окисления СН4. Профиль свободной энергии представлен на рисунке 7, предполагается, что лимитирующей стадией окисления метана до уксусной кислоты является начальная активация метана.
Механизм реакции, показанный на рисунке 6, не включает переход Pd2+ в Pd0. Однако, как указывалось ранее, переход Pd наблюдался во время экспериментальных исследований[1,2,15]. Вычисления показали, что предположительно, сокращение количества Pd не будет проходить как стадия последовательности окисления метана до метанола. Поэтому, некоторые другие соединения в системе отвечают за сокращение количества Pd2+. Экспериментальная работа, о которой сообщали Зерелла и Белл, показывает что СО, полученный в течение полной реакции может уменьшать количество Pd2+, переводя в палладиевую чернь[2,15]. Термодинамические вычисления для реакций 25 и 24 показывают, что процесс является возможным, если эти атомы могут формировать малые кластеры Pd, тогда изменение свободной энергии Гиббса для произведения элементарного Pd является более благоприятным. Как отмечалось ранее для реакции Pd→1/6Pd6 ∆Е=-32,6ккал/моль, ∆Go= 23,4ккал/моль.
Pd(η2-HSO4)(HSO4)(H2SO4) + CO + H2O → Pd(H2SO4)2 + CO2 + H2SO4
∆Е=-3,6 ккал/моль, ∆Go=-11,5 ккал/моль (24)
Pd(HSO4)2(H2SO4)2 + CO + H2O → Pd(H2SO4)2 + CO2 + 2H2SO4
∆Е=-2,9 ккал/моль, ∆Go=-31,2 ккал/моль (25)
Эти расчеты формирования комплекса Pd были сделаны с базисным комплексом LANL2DZ, предполагая, что реакция происходит в газовой фразе. Отмечается, что СО, используемый в вышеупомянутых реакциях, формируется окислением CH3HSO4, полученного во время реакции. Термодинамика для такого окисления благоприятна, как показано в реакции 26 ниже.
CH3HSO4 + H2SO4 → CO + H2O + 2H2SO3
∆Е=-39,0 ккал/моль, ∆Go=-70,5 ккал/моль (26)
Повторное окисление Pd0 может проходить в одном из нескольких процессов. Два примера представлены в реакциях 27 и 28. Первый механизм включает H2SO4, как окислитель, а во втором в качестве окислителя применяется O2.
Pd(H2SO4)2 + H2SO4 → Pd(η2-HSO4)2 + SO2 + 2H2O
∆Е=-48,2 ккал/моль, ∆Go=-76,3 ккал/моль (27)
Pd(H2SO4)2 + 1/2O2 → Pd(η2-HSO4)2 + H2O
∆Е=-67,7 ккал/моль, ∆Go=-71,6 ккал/моль (28)
Очевидно, что Pd0 может быть повторно окислен и H2SO4 и O2, и что значения ∆Go отличаются незначительно для реакций 27 и 28. Это заключение подтверждается экспериментальной работой Зерелла и др. [2].
Предыдущее обсуждение иллюстрирует важность утверждения необходимости поддержания баланса концентрации СО в реакционных системах для достижения высокого выхода уксусной кислоты и содержание катионов Pd2+ в растворе. Введение СО в связь Pd-CH3 в Pd(HSO4)(CH3)(CO)(H2SO4), реакция 12, достигается повышением парциального давления СО, однако высокое парциальное давление СО ведет к сокращению содержания Pd(η2-HSO4)(HSO4)(H2SO4) и Pd(HSO4)2(H2SO4)2 переводом до Pd0 по реакциям 24 и 25. Эти наблюдения согласовываются с экспериментальными данными Зерелла и др. [2], обнаружившими, что выход уксусной кислоты проходит через максимум с повышением парциального давления СО.
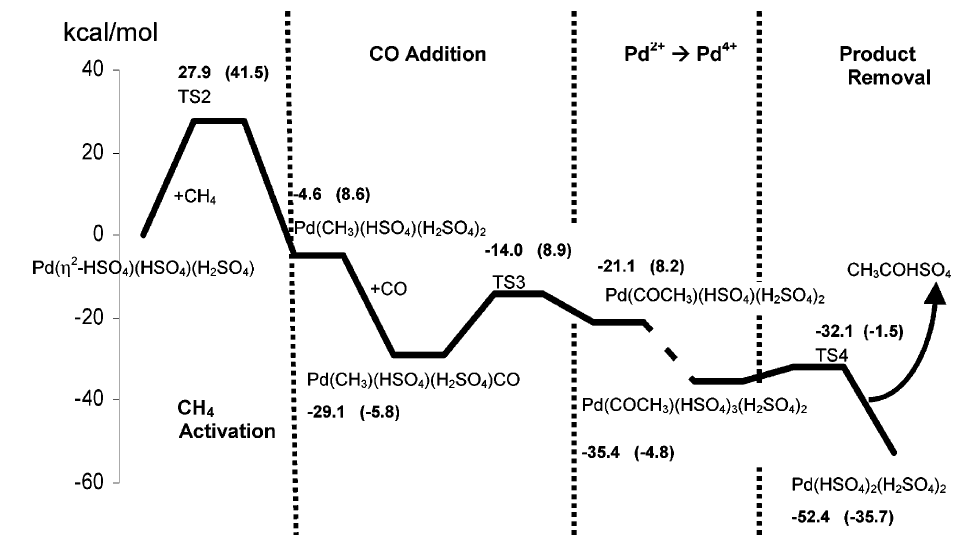
Рисунок 7 Схематическое изображение изменения электронной энергии во время представленного механизма окисления метана до уксусной кислоты. Граф измерен на основании электронной энергии (ккал/моль) как показано на оси Y. Стандартные свободные энергии при 453 K соответствующих структур даны в круглых скобках. TS2 - переходное состояние для активации метана. TS3 - переходное состояние для введения СО в связь Pd -CH3. TS4 – переходное состояние для CH3COHSO4 смещения центра от Pd4 +. Разрыв линии указывают на части энергетического профиля, где барьер активации не был вычислен.
Заключение. Результаты этого исследования показывают, что катионы Pd2+,стабилизированы в концентрированной серной кислоте, находятся, прежде всего, в формах Pd(η2-HSO4)(HSO4)(H2SO4) и Pd(HSO4)2(H2SO4)2. Активация метана происходит прежде всего с помощью введения СН4 в одну из Pd-О связей бисульфатного лиганда. Внедрение СО в связь Pd-CH3 этих соединений приводит к формированию соединений содержащих Pd-СОCH3. Прямое формирование CH3HSO4 или CH3COHSO4 с помощью восстановительного элиминирования Pd(HSO4)(CH3)(H2SO4)2 или Pd(HSO4)(CH3CO)(H2SO4)2 предположительно имеет высокий барьер активации. Намного более вероятный маршрут получения продуктов включает окисление Pd(HSO4)(CH3)(H2SO4)2 и Pd(HSO4)(CH3CO)(H2SO4)2 до форм Pd(η2-HSO4)(HSO4)2(CH3)(H2SO4) и Pd(η2-HSO4)(HSO4)2(CH3CO)(H2SO4) соответственно, которые свободно могут отщепить CH3HSO4 или CH3COHSO4. Уксусная кислота формируется в результате гидролиза CH3COHSO4, процесс термодинамически возможен в 96%(мас.) серной кислоте.
Потеря Pd2+ из растворав форме Pd0 или палладиевой черни происходит с сокращением СО. Этот процесс компенсируется повторным окислением Pd H2SO4 или О2. Таким образом, необходимо поддерживать баланс восстановленных и окисленных форм.
Благодарность Эта работа была поддержана the Methane Conversion Cooperative, основанный BP.
Дополнительная информация Вычислительные детали о точности энергетических вычислений; молекулярные конфигурации и минимальные энергетические пути; энергетический рабочий лист вычисления авторов для реферата. Этот материал доступен бесплатно через интернет http://pubs.acs.org.
(1) Periana, R. A.; Mironov, O.; Taube, D.; Bhalla, G.; Jones, C. J. Science 2003, 301, 814.
(2) Zerella, M.; Kahros, A.; Bell A. T. J. Catal. 2005, in press.
(3) Gilbert, T. M.; Hristov, I.; Ziegler, T. Organometallics 2001, 20, 1183.
(4) Hristov, I. H.; Ziegler, T. Organometallics 2003, 22, 1668.
(5) Kua, J.; Xu, X.; Periana, R. A.; Goddard, W. A. Organometallics 2002, 21, 511.
(6) Xu, X.; Kua, J.; Periana, R. A.; Goddard, W. A. Organometallics 2003, 22, 2057.
(7) Jones, C. J.; Taube, D.; Ziatdinov, V. R.; Periana, R. A.; Nielsen, R. J.; Oxgaard, J.; Goddard, W. A. Angew. Chem., Int. Ed. 2004, 43, 4626.
(8) Frisch, M. J.; et al. Gaussian 03, revision C.02; Gaussian, Inc.: Wallingford,
CT, 2004.
(9) Schaftenaar, G.; Noordik, J. H. J. Comput.-Aided Mol. Design 2000, 14, 123.
(10) Jaguar, 5.5 ed.; Schrodinger, LLC: Portland, OR, 2003.
(11) Peters, B.; Heyden, A.; Bell, A. T.; Chakraborty, A. J. Chem. Phys. 2004, 120, 7877.
(12) Treutler, O.; Ahlrichs, R. J. Chem. Phys. 1995, 102, 346.
(13) Kazansky, V. B. Catal, Today 2002, 73, 127.
(14) Kazansky, V.; Solkan, V. Phys. Chem. Chem. Phys. 2003, 5, 31.
(15) Robertson, E. B.; Dunford, H. B. J. Am. Chem. Soc. 1964, 86, 5080.
(16) Shi, T. S.; Elding, L. I. Acta Chem. Scand. 1998, 52, 897.
(17) Rudakov, E. S.; Yaroshenko, A. P.; Rudakova, R. I.; Zamashchikov, V. V. Ukr. Khim. Zh. 1984, 50, 680.
(18) Zerella, M.; Mukhopadhyay, S.; Bell, A. T. Chem. Commun. 2004, 1948.
(20) Xu, X.; Fu, G.; Goddard, W. A.; Periana, R. A. Selective oxidation of CH4 to CH3OH using the Catalytica (bpym)PtCl2 catalyst: a theoretical study. In Natural Gas ConVersion VII, Proceedings of the 7th Natural Gas Conversion Symposium, June 6-10, 2004, Dalian, China; Bao, X., Xu, Y., Eds.; Elsevier: Amsterdam, 2004; Vol. 147, p 499.
(21) Campora, J.; Palma, P.; del Rio, D.; Carmona, E.; Graiff, C.; Tiripicchio, A. Organometallics 2003, 22, 3345.
(22) Canty, A. J.; Denney, M. C.; Patel, J.; Sun, H. L.; Skelton, B. W.; White, A. H. J. Organomet. Chem. 2004, 689, 672.
(23) Yamamoto, Y.; Kuwabara, S.; Matsuo, S.; Ohno, T.; Nishiyama, H.; Itoh, K. Organometallics 2004, 23, 3898.