Библиотека
Утилизация сточных вод мышьяково-содовой сероочистки
И.Г.Крутько
Мариупольский коксохимический завод
Источник: Ежемесячный научно-технический и производственный журнал «Кокс и Химия» – M.: Металлургия – 1989. – № 4. – с. 52–53.
При обезвреживании сточных вод мышьяково-содовой сероочистки с получением тиоцианата меди (I) образуется маточный раствор:
Сульфат натрия, г/дм3 130–160
Политионаты натрия в пересчете на тетратионат, г/дм3 90–110
Комплексные соединения меди, г/дм3 0,8—1,2
Серная кислота, г/дм3 1,0–1,8
Плотность при 20 оC, кг/м3 1150–1170
Раствор, образующийся после выделения тиоцианата меди (I), представляет собой концентрированный раствор минеральных солей – сульфата и тетратионата натрия. Для обессоливания его пе¬рерабатывают с получением товарных продуктов.
Отработанный раствор после I ступени нейтрализации, используемый для получения тиоцианата меди (I), характеризуется непостоянством мольного соотношения роданида и тиосульфата натрия, тогда как синтез тиоцианата меди (I) требует строго определенного соотношения указанных солей. Политионаты подвергаются щелочному разложению до тиосульфата, и он может быть возвращен в цикл получения тиоцианата меди (1) для поддержания оптимального состава перерабатываемого раствора. В качестве щелочного агента исследовали углекислый натрий, при взаимодействии которого с маточным раствором прежде всего нейтрализуется серная кислота.
Политионаты в растворе представлены в основном двумя соединениями – тетратионатом и тритионатом натрия. Интенсифицировать разложение политионатов содой можно нагреванием, химизм щелочного разложения тетратионата и три- тионата натрия можно представить следующей схемой:
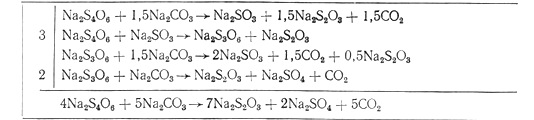
Присутствующие в растворе тиоцианатокуприты-2 взаимодействуют с гидроксидом натрия, образующимся в результате гидролиза углекислого натрия. При введении в раствор карбоната натрия произведение концентраций ионов меди и гидроксид-ионов превышает произведение растворимости гидроксида меди, раствор оказывается пересыщенным и начинается образование осадка Сu(ОН)2. При нагревании гидроксид меди отщепляет одну молекулу воды, переходя в черный оксид меди:
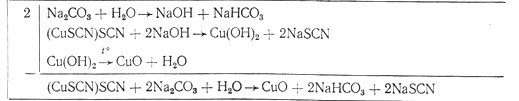
Практические результаты подтверждают при¬веденную выше схему химизма щелочного воздействия углекислого натрия (отн. ед.) на маточный раствор (см. таблицу). Продукты распада политионатов – тиосульфат и сульфат натрия. Образование сульфита натрия подтверждается его присутствием при неполном разложении политионатов, т. е. на промежуточных стадиях процесса. При завершении разложения политионатов сульфит-ион в растворе практически отсутствует.
В результате экспериментальных исследований наметилась следующая принципиальная схема переработки маточного раствора:
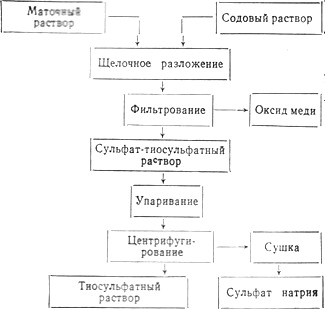
Способ переработки маточного раствора проверили на опытной установке, построенной на Мариупольском коксохимическом заводе. Получили опытную партию сульфата натрия (белые кристаллы), %: сульфат натрия 95–97, тиосульфат натрия 2–3, гидрокарбонат натрия 0,8–1,1, влага 0,3–0,5, роданистый натрий отсутствует.
| Процесс | Исходный реагент | Продукт реакции | ||||||
| Na2S4O6 | Na2CO3 | (CuSCN)SCN | Na2S2O3 | Na2SO4 | CuO | CO2 | NaHCO3 | |
| Разложение тетратионата | 1 | 1,25 | - | 1,72 | 0,6 | - | 1,19 | - |
| Теоритическое | 1 | 1,25 | - | 1,75 | 0,5 | - | 1,25 | - |
| Разложение комплексных соединений | - | 2,0 | 1,0 | - | - | 0,98 | - | 2,2 |
| Теоритическое | - | 2,0 | 1,0 | - | - | 1,00 | - | 2,0 |
Качество сульфата натрия, полученного переработкой маточного раствора, позволит широко использовать товарную соль в целлюлозно-бумажной и стекольной промышленности. Тиосульфатный раствор передается в сборник осветленного раствора после 1 ступени нейтрализации мышьяково-содовой сероочистки для стабилизации состава раствора.
Выводы
- Исследован химизм щелочного разложения политионатов и тиоцианатокупритов-2 при воз¬действии на маточный раствор углекислого натрия.
- Разработана технологическая схема переработки маточного раствора с получением товарной соли (сульфата натрия) и концентрированного тиосульфатного раствора.
- Получена опытная партия сульфата натрия, который может быть использован в целлюлозно- бумажной и стекольной промышленности