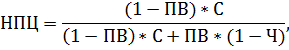КЛЮЧЕВЫЕ СЛОВА: хроническая ишемическая болезнь сердца, промежуточная предтестовая вероятность, магнитокардиография, прогностическая ценность, комплексный индекс
Ишемическая болезнь сердца (ИБС) в последние десятилетия приняла характер пандемии. В развитых странах она является причиной смерти примерно в 20 % случаев. По данным ВОЗ, смертность от ИБС к 2030 г. достигнет 23,4 млн человек [12]. Поэтому ранняя диагностика этого заболевания – одна из важнейших задач современной кардиологии [2].
Золотым стандартом диагностики ИБС остается коронароангиография (КГ), однако ее стоимость относительно высока, при ее проведении возможны различные осложнения, в том числе смерть (0,1–0,2 %), нефатальный инфаркт миокарда (0,1 %), серьезные цереброваскулярные осложнения (0,1 %), кровотечения (8,8 %) [28]. При этом хорошо известно, что 19–57 % больных с ИБС (в зависимости от популяционных особенностей обследованных групп [26]) могут не иметь значимых ангиографических изменений коронарных артерий. КГ может быть методом первой линии лишь у больных с высокой предтестовой вероятностью значимого коронарного стеноза, с тяжелыми клиническими проявлениями болезни. Больные с промежуточной предтестовой вероятностью выраженного коронарного стеноза нуждаются в рентабельной и безопасной предварительной стратификации риска на основе неинвазивных технологий [20]. Наиболее распространенные, рутинные и дешевые методы, такие как электрокардиография и эхокардиография покоя, не обладают достаточной чувствительностью. Так, ЭКГ покоя остается малоизмененной приблизительно у 50 % больных с хронической ИБС, даже во время эпизодов дискомфорта в грудной клетке [18]. В качестве методов, способных выполнять функции так называемого «привратника» [25] для КГ, в настоящее время используют тесты с дозированной физической нагрузкой под контролем ЭКГ, стресс-эхокардиографию (СЭ), радиоизотопное исследование перфузии миокарда, а также оценку перфузии миокарда методом магнитно-резонансной томографии. Каждый из перечисленных методов имеет свои преимущества и недостатки.
Пробы на велоэргометре или тредмиле под контролем ЭКГ наиболее распространены благодаря доступности и небольшой стоимости исследования [9], однако их информативность относительно невысока: чувствительность составляет 45–68 %, специфичность – 50–90 % [3].
СЭ предоставляет ценную дополнительную (по сравнению с велоэргометрией) информацию о наличии, выраженности и локализации ишемии,
но ее стоимость выше. Чувствительность, специфичность и диагностическая точность СЭ колеблется в диапазоне 80–85 %, при этом наибольшая
чувствительность (> 90 %) – у больных с поражением трех сосудов, а наименьшая (около 75 %) – с поражением одного сосуда [3, 19]. Недостатки СЭ: значительное число пациентов (8–10 %) с плохим ультразвуковым окном, а также субъективность оценки нарушений сократимости.
Стоимость сцинтиграфии миокарда, однофотонной эмиссионной компьютерной томографии, магнитнорезонансной томографии миокарда и, особенно, позитронной эмиссионной томографии гораздо выше, чем велоэргометрии [21]. Диагностическая точность радиоизотопного исследования, по одним данным, сравнима с точностью СЭ, по другим – это исследование обладает несколько более высокой чувствительностью [30]. Существенным недостатком метода является использование источников ионизирующей радиации.
Таким образом, необходим недорогой, доступный и полностью безопасный метод с достаточно высокой диагностической точностью. Перспективной с этой точки зрения представляется магнитокардиография (МКГ) – метод неинвазивного исследования магнитного поля, порожденного электрической активностью миокарда.
История данного метода начинается с 1962 г., когда Бейли и МакФи в г. Сиракузы (США) впервые зарегистрировали МКГ человека с
помощью индукционной катушки [11]. На сегодняшний день функционируют около 40 МКГ-лабораторий в таких
странах, как США, ФРГ, Китай, Южная Корея, Италия, Финляндия, Великобритания, Россия, Япония, Тайвань и др. Исследования киевской
магнитокардиографической группы, проводимые с середины 1990-х годов совместно Институтом кибернетики им. В.М. Глушкова НАНУ и ННЦ
«Институт кардиологии им. Н.Д. Стражеско» НАМНУ [4] и позднее в других клиниках [16, 23], были направлены на разработку целостной МКГ-технологии, особенно необходимой для диагностики ишемии миокарда у больных с неинформативными рутинными тестами. В последние годы интенсивно усовершенствовались методы анализа магнитокардиографических данных во всех аспектах, в частности измерительная система.
Цель работы – исследовать информативность нового комплексного магнитокардиографического индекса для диагностики обструктивного поражения коронарных артерий.
Материал и методы
В основную группу (группа 1) вошли 79 пациентов в возрасте в среднем (56 ± 11) лет: 33 пациента клиники кардиологии Главного военно-медицинского клинического центра МО Украины (Киев) и 46 пациентов II кардиологической клиники Католического госпиталя Philippusstift (Эссен, Германия). Больные были госпитализированы с диагнозом ИБС, им выполнили комплекс стандартных исследований, а также КГ и МКГ. В зависимости от результатов КГ больные были разделены на две подгруппы: 1а – 54 пациента, у которых при КГ был выявлен стеноз 70 % как минимум в одной из главных коронарных артерий; 1б – 25 больных без гемодинамически значимого коронарного стеноза. В обследование не включали больных с инфарктом миокарда в анамнезе, несинусовым ритмом сердца, сердечной недостаточностью выше II стадии по NYHA, а также выраженными изменениями ЭКГ в покое (аномальными зубцами Q, депрессией/элевацией сегмента ST, отрицательными зубцами Т более чем в двух отведениях, полной блокадой ножек пучка Гиса).
Предтестовую вероятность наличия ИБС у пациентов определяли с помощью простого клинического индекса. Для этого был выбран индекс клиники Майо, модифицированный в 2002 г. [24], рассчитываемый следующим образом:
Индекс Майо = пол (мужской = 1; женский = 0) + инфаркт миокарда в анамнезе (нет = 0; да = 1) + боль в грудной клетке (атипичная = 0; типичная = 1) + сахарный диабет (нет = 0; инсулиннезависимый = 1; инсулинзависимый = 2) + возраст (40–49 лет = 1; 50–59 лет = 2; 60–69 лет = 3; 70–79 лет = 4; 80–89 лет = 5).
Результаты ранжировали в диапазоне от 0 до 10.
Группа сравнения (группа 2) состояла из 30 здоровых добровольцев в возрасте в среднем (47 ± 9) лет, которые проходили диспансерное обследование (в том числе 7 из них имели отрицательные результаты СЭ с добутамином) и постоянный медицинский контроль как члены отдела пожарной охраны муниципалитета г. Эссен либо как члены украинской антарктической экспедиции, футбольные арбитры и сотрудники спортивных федераций.
КГ и катетеризацию левых отделов сердца выполняли в соответствии с обычной клинической практикой по методике M. Judkins.
МКГ проводили за 24–48 ч до КГ с помощью 7-канальных стационарных МКГ-систем в неэкранированных помещениях в положении обследуемого лежа на спине на подвижной платформе. Датчики магнитного поля были расположены в 9 позициях (по 4 канала в каждой позиции) в рамках прямоугольной измерительной решетки 6x6 с шагом 4 см над прекардиальной областью. Референтной точкой была яремная вырезка. Общая продолжительность регистрации МКГ составляла около 10 мин. Одновременно регистрировали ЭКГ во втором отведении.
В результате предварительной обработки сигнала получали 36 усредненных МКГ-кривых. Затем с помощью маркеров выделяли опорные точки: начало и конец комплекса QRS и интервала ST-T. Во всех зарегистрированных МКГ-кривых соотношение сигнал – шум было достаточным для дальнейшего анализа, опорные точки PQRST хорошо дифференцировались. Технология магнитного картирования подробно описана в работе [6].
Для анализа данных реконструировали распределенные источники тока, порождающие измеренное магнитное поле. Анализировали карты распределения плотности тока (РПТ), отображающие распределение потока электрических зарядов внутри сердца во фронтальной плоскости, при этом длина стрелок пропорциональна плотности потока этих зарядов (рис. 1).
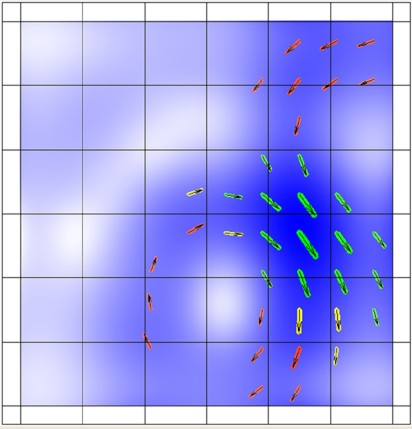
Рис. 1. Нормальная карта распределения плотности тока на интервале ST-T.
Кроме того, использовали цветную кодировку направления векторов. Анализировали набор карт РПТ, реконструированных с шагом 5 мс на протяжении комплекса QRS и с шагом 10 мс на протяжении интервала ST-T. Принципы анализа отдельной карты РПТ и набора карт на протяжении деполяризации и реполяризации желудочков, некоторые электрофизиологические модели, лежащие в основе такого анализа, подробно описаны в работе [7]. Приведем лишь некоторые основные положения.
Анализ карт РПТ состоит из оценки пространственной структуры карт и значений суммарного (полного) тока и включает два этапа:
- анализ отдельной мгновенной карты;
- анализ процесса де- или реполяризации в целом, то есть анализ набора карт, или динамическое картирование.
Анализ отдельной карты основан на понятии «должного» направления. Для каждого вектора плотности тока известно нормальное направление, то есть сектор в рамках применяемой в электрокардиографии круговой диаграммы – от 0 до 180° и от 180 до 0°, при попадании в который направление данного вектора считается нормальным, или «должным». При этом «должное» направление имеет четкую привязку к интервалу кардиоцикла, которому принадлежит данная карта. Так, на протяжении реполяризации желудочков (от точки J до окончания зубца Т) «должным» является направление в сектор от 10 до 80°.
Известно, что во время деполяризации желудочков возбуждение последовательно охватывает межжелудочковую перегородку, передне-верхушечную область, боковую стенку, задне-нижнюю область левого желудочка. Для каждой из этих фаз деполяризации имеется собственное «должное» направление векторов плотности тока.
Количественным выражением такого вида анализа является показатель анормальности (Abnormality Index – AI) – отношение суммы длин векторов, направленных в «должном» для каждого момента времени направлении, к сумме длин векторов, имеющих отличное от «должного» направление. С электрофизиологической точки зрения AI отражает соотношение величин потока ионов, текущих в «должном» направлении, и в направлении, отличном от «должного». Показатель нормируется на 100 %. Также определяли суммарный (полный) ток – сумму длин всех векторов карты РПТ.
Следующий этап – анализ процессов де- и реполяризации желудочков в целом. Рассчитывали средние значения AI на протяжении комплекса QRS и интервала ST-T – соответственно AIQRStotal и AIST-Ttotal.
Оценивали однородность процесса реполяризации – подобие пространственной структуры карт и гладкость изменения суммарной величины тока на протяжении исследуемого интервала. Для количественной оценки однородности пространственной структуры карт рассчитывали коэффициент корреляции (подобия) – Сcor между всеми картами на протяжении интервала ST-T. Для определения гладкости кривой изменений суммарной величины тока анализировали форму этой кривой [7]. Вычисляли продолжительность (в процентах к общей длительности интервала ST-T) участка этой кривой от ее начала до точки перегиба, то есть до момента начала ее монотонного возрастания (Adur). Анализировали также отношение величин полного тока на вершинах зубцов R и T – (R/Tcurrent). Кроме того, использовали показатель, основанный на визуальном анализе структуры суммарной карты РПТ на протяжении интервала ST-T. На основании созданного ранее атласа карт РПТ, существенно дополненного и переработанного в последние годы, карту оценивали как типичную или не типичную для ишемии миокарда [13].
Таким образом, использовали 6 показателей: AIQRStotal, AIST-Ttotal, Adur, Сcor, R/Tcurrent и степень типичности карт для ишемии миокарда – MAPtyp, на основании которых предложен комплексный МКГ-индекс – CI. Его рассчитывали следующим образом. Все количественные показатели были разделены на 4 диапазона значений, соответствующих норме, незначительным изменениям, умеренным изменениям, выраженным изменениям. При этом первому диапазону значений приписывали 1 балл, второму – 2 балла, 3-му и 4-му – соответственно 3 и 4 балла (табл. 1). Показатель MAPtyp был градуирован: карты, нетипичные для ИБС, – 1 балл, неопределенные – 2 балла, типичные для ИБС – 3 балла. То есть, CI варьировал от 6 до 23 баллов и рассчитывался по формуле:
CI = AIQRStotal + AIST-Ttotal + Adur + Сcor + R/Tcurrent + MAPtyp.
Таблица 1. Диапазоны значений количественных показателей, соответствующие разному количеству баллов.
| Показатель |
1 балл |
2 балла |
3 балла |
4 балла |
| AIQRStotal, % |
< 5 |
6-15 |
16-25 |
> 25 |
| AIST-Ttotal, % |
< 5 |
6-15 |
16-25 |
> 25 |
| Adur, % |
< 25 |
26-35 |
36-50 |
> 50 |
| Сcor, % |
> 80 |
70-79 |
60-69 |
< 60 |
| R/Tcurrent, % |
4-6 |
6,01-7 или 3,99-3 |
7,01-8 или 2,9-2 |
> 8 или < 2 |
Таким образом, CI представляет собой интегральный балльный критерий аддитивного типа.
Кроме того, сопоставили локализацию выявленных стенозов коронарных артерий по данным КГ и изменений по данным МКГ.
Для определения локализации электрофизиологических нарушений строили суммарную карту РПТ путем суммирования всех мгновенных карт на интервале ST-T. Затем ее делили на 9 квадрантов, причем каждый квадрант соответствовал бассейну одной из трех главных коронарных артерий [15]. Для каждого исследуемого отмечено наличие групп векторов, имеющих направление, отличное от должного, в тех или иных квадрантах.
Предварительную обработку и анализ данных МКГ проводили с помощью оригинального пакета программ два опытных исследователя, которые не были проинформированы о результатах КГ.
Достоверность различий значений количественных показателей в обследованных группах оценивали с помощью критерия Стьюдента. Значения Р<0,05 считали статистически достоверными. Достоверность различий показателя MAPtyp и комплексного МКГ-индекса CI оценивали с помощью теста Манна – Уитни.
Граничные значения диапазонов величин количественных показателей выбирали на основании компромисса между стратегиями равной ширины диапазонов и равной заселенности диапазонов (то есть когда в один интервал попадает примерно одинаковое количество измерений). Чувствительность и специфичность рассчитывали на основании значений комплексного МКГ-индекса. Пороговое значение (значение с наибольшей дифференцирующей силой) CI0 определяли с помощью ROC-кривой. Использовали бинарное решающее правило:
Значимая обструкция коронарных сосудов присутствует, если CI >= CI0,
Значимая обструкция коронарных сосудов отсутствует, если CI < CI0.
Чувствительность определяли как долю пациентов со значимой обструкцией коронарных сосудов, классифицированных с помощью теста в группу больных с обструкцией коронарных сосудов, а специфичность – как долю обследованных без значимой коронарной обструкции, отнесенных тестом к группе без стеноза.
Прогностическую ценность положительного и отрицательного результата МКГ-теста рассчитывали на основании таких показателей, как позитивная (ППЦ) и негативная (НПЦ) предсказующая ценность. Поскольку они зависят от предтестовой вероятности наличия заболевания, то в случаях, когда предтестовая вероятность известна, рекомендовано использовать формулы расчета ППЦ и НПЦ с учетом предтестовой вероятности [21]:

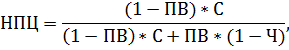
где ПВ – предтестовая вероятность, Ч – чувствительность, С – специфичность.
ППЦ/НПЦ интерпретировали как посттестовую вероятность того, что у пациента имеется гемодинамически значимый коронарный стеноз, если значение CI оказывается выше (ниже) порога.
Пороговое (бинарное) решающее правило имеет существенный недостаток: вероятность ошибочного диагноза для каждого конкретного испытуемого зависит от близости диагностического параметра к пороговому значению.
Вблизи порога вероятность ошибки резко возрастает [8].
Поэтому для индивидуализации диагностического решения желательно использовать более сложные правила, как минимум трехзначные –
разделение данных не на два, а на три класса, включая промежуточный класс. Методология определения границ промежуточного класса базируется
на вычислении вероятности отнесения к крайним (позитивному и негативному) классам. Мы применяли вероятностный подход [1, 29], согласно которому верхняя и нижняя границы промежуточной зоны равны пороговым значениям СI при последовательном попарном сравнении групп 1 и 2, а затем групп 2 и 3. Пороговое значение определяли как точку пересечения функций вероятности соответствующих групп.
Кроме того, ППЦ и НПЦ рассчитывали и по общепринятым формулам без учета предтестовой вероятности.
Результаты и их обсуждение
Предтестовая вероятность ИБС в подгруппе 1а составила 4,9 ± 1,1 (из 10 баллов), в подгруппе 1б – 4,6 ± 1,2. Таким образом, отобранные пациенты имели промежуточную предтестовую вероятность наличия коронарного стеноза.
Результаты МКГ-исследования представлены в табл. 2.
Таблица 2. Значения МКГ-показателей в обследованных группах.
| Показатель |
Величина показателя(M±m) у пациентов |
| подгруппы 1а(n=54) |
подгруппы 1б(n=25) |
группы 2(n=30) |
| AIQRStotal |
7,4±5,8* |
7,8±7,8 |
4,2±5,1 |
| AIST-Ttotal |
13,9±11,7*° |
8,0±12,2 |
3,3±4,6 |
| Adur |
35,1±12,1*° |
25,6±21,8 |
14,8±10,8 |
| Сcor |
70,1±6,9*° |
77,1±7,3 |
78,5±6,6 |
| R/Tcurrent |
4,70±2,65* |
4,2±2,2 |
3,2±1,1 |
| MAPtotal |
2,6±0,6*° |
1,4±0,6 |
1,20±0,43 |
| CI |
13,90±2,00*° |
9,9±2,1 |
8,50±1,45 |
Примечание. Различия показателей достоверны по сравнению с таковыми у пациентов: * – группы 2 (Р<0,05); ° – подгруппы 1б (Р<0,05).
Ценность показателя CI анализировали при попарном сравнении подгруппы 1а с подгруппой 1б и группой 2 с помощью ROC-анализа (рис. 2, 3).
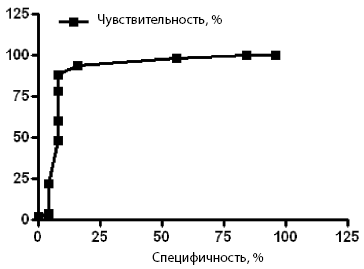
Рис. 2. ROC-кривая для подгрупп 1а и 1б.
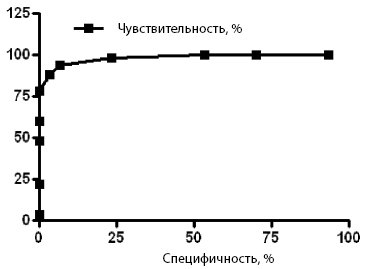
Рис. 3. ROC-кривая для подгруппы 1а и группы 2.
Таблица 3. Диагностическая ценность комплексного показателя СІ при расчете по формулам с учетом предтестовой вероятности.
| Показатель |
Сравнение подгрупп 1а и 1б |
Сравнение подгруппы 1а и группы 2 |
| Чувствительность, % |
93 |
93 |
| Специфичность, % |
84 |
94 |
| ППЦ, % |
85 |
94 |
| НПЦ, % |
93 |
93 |
Таблица 4. Диагностическая ценность комплексного показателя СІ при расчете по общепринятым формулам без учета предтестовой вероятности.
| Показатель |
Сравнение подгрупп 1а и 1б |
Сравнение подгруппы 1а и группы 2 |
| Чувствительность, % |
93 |
93 |
| Специфичность, % |
84 |
94 |
| ППЦ, % |
93 |
96 |
| НПЦ, % |
84 |
87 |
При сравнении подгрупп 1а и 1б дополнительно анализировали диагностическую точность CI для больных с одно- и многососудистым поражением коронарного русла (табл. 5).
Таблица 5. Диагностическая ценность комплексного показателя СІ для одно- и многососудистого поражения при сравнении подгрупп 1а и 1б.
| Показатель |
Однососудистое поражение (n=25) |
Многососудистое поражение (n=29) |
| Чувствительность |
89 |
96 |
| Специфичность |
84 |
84 |
| ППЦ |
84 |
85 |
| НПЦ |
89 |
96 |
При вероятностном анализе были определены верхняя и нижняя границы промежуточного класса – соответственно 8,65 и 11,12. К этому классу (со значениями CI 9–11) были отнесены 19 (76 %) пациентов подгруппы 1б, 10 (19 %) – подгруппы 1а и 9 (30 %) больных группы 2.
Выбор диагностической стратегии является особенно ответственным в группе пациентов с промежуточной (30–70 %) предтестовой вероятностью заболевания, поскольку согласно теореме Байеса именно у таких больных результаты теста имеют наибольшее влияние на клинически значимое диагностическое решение [22].
Настоящая статья посвящена изучению диагностических возможностей МКГ у больных именно с промежуточной вероятностью значимой обструкции коронарных артерий. Были проанализированы МКГ-параметры, характеризующие разные аспекты электрофизиологии миокарда, прежде всего его электрическую однородность (гомогенность). Такие параметры, как AIQRStotal и AIST-Ttotal, отражают соответствие направления перемещения потока электрических зарядов физиологической норме, а также пространственную (региональную) гомогенность миокарда в каждый момент времени и в целом в течение деполяризации и реполяризации соответственно. Эти показатели, по-видимому, свидетельствуют и об изменениях глубины залегания зоны максимальной электрической активности [5]. Показатель Сcor отражает степень сходства между собой пространственной структуры карт на протяжении интервала ST-T. По показателю Adur можно судить о гладкости изменений суммарной величины тока на протяжении интервала ST-T. Чем выше значения Сcor и ниже значения Adur тем более похожи между собой карты РПТ внутри интервала SТ-T, тем выше гомогенность процесса реполяризации в целом. Уменьшение значений Сcor и увеличение Adur почти всегда происходит за счет начальной части сегмента ST. Продолжительность этого начального участка соответствует времени, в течение которого некоторые зоны миокарда находятся в более ранней 2-й фазе трансмембранного потенциала действия по сравнению с окружающими участками, которые находятся в 3-й фазе. То есть, продолжительность этого участка отражает степень негомогенности реполяризации [7]. Наконец показатель R/Tcurrent отражает соотношение суммарной плотности тока на вершине зубца Т и плотности тока на вершине зубца R (абсолютные значения амплитуд зубцов МКГ в большой степени зависят от расстояния между источником сигнала (сердцем) и плоскостью измерения). Значение и электрофизиологический смысл амплитуды Т хорошо известны в электрокардиографии. Амплитуда зубца Т является своеобразным «символом» трансмуральной дисперсии реполяризации.
Полученные данные свидетельствуют об увеличении электрической неоднородности миокарда при значительном ограничении коронарного кровотока, даже при малоизмененной ЭКГ в покое по сравнению с группой без гемодинамически значимого стеноза и тем более со здоровыми. Проанализировав диагностическую ценность каждого из этих показателей, выявили их достоверные различия в группах. ППЦ составила 58–80 %, НПЦ – 66–72 %. Диагностическая точность показателей, описывающих реполяризацию желудочков (AIST-Ttotal, Adur, Ccor), оказалась существенно выше таковой для AQRStotal, «отвечающего» за деполяризацию желудочков. Это объяснимо, учитывая, что при измерении компоненты Z магнитного поля сердца мы фактически регистрируем сигналы, связанные с током, направление которого тангенциально (параллельно) к плоскости измерений.
В дополнение к отдельным параметрам нами предложен комплексный МКГ-индекс (CI), синтезирующий эффект отдельных входящих в него показателей. Методология построения комплексного показателя может быть разной. В более ранних работах для этой цели мы применяли методы мультивариантной статистики [17]. В настоящем исследовании выбран другой эмпирико-статистический прием – формирование комплексного индекса на основе балльных оценок (подобный подход используют для оценки результатов пробы с дозированной физической нагрузкой, применяя индекс Дюка). Как и ожидалось, диагностическая ценность комплексного индекса оказалась выше, чем ценность любого из входящих в него отдельных параметров: ППЦ и НПЦ составили соответственно 85 и 93 %.
Цель любого диагностического теста – снизить уровень неопределенности, иными словами увеличить уверенность врача в правильности принимаемых им решений. В настоящей статье проанализированы группы пациентов, для которых таким решением является назначение КГ. При этом предтестовая вероятность гемодинамически значимого коронарного стеноза у обследованных больных – около 50 %, следовательно, степень неопределенности максимальная. Постмагнитокардиографическая вероятность (термин образован по аналогии с «постэлектрокардиографической вероятностью» [29]) того, что гемодинамически значимый стеноз отсутствует, составляет 85 % при условии отрицательного результата МКГ-исследования. При условии положительного результата МКГ-вероятность наличия гемодинамически значимого стеноза составляет 93 %. Таким образом, полученные нами результаты МКГ резко снижают неопределенность в принятии решения: в этой группе пациентов при положительном результате МКГ коронарографическое исследование следует назначить, а при отрицательном – нет. Однако даже интуитивно понятно, что полученная для всей группы посттестовая вероятность не может быть одинаково верной для всех обследованных, независимо от положения конкретного значения комплексного МКГ-индекса каждого пациента на шкале по отношению к пороговому значению. Поэтому нами был применен уточненный вероятностный анализ и выделена промежуточная зона сомнения. Оказалось, что к этой группе отнесено, как и ожидалось, большинство (76 %) больных подгруппы 1б, но также значительная часть (22 %) обследованных двух других групп. Для решения вопроса о правильной диагностической стратегии у этих лиц нужна дополнительная информация. Возможно, для еще большего уменьшения неопределенности в выборе имеет смысл использование многозначных (больше 3 интервалов значений параметра) решающих правил.
Полученные в этом исследовании достаточно высокие значения диагностической точности достигнуты в состоянии покоя. Причины электрофизиологических изменений в покое у больных с ИБС различны. В первую очередь, изменения реполяризации как результат апоптоза [10]. Также предыдущие эпизоды ишемии миокарда могут приводить к некрозу клеток в ограниченных участках миокарда, что вызывает нарушения электрогенеза. Установлено, что преходящая ишемия способствует увеличению интерстициального фиброза в эндокарде больных без инфаркта миокарда в анамнезе [27]. Высказано предположение, что при ИБС и в состоянии покоя имеется значительная альтернация уровня кровоснабжения миокарда, что также может привести к тонким электрофизиологическим изменениям.
Известно, что ишемия миокарда сопровождается активацией свободнорадикальных процессов, и это должно проявляться нарушениями в функционировании ионных каналов, изменениями трансмембранного потенциала, возбудимости клеток проводящей системы и кардиомиоцитов. Можно предположить, что изменения МКГ-параметров у пациентов с ИБС в состоянии покоя обусловлены ухудшениями таких электрофизиологических характеристик, как функционирование мембран и межклеточных соединений, скорости проведения, сложными и разнообразными нарушениями перфузии и метаболизма.
Анализируя возможности применения разных методов функциональной диагностики ИБС, необходимо принимать во внимание их положение на ступенях «ишемического каскада». Например, систолическая дисфункция миокарда, которая определяется методом эхокардиографии при нагрузке, в ишемическом каскаде появляется позднее, чем неоднородность кровотока. Изменения сегмента ST на ЭКГ проявляются еще позднее, и поэтому возможности ЭКГ в выявлении ишемии миокарда даже при нагрузке ограничены.
МКГ намного более чувствительна, чем ЭКГ, к изменениям в распределении плотности тока, то есть форма МКГ-сигнала изменяется и в тех случаях, когда форма ЭКГ-сигнала не отличается от нормальной. Это преимущество МКГ может быть особенно наглядно продемонстрировано на примере дислокации сегмента ST (рис. 4, 5).
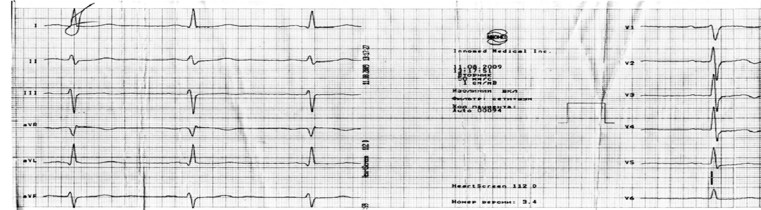
Рис. 4. ЭКГ в 12 отведениях больного Л. с поражением двух коронарных сосудов.
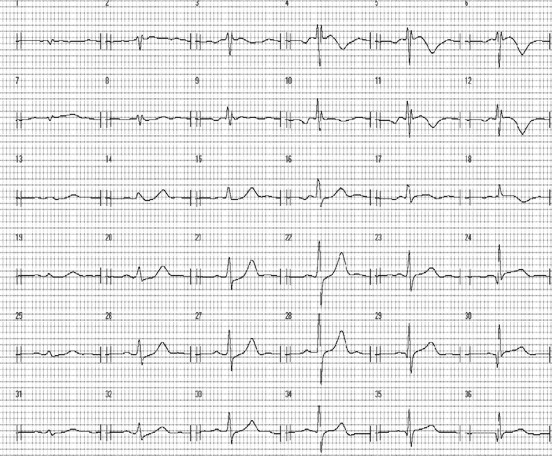
Рис. 5. МКГ в 36 точках больного Л. с поражением двух коронарных сосудов.
На рис. 4 и 5 изображены стандартная ЭКГ и МКГ, зарегистрированная в тот же день через 30 мин. На ЭКГ ни в одном из отведений не зафиксировано смещение сегмента ST, в то время как в точках 4 и 5 МКГ-сетки четко видно элевацию, а в точках 14 и 20 – депрессию сегмента ST.
Отвечая на вопрос о месте выявленных с помощью МКГ-исследования изменений на ступенях ишемического каскада, следует предположить два варианта: в ряде случаев МКГ выявляет изменения на самой ранней стадии ишемического каскада, в других случаях МКГ в покое находится вне ишемического каскада, регистрируя «следы» эпизодов преходящей ишемии миокарда, которые имели место ранее.
Не наблюдали существенных различий значения CI у больных с однососудистым и многососудистым поражением. Вероятно, степень недостаточности перфузии миокарда и, следовательно, электрической негомогенности зависит не cтолько от количества стенозированных артерий, сколько от степени стеноза, состояния коллатерального кровообращения и микроциркуляторного русла.
Данное исследование выполнено в специализированных авторитетных кардиологических клиниках. Однако, как показывает повседневная клиническая практика, даже в учреждениях такого уровня не только в Украине, но и в Западной Европе точное следование диагностическому алгоритму, рекомендованному в работе [22], представляет определенные трудности. Радиоизотопные нагрузочные тесты в обоих учреждениях не проводят, СЭ выполняют нерегулярно. У значительной части больных имелись противопоказания к проведению нагрузочного теста на велоэргометре. Несколько пациентов отказались от нагрузочного теста. В ряде случаев результаты пробы с нагрузкой оказывались сомнительными или неинформативными. Таким образом, МКГ-исследование, не имеющее противопоказаний, максимально комфортное для пациентов, не требующее участия врача в момент регистрации и предварительной обработки сигнала, является рациональной практической альтернативой нагрузочным функциональным тестам.
Настоящее исследование имеет ряд ограничений. Прежде всего, количество обследованных во всех группах должно быть увеличено, группы должны быть более сбалансированы по гендерному признаку (в нашем исследовании преобладают мужчины). Также один из МКГ-параметров – MAPtotal – представляет собой визуальный анализ структуры одной суммарной карты РПТ, поэтому желательно разработать программное обеспечение, основанное на современных методах распознавания образов [14]. Кроме того, данное исследование не включает анализ цена/эффект на основе формальных критериев экономической эффективности диагностического метода. Такой анализ мы планируем провести в следующих работах.
Выводы
- Показатели диагностической ценности комплексного магнитокардиографического индекса в диагностике ишемической болезни сердца у больных с промежуточной предтестовой вероятностью заболевания и нормальными результатами электрокардиографии и эхокардиографии в покое составляют: позитивная прогностическая ценность – 85 %, негативная – 93 %.
- Магнитокардиографическое исследование в состоянии покоя может быть рекомендовано как метод первой линии в диагностике гемодинамически значимого коронарного стеноза.
Авторы выражают искреннюю благодарность Ю. Фролову, С. Романовичу, Л. Файнзильбергу, Н. Прогоному за плодотворное участие в создании программного обеспечения, использованного в данном исследовании, Н.Н. Буднику – за существенную помощь в статистической обработке данных, а также Госинформнауки Украины – за поддержку в рамках проектов М/300-2011 и ДЗ/466-2011.
Литература
- Закорчений О., Будник М. Вирішення задачі класифікації в просторі
ймовірностей // Комп’ютернi засоби, системи та мережі: Зб. наук. пр. НАН
України. – Ін-т кібернетики
ім. В.М. Глушкова / За ред. О.В. Палагіна. – К., 2010. –
№ 9. – С. 27–36.
- Корнацький В.М. Проблеми здоров’я суспільства та продовження життя.
– К.: Інститут кардіології ім. М.Д. Стражеска, 2006. – 46 с.
- Лутай М.И., Немчина Е.А., Цыж А.В. и др. Диагностическая значимость
стресс-эхокардиографии с добутамином для определения ишемической болезни
сердца // Укр. кардіол. журн. – 2006. – № 6. – С. 8–15.
- Лутай М.И., Чайковский И.А., Сосницький В.М. и др. Распределение
магнитного поля в процессе реполяризации при хронической ИБС сердца по
данным магнитокардиографии // Укр. кардіол. журн. – 1995. – № 6. – С.
9–11.
- Сосницький В.М., Войтович И.Д., Бойчак М.П та ін. Магнітне картування
серця – нова інформаційна технологія неінвазивної електрофізіології //
Доповіді Національної академії наук України. – 2011. – № 1. – C. 166–171.
- Сосницкий В., Войтович И., Сутковой П. и др. Оптимизация технологии
магнитокардиографического картирования // Управляючі системи і машини.
– 2010. – № 4. – С. 64–71.
- Чайковский И., Бойчак М., Сосницкий В. и др. Магнитокардиография
в клинической практике: алгоритмы и технологии анализа данных // Лікарська
справа. – 2011. – № 3–4. – С. 3–20.
- Эпидемиология и факторы риска ишемической болезни сердца / Под.
ред. А.Н. Климова. – Л.: Медицина, 1989. –
176 с.
- Baer F.M. Stress-ECG is adequate to detect myocardial ischemia:
when are additional diagnostic tests needed // Dtsch. Med. Wochenschr.
– 2008. – № 132 (39). – P. 2026–2030.
- Buja L.M., Entman M.L. Modes of myocardial cell injury and cell
death in ischemic heart disease // Circulation. – 1998. –
Vol. 98. – P. 1355–1357.
- Baule G.M., McFee R. The magnetic heart vector // Amer. Heart J.
– 1970. – P. 721–729.
- Cassar A., Holmes D., Charanjit S. et al. Chronic coronary artery
disease: diagnosis and management // Mayo Clin.
Proc. – 2009. – Vol. 84 (12). – P. 1130–1146.
- Chaikovsky I., Auth-Eisernitz S., Avolin B. et al. Atlas of typical
magnetocardiographic maps for diagnosis of CAD within ST-T interval //
Proc. of 14th International Conference on Biomagnetism, Boston, 2004. –
P. 393–394.
- Chaykovskyy I., Dovbysh A., Budnyk M. et al. Development of pattern
recognition method for diagnosis of myocardial ischemia and noncoronarogenic
myocardial diseases based on current density distribution maps // Federation
Med&Biol Engineering (IFMBE) Proceedings Series. – 2010. – Vol. 28.
– Springer Verlag: Heidelberg. – P. 424–427.
- Chaikovsky I., Ebmeyer S., Hailer B. et al. Predictive value of
the magnetocardiogram for location of regional ischemia or infarction as
detected by quantitative analysis of the coronary arteriogram. // Congress
Series (ICS) 1300 / Ed. D. Cheyne, B. Ross, G. Stroink, H. Weinberg. –
Rotterdam (Netherlands): Elsevier Science, 2007. – P. 463–467.
- Chaikovsky I., Koehler J., Hecker T. et al. High sensitivity of
magnetocardiography in patients with coronary artery disease and normal
or unspecifically changed electrocardiogram
// Circulation. – 2000. – Vol. 102. – P. 3822.
- Chaikovsky I., Steinberg F., Hailer B. et al. Possibilities of
magnetocardiography in CAD detection in patients with normal or unspecifically
changed ECG // Proc. 3rd Intern. Congress on CAD. – Lyon, 2000. – P. 415–421.
- Connolly D.C., Elveback L.R., Oxman H.A. Coronary heart disease
in residents of Rochester, Minnesota: Prognostic value of the resting electrocardiogram
at the time of initial diagnosis of angina pectoris // Mayo Clin. Proc.
– 1984. – Vol. 59. – P. 247–250.
- Geleijnse M.L., Fioretti P.M., Roelandt J.R. Methodology, feasibility,
safety and diagnostic accuracy of dobutamine stress echocardiography //
J. Amer. Coll. Cardiology. – 1997. –
Vol. 30. – P. 595–606.
- Gershlick A.H., de Belder M., Chambers J. et al. Role of non-invasive
imaging in the management of coronary artery disease: an assessment of
likely change over the next 10 years. A report from the British Cardiovascular
Society Working Group
// Heart. – 2007. – Vol. 93. – P. 423–431.
- Gibbons R.J., Abrams J., Chatterjee K. et al. ACC/AHA 2002 guideline
update for the management of patients with chronic stable angina – summary
article: a report of the American College of Cardiology / American Heart
Association Task Force on practice guidelines (Committee on the Management
of Patients With Chronic Stable Angina) // J. Amer. Coll. Cardiology.
– 2003. – Vol. 41 (1). – P. 159–168.
- Gibbons R.J., Balady G.J., Bricker J.T. et al. ACC/AHA 2002 guideline
update for exercise testing: summary article: a report of the American
College of Cardiology/American Heart Association Task Force on Practice
Guidelines (Committee on Exercise Testing) // J. Amer. Coll. Cardiology.
– 2002. –
Vol. 40. – P. 1531–1540.
- Hailer B., Chaikovsky I., Auth-Eisernitz S. et al. The value of
MCG in pts with and without relevant stenoses of the coronary arteries
using an unshielded system // PACE. – 2005. –
Vol. 28. – P. 8–15.
- Ho K.T., Miler T.D., Hodge D.O. et al. Use a simple clinical score
to predict prognosis of patients with normal or mildly abnormal resting
electrocardiographic findings undergoing evaluation of coronary artery
disease // Mayo Clin. Proc. – 2002. – Vol. 77. – P. 515–521.
- Hoilund-Karlsen P., Johansen A., Christensen H. et al. Potential
impact of myocardial perfusion scintigraphy as gatekeeper for invasive
examination and treatment in patients with stable angina pectoris: observational
study without post-test referral bias // Eur. Heart J. – 2006. – Vol. 27.
– P. 29–34.
- Kemp H.G., Kronmal R.A., Vietstra R.E., Frye R.L. Seven year survival
of patients with normal coronary arteriograms: a CASS registry study //
J. Amer. Coll. Cardiology. – 1986. – Vol. 7. – P. 479–483.
- Krogmann O.N., Traber J., Jakob M. et al. Determinants of left
ventricular diastolic function during myocardial ischemia: influence of
myocardial structure and pericardial constraint // Coron. Artery Dis. –
1998. – Vol. 9 (5). – P. 239–248.
- May O., Schlosser H., Skytte L. A high pressure predicts bleeding
complications and a longer hospital stay after elective coronary angiography
using the femoral approach // J. Interv. Cardiology. – 2009. – Vol. 22.
– P. 175–178.
- Melin J., Wijns W., Vanbutsele R. et al. Alternative diagnostic
strategies for coronary artery disease in women: demonstration of the usefulness
and efficiency of probability analysis // Circulation. – 1985. – Vol. 71,
№ 3. – P. 535–542.
- Rocchi G., Fallani F., Bracchetti G. et al. Non-invasive detection
of coronary artery stenosis: a comparison among power-Doppler contrast
echo, 99Tc-sestamibi SPECT and echo wall-motion analysis // Coron. Artery
Dis. – 2003. – Vol. 14. – P. 239–245.