Аннотация
Майкл Дж. Лаццарони, Дэвид Буш, Джейсон П.Халлетта, Джеймс С.Браун, Чарльз Л.Лиотта, Чарльз А.Эккерт, Роджер Гласер -
Равновесие пар-жидкость-жидкость для систем, содержащих диоксид углерода, органический компонент и воду при высоких давлениях
Сверхкритический диоксид углерода, хоть и является инертным разбавителем, способен повысить выход и/или селективность
для гомогенно- и геторогенно-каталитических реакций и улучшить восстановление гомогенных катализаторов. Для реакций,
включающих постоянные газы (т.е. О2, CO и H2) и жидкости, добавление диоксида углерода может
повысить взаимную растворимость и снизить сопротивление массобмену. В гомогенно-каталитических реакциях, растворимость
или нерастворимость катализатора может настраиваться присутствием диоксида углерода, таким образом обеспечивающего
высокую восстанавливаемость катализатора.
Фазовые равновесия для систем, содержащих диоксид углерода, органический компонент (тетрагидрофуран, ацетонитрил, или
1,4-диоксан), воду при высоких давлениях, измерялись с использованием сапфировой трубки переменного объема. Используя
измерение суммарного объема и зная добавленную массу, мы можем рассчитать состав и плотность обеих фаз. Это обеспечивает
быстрое и легкое измерение без отбора проб или калибровки. Мы обнаружили, что данные системы хорошо описываются
уравнением состояния Пенга-Робинсона с правилами смешения Вонга-Сандлера с поправками на бинарную систему. Применение
фазового поведения направлено на реакционные условия и условия разделения.
Введение
Сверхкритический диоксид углерода, хоть и является инертным разбавителем, способен повысить выход и/или селективность для гомогенно- и геторогенно-каталитических реакций и улучшить восстановление гомогенных катализаторов. Для реакций, включающих постоянные газы (т.е. О2, CO и H2) и жидкости, добавление диоксида углерода может повысить взаимную растворимость и снизить сопротивление массобмену.
В гомогенном катализе мы использовали уникальное фазовое поведение CO2. СО2 единственный нетоксичный, негорючий растворитель, смешивающийся с фторуглеводородами, углеводородами и большинством полярных органических веществ, такими как спирты, эфиры, кетоны и нитрилы, но не смешивающийся с водой. Для фторорганических двухфазных реакций [1], CO2 может быть добавлен для их запуска в гомогенной среде с повышением выхода реакции [2]. CO2 может также быть использован для улучшения водно-органических двухфазных реакций. Традиционная методика водно-органических реакций, распространенная Рурчем/Рон-Пуленс процессом [3] требует нерастворимого в воде растворителя, который нужен для рециркуляции каталиатора, но не мешающего массобмену. Здесь добавление полярного органического сорастворителя в сочетании с последующим расщеплением фазы, индуцированного растворением газообразного диоксида углерода, создает возможность для запуска гомогенных реакций в органической/водной смеси с водорастворимым катализатором. После CO2-инициированного разделения фаз, богатая катализатором водная фаза и богатая продуктом реакции органическая фаза могут быть легко декантированы и водная фаза рециркулируется.
Для исследования осуществимости этих процессов изучались равновесия пар-жидкость-жидкость в смеси вода – CO2 – тетрагидрофуран, 1,4-диоксан, или ацетонитрил при 25°, 40° и 60°С и давлениях 10-57 бар.
Методика исследования
Реактивы.Тетрагидрофуран для ВЭЖХ (99%), 1,4-диоксан (99%), ацетонитрил (99%) и вода (99%) были получены от Олдрич Кемикал Компани и использовались сразу после получения. Диоксид углерода особой чистоты (99,99%) был получен от Мэтисон Газ. СО2 был дополнительно очищен для удаления следов влаги с использование Мэтисон (модель 450В) газоочистителя и фильтровального картриджа (тип 451).
Установка.На рис.1 приведена схема установки с ячейкой равновесия. Ячейка равновесия состоит из полого сапфирового цилиндра (50,8 мм наружный диаметр, 25,4±0,0001 мм внутренний диаметр, 203,2 мм длина) с подвижным поршнем из нержавеющей стали внутри и крышками также из нержавеющей стали. Ячейка разделена на две части, разделенные уплотнительным кольцом на поршне, с одной стороны находятся равновесные компоненты и с другой стороны сжимающую жидкость, в данном случае воду. Постоянство температур поддерживалось воздушной баней в ячейке с точностью ±0,2 К.
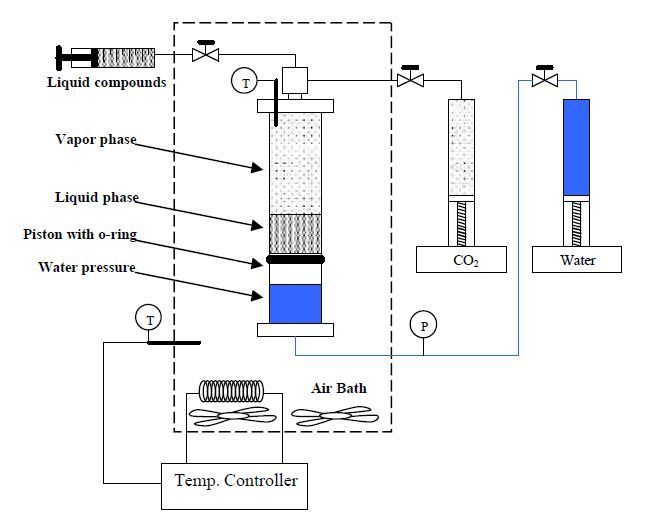
Рисунок 1 – Схема установки с ячейкой равновесия
Жидкие компоненты добавлялись в ячейку с использованием газонепроницаемого шприца. Шприц взвешивался перед и после добавления для определения массы добавленной жидкости. СО2 добавлялся в ячейку шприцевым насосом при постоянных температуре и давлении. Используя разность объемов шприца и уравнение состояния Спана-Вагнера, рассчитывалось число молей добавленного СО2.
Объемы жидкости и пара рассчитывались измерением высоты менисков с помощью микрометрического катетометра. Для разницы менее 50 мм точность составляла 0,01 мм, для большей разности точность 0,1 мм.
Эксперимент.Процедура измерения фазовых равновесий подобна использованной Ренон и др. [4]. Вкратце, 3 компонента, 3 фазы и постоянные температура и давление - 0 степеней свободы; таким образом, концентрация в каждой фазе была независима от общей концентрации. Минимум три загрузки разных составов необходимо для расчета составов и молярных объемов трех фаз по измерениям объемов каждой фазы и общему составу. В данном эксперименте было сделано пять загрузок для большей точности.
Дополнительно состав и молярный объем паровой фазы предполагались по известным данным. Поскольку одна из жидких фаз практически полностью состоит из воды, парциальное давление воды в паровой фазе предполагалось равным давлению насыщенного пара, и состав остальных двух компонентов предсказывался по данным двухфазной системы с поправкой. Молярный объем паровой фазы предполагался с учетом того, что данная фаза состоит из чистого СО2, поскольку его содержание никогда не было менее 98%.
Результаты эксперимента
Фазовые равновеси пар-жидкость-жидкость системы диоксид углерода – тетрагидрофуран (ТГФ) – вода при высоких давлениях были измерены при 298,15 К, 313,15 К, 333,15 К и давлениях 10-52 бар. Состав и молярные объемы приведены в таблице 1. Состав паровой фазы в таблицах не показан.
Фазовые равновеси пар-жидкость-жидкость системы диоксид углерода – ацетонитрил (АЦН) – вода при высоких давлениях были измерены при 313,15 К и давлениях 18,6-52 бар. Состав и молярные объемы приведены в таблице 2.
Фазовые равновеси пар-жидкость-жидкость системы диоксид углерода – 1,4-диоксан (ДИОКС) – вода при высоких давлениях были измерены при 313,15 К и давлениях 27,7-57 бар. Состав и молярные объемы приведены в таблице 1.
Таблица 1 – Параметры системы диоксид углерода – тетрагидрофуран (ТГФ) – вода при 298 К, 313 К, 333 К
| Т (К) | Р (бар) | Жидкая фаза 1 (L1) | Жидкая фаза 2 (L2) | Паровая фаза | ||||||
| х СО2 | х ТГФ | х Н2О | νL (см³/моль) | х СО2 | х ТГФ | х Н2О | νL (см³/моль) | νV (см³/моль) | ||
| 298 | 10,3 | 0,005 | 0,136 | 0,859 | 23,6 | 0,085 | 0,492 | 0,423 | 58,2 | 2267,6 |
| 298 | 20,7 | 0,014 | 0,076 | 0,910 | 20,9 | 0,300 | 0,542 | 0,158 | 61,8 | 1065,0 |
| 298 | 31,0 | 0,049 | 0,049 | 0,902 | 19,4 | 0,436 | 0,461 | 0,103 | 62,1 | 658,8 |
| 298 | 41,4 | 0,057 | 0,039 | 0,904 | 19,4 | 0,657 | 0,295 | 0,048 | 54,1 | 449,4 |
| 298 | 51,7 | 0,054 | 0,020 | 0,926 | 17,1 | 0,847 | 0,142 | 0,011 | 54,0 | 316,0 |
| 313 | 9,9 | 0,012 | 0,118 | 0,870 | 25,1 | 0,045 | 0,511 | 0,445 | 53,4 | 2512,6 |
| 313 | 24,2 | 0,028 | 0,072 | 0,901 | 22,1 | 0,216 | 0,520 | 0,264 | 58,3 | 957,9 |
| 313 | 38,6 | 0,016 | 0,045 | 0,939 | 20,2 | 0,437 | 0,445 | 0,119 | 60,3 | 549,5 |
| 313 | 44,9 | 0,011 | 0,044 | 0,945 | 20,3 | 0,568 | 0,384 | 0,049 | 60,8 | 451,9 |
| 313 | 52,1 | 0,030 | 0,033 | 0,937 | 19,9 | 0,625 | 0,324 | 0,051 | 59,1 | 367,4 |
| 333 | 10,3 | 0,000 | 0,095 | 0,905 | 23,9 | 0,037 | 0,600 | 0,364 | 58,2 | 2584,0 |
| 333 | 20,7 | 0,003 | 0,058 | 0,939 | 22,3 | 0,131 | 0,597 | 0,272 | 55,5 | 1240,7 |
| 333 | 31,0 | 0,001 | 0,043 | 0,955 | 21,0 | 0,224 | 0,573 | 0,202 | 59,2 | 791,1 |
| 333 | 41,4 | 0,021 | 0,040 | 0,939 | 20,5 | 0,306 | 0,548 | 0,146 | 64,6 | 565,3 |
| 333 | 51,7 | 0,004 | 0,006 | 0,990 | 20,4 | 0,424 | 0,482 | 0,094 | 58,0 | 428,6 |
Таблица 2 – Параметры системы системы диоксид углерода – ацетонитрил (АЦН) – вода при 313 К
| Т (К) | Р (бар) | Жидкая фаза 1 (L1) | Жидкая фаза 2 (L2) | Паровая фаза | ||||||
| х СО2 | х АЦН | х Н2О | νL (см³/моль) | х СО2 | х АЦН | х Н2О | νL (см³/моль) | νV (см³/моль) | ||
| 313 | 18,6 | 0,038 | 0,229 | 0,733 | 25,7 | 0,076 | 0,435 | 0,489 | 33,6 | 1283,7 |
| 313 | 24,1 | 0,019 | 0,136 | 0,845 | 21,0 | 0,170 | 0,594 | 0,237 | 42,7 | 960,6 |
| 313 | 31,0 | 0,010 | 0,067 | 0,924 | 20,1 | 0,258 | 0,624 | 0,119 | 44,1 | 717,9 |
| 313 | 41,4 | 0,011 | 0,082 | 0,907 | 18,0 | 0,407 | 0,527 | 0,066 | 49,7 | 503,0 |
| 313 | 51,7 | 0,025 | 0,056 | 0,918 | 18,7 | 0,495 | 0,434 | 0,071 | 46,6 | 370,9 |
Таблица 3 – Параметры системы системы диоксид углерода – 1,4-диоксан – вода при 313 К
| Т (К) | Р (бар) | Жидкая фаза 1 (L1) | Жидкая фаза 2 (L2) | Паровая фаза | ||||||
| х СО2 | х ДИОКС | х Н2О | νL (см³/моль) | х СО2 | х ДИОКС | х Н2О | νL (см³/моль) | νV (см³/моль) | ||
| 313 | 27,7 | 0,081 | 0,247 | 0,672 | 35,0 | 0,200 | 0,435 | 0,365 | 52,8 | 819,7 |
| 313 | 29,3 | 0,055 | 0,210 | 0,735 | 32,8 | 0,247 | 0,434 | 0,319 | 49,8 | 768,0 |
| 313 | 31,0 | 0,037 | 0,174 | 0,789 | 29,8 | 0,309 | 0,458 | 0,233 | 53,2 | 717,9 |
| 313 | 37,9 | 0,018 | 0,115 | 0,867 | 24,5 | 0,443 | 0,443 | 0,125 | 57,6 | 562,1 |
| 313 | 43,4 | 0,025 | 0,091 | 0,884 | 22,9 | 0,509 | 0,374 | 0,117 | 55,8 | 471,9 |
Обработка экспериментальных данных
Для моделирования фазовых равновесий было выбрано уравнение состояния Пенга-Робинсона [5] с модификацией Страека и Вера [6] (ПРСВ). Параметры чистых компонентов для ПРСВ приведены в таблице 4. Было применено несколько типов правил смешения для приведения к бинарным фазовым равновесиям, включая два параметра Ван-дер-Ваалься, правила Матиас-Клоц-Праушниц [7] и Вонг-Сандлера [8]. Из этих правил только правила Вонг-Сандлера (ВС) применимы для поведения водно-органических фаз точно. Остальные предсказывают несмешиваемость жидкостей, как показано на рис. 2. Оба выражения NRTL [9] и UNIQUAC [10] gE исследовались как часть правил смешения ВС.
Таблица 4 – Параметры чистых компонентов с использованием уравнения состояния ПРСВ
| Соединения | Тс (К) | Рс (бар) | ω | κ1 | r | q |
| СО2 | 304,21 | 73,6 | 0,2250 | 0,04285 | 1,299 | 1,292 |
| Н2О | 647,1 | 220,55 | 0,3438 | -0,06635 | 0,920 | 1,400 |
| тетрагидрофуран | 540,15 | 51,9 | 0,2255 | 0,03961 | 2,866 | 2,172 |
| ацетонитрил | 545,5 | 48,3 | 0,3371 | -0,13991 | 1,870 | 1,724 |
| 1,4-диоксан | 587 | 52,08 | 0,2793 | 0,02013 | 3,073 | 2,360 |
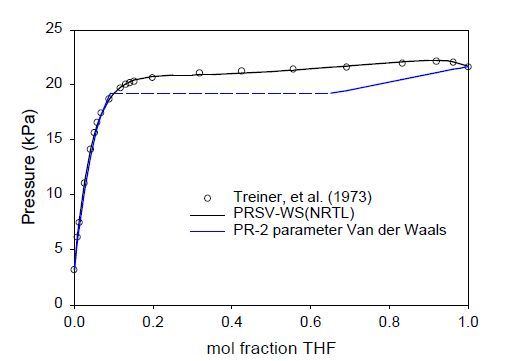
Рисунок 2 – Р-х диаграмма бинарной системы ТГФ – вода при 298 К с рачетом по ПР с поправками Вонг-Сандлера и двумя параметрами Ван-дер-Ваальса
Данные по семи составным бинарным системам были собраны из литературы, в них была введена поправка с использованием уравнения состояния ПРСВ-ВС. Параметры взаимодействия для модели gE и параметры бинарных взаимодействий были приведены к данным с помощью метода наименьших квадратов по значениям давления. Параметры смешения и ошибка в процентах показаны в таблице 5.
Таблица 5 – Поправки для данных по бинарным системам и параметры смешения при использовании уравнения состояния ПРСВ-ВС
| Система | Np | Т диапазон (К) | NTRLa | UNIQUAC | Источник данных | ||||
| g12/g21b | k12 | %ΔР | U12/U21 | k12 | %ΔР | ||||
| СО2+Н2О | 10 | 323 | 1850/2191 | -0,383 | 3,01 | 1979/1308 | -0,479 | 1,77 | [11] |
| СО2+ТГФ | 8 | 313 | 755/-304 | 0,384 | 0,06 | 241/-38 | 0,380 | 0,02 | [12] |
| ТГФ+Н2О | 43 | 298 | 1649/1949 | 0,108 | 0,74 | 1300/-206 | 0,134 | 3,68 | [13,14] |
| СО2+АЦН | 22 | 313 | 4569/-1,3 | 0,298 | 4,00 | 10219/-398 | 0,340 | 3,79 | [15] |
| АЦН+Н2О | 44 | 323 | 1106/1219 | 0,260 | 0,20 | 748/925 | -0,104 | 0,26 | [16,[17] |
| СО2+ДИОКС | 48 | 313 | -437/984 | 0,338 | 4,84 | -416/940 | 0,338 | 4,94 | [15] |
| ДИОКС+Н2О | 113 | 308-323 | 1119/540 | 0,368 | 1,04 | 1032/102 | -0,189 | 1,21 | [18,19,20,21] |
aα=0,36; bτij=gij/RT
Обсуждение результатов
Предсказание поведения трехфазной системы СО2 – ТГФ – Н2О первого типа при температурах 298 К и 313 К показано на рис.3 (примечание: показаны составы только двух фаз. Составы фазы, богатой СО2 были опущены, т.к. они инвариантны при изучаемых диапазонах температур и давлений). Построенные изотермы хорошо согласуются с экспериментальными данными, хотя предсказания с помощью уравнения ПРСВ-ВС с использованием модели UNIQUAC gE предсказывают более высокое давление расслоения для фазы жидкость-жидкость, чем экспериментальное. Недостаточность данных для системы ТГФ – Н2О при 313 К и склонность к ошибочным предскааниям фазовых расслоений NTRL и UNIQUAC накладываются в плохую сходимость при 313 К.
Предсказание поведения систем первого типа с ацетонитрилом и 1,4-диоксаном при 313 К показано на рис.4 и 5 соответственно. Они в обоих случаях хорошо согласуются с экспериментальными данными, хотя уравнение ПРСВ-ВС с NTRL лучше охватывает поведение в системе СО2 – ацетонитрил.
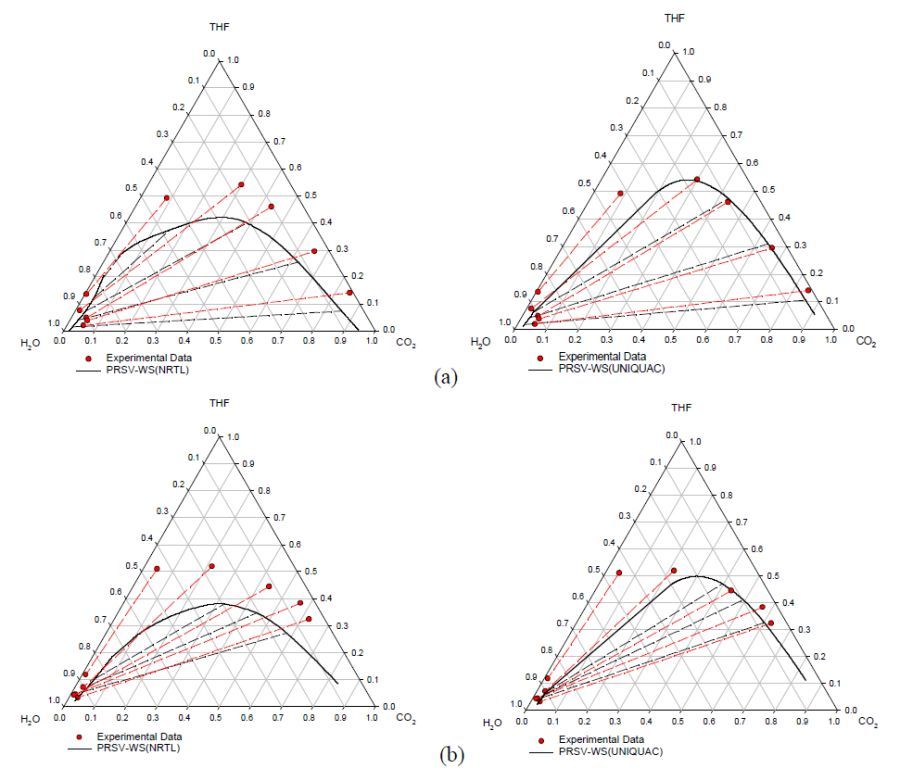
Рисунок 3 – Фазовое поведение системы СО2 – ТГФ – вода при 25°С (а) и при 40°С (b)
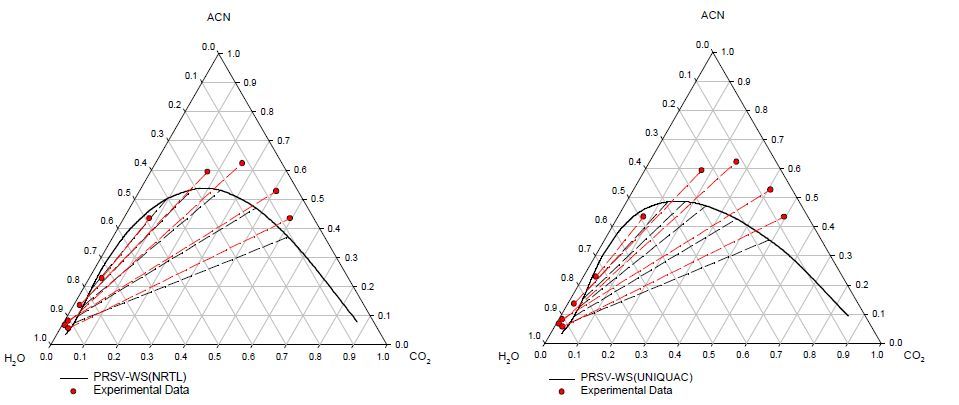
Рисунок 4 – Фазовое поведение системы СО2 – АЦН – вода при 40°С
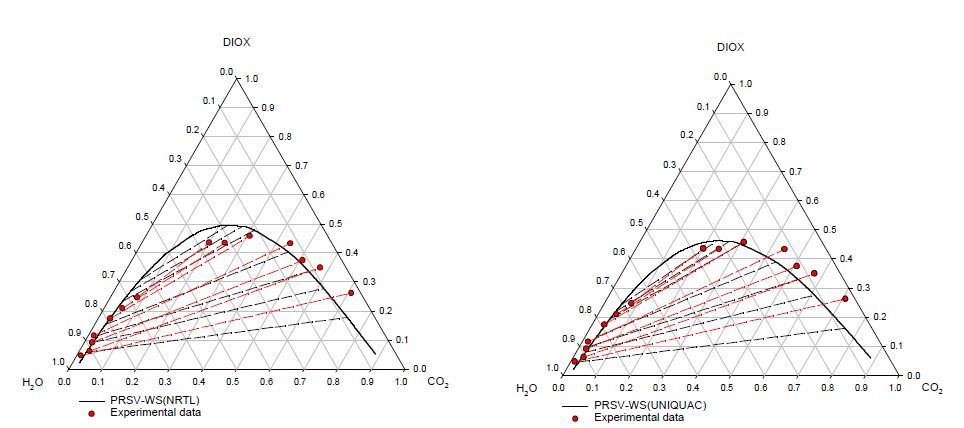
Рисунок 5 – Фазовое поведение системы СО2 – ДИОКС – вода при 40°С
На рис.6 показаны измеренные и предсказанные молярные объемы для двух жидких фаз в равновесии L1L2V при 313 К для системы СО2 – 1,4 – диоксан-вода. Предсказание с помощью уравнения состояния ПРСВ-ВС дает погрешность 6% по сравнению с измеренными молярными объемами.
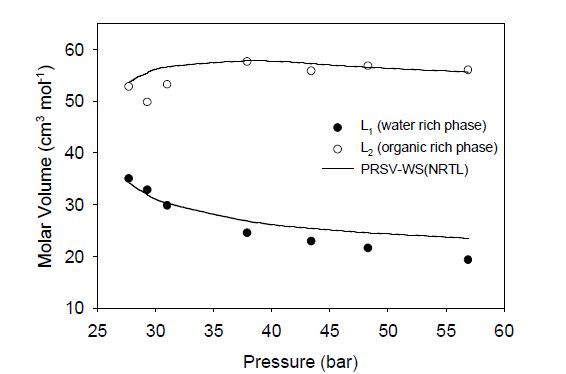
Рисунок 6 – Зависимость молярного объема от давление для жидких фаз L1L2 системы СО2 – 1,4-диоксан – вода при 313 К
Заключение
Экспериментальная методика позволяет точно и быстро проводить измерения трехфазных равновесий без отбора проб и калибровки. Сложность поведения фаз вода-органическое вещество требует более сложных правил смешения. Правила смешения Вонга-Сандлера дают обоснованные предсказания только для бинарных систем.
СО2-индуцированные расслоения для тетрагидрофурана и воды представляются наиболее перспективной системой для рециркуляции водорастворимого катализатора. Очень малое количество СО2 требуется для достижения расслоения фаз, следовательно, рзделения могут быть реализованы при более низких давлениях и эксплуатационных затратах.
Источники
- Horvath, I. T.; Rabai, J. Science. 1994, 266, 72.
- West, K. N.; Hallett, J. P.; Jones, R. S.; Bush, D.; Liotta, C. L.; Eckert, C.A. J. Am.Chem. Soc. 2003. Submitted.
- Kohlpaintner, C. W.; Fischer, R. W.; Cornils, B. Appl. Cat. A 2001, 221, 219.
- Laugier, A.; Richon, D.; Renon, H. Fluid Phase Equilib. 1990, 54, 19.
- Peng, D. Y.; Robinson, D. B. Ind. Eng. Chem. Fundam. 1976, 15, 59.
- Stryjek, R.; Vera, J. H. Can. J. Chem. Eng. 1986, 64, 323.
- Mathias, P. M.; Klotz, H. C.; Prausnitz, J. M. Fluid Phase Equilib. 1991, 67, 31.
- Wong, D. S. H.; Sandler, S. I. Ind. Eng. Chem. Fundam. 1992, 31, 2033.
- Renon, H.; Prausnitz, J. M. AIChE J. 1968, 14, 135.
- Abrams, D. S.; Prausnitz, J. M. AIChE J. 1975, 21, 116.
- Bamberger, A.; Sieder, G.; Maurer, G. J. Supercritical Fluids 2000, 17, 97.
- Lazzaroni, M. J.; Bush, D. Manuscript in preparation.
- Signer, R.; Arm, H.; Daeniker, H. Helv. Chim. Acta. 1969, 52, 2347.
- Treiner, C; Bocquet, J. F.; Chemla, M. J. Chim. Phys. Phys. –Chim. Biol. 1973, 70, 72.
- Kordikowski, A.; Schenk, A. P.; Van Nielen, R. M.; Peters, C. J. J. Supercritical Fluids. 1995, 8, 205.
- Villamanan, M. A.; Allawi, A. J.; Van Ness, H. C. J. Chem. Eng. Data. 1984, 29, 293.
- Wilson, S. R.; Patel, R. B.; Abbott, M. M.; Van Ness, H. C. J. Chem. Eng. Data. 1979, 24, 130.
- Kortuem, G.; Valent, V. Ber. Bunsenges. Phys. Chem. 1977, 81, 752.
- Steinbrecher, M.; Bittrich, H. J. Z. Phys. Chem. 1963, 224, 97.
- Balcazar-Ortiz, A. M.; Patel, R. B.; Abbott, M. M.; Van Ness, H. C. J. Chem. Eng. Data. 1979, 24, 133.
- Loehe, J. R.; Van Ness, H. C.; Abbott, M. M. J. Chem. Eng. Data. 1981, 26, 178.