Выбор методов и алгоритмов построения трехмерной компьютерной модели проблемного участка челюстно-лицевой области.
Авторы: Меркулова Е.В., Алтухов С.С., Плахова Е.Е.
Источник: Вестник Херсонского государственного технического университета. – Херсон: ХГТУ, 2013.
Введение
Диагностика травм челюстно-лицевой области (ЧЛО) была и остается одной из самых актуальных задач челюстно-лицевой хирургии. Качественная диагностика играет важную роль при проведении стоматологического лечения и выполнении ряда операций, таких как имплантация зубов и остеосинтез.
Благодаря развитию материалов и технологий в последние десятилетия имплантация, т.е. вживление в ткани биосовместимых структур и материалов, приобретает все большую популярность [1]. Производство подобных конструкций требует большого внимания к данным каждого пациента, т.к. они являются строго индивидуальными и специфичными. Также данный процесс является достаточно дорогостоящим и требующим больших трудозатрат. Множество погрешностей на этапах планирования хирургического вмешательства и несоответствие вживляемых материалов может привести к качественным дефектам изготавливаемых зубных имплантатов и существенному росту различных осложнений функционального характера [2].
Известными мировыми научно-производственными центрами в сотрудничестве со стоматологами уже давно ведутся разработки в отношении использования технологий компьютерного моделирования. Наиболее известными программными продуктами для изготовления различных ортопедических конструкций, а также для планирования сложных операций в челюстно-лицевой хирургии и имплантологии являются NobelClinician, NobelProcera, Planmeca Romexis, Mimics Z, Implant-Assistant® [3].
Основными недостатками данных программных продуктов являются:
- Не все обеспечение ориентировано на обработку файлов основного медицинского формата DICOM.
- Большинство программных пакетов является составной частью дорогостоящего оборудования.
Поэтому актуальной задачей является создание специализированной компьютерной системы (СКС), которая на основе данных спиральной компьютерной томографии (СКТ) будет визуализировать трехмерную компьютерную модель ЧЛО с учетом размеров и локализации имплантируемой конструкции. Построение трехмерной модели челюсти по данным СКТ позволит наиболее полно представить границы, размеры и объем дефекта (деформации), спланировать ход оперативного вмешательства, определить форму, размер и размещение фиксирующей конструкции при проведении остеосинтеза, подобрать стандартный имплантат или изготовить индивидуальную конструкцию при проведении имплантации.
Постановка задачи
Целью работы является выбор и адаптация методов и алгоритмов, применяемых при решении задачи определения анатомо-топографических параметров кости для определения типа имплантата с целью построения трехмерной модели ЧЛО в разрабатываемой СКС, с учетом размеров и локализации имплантата.
Исходя из поставленной цели необходимо решить следующие задачи:
- определение подхода к построению сечения челюстно-лицевой области в месте определения анатомо-топографических параметров;
- создание алгоритма определения плотности костной ткани на построенном сечении для дальнейшего выбора параметров имплантируемой конструкции;
- выбор и описание метода получения длины и ширины кости в физических единицах измерения для выбора параметров имплантируемой конструкции;
- определение подхода к построению трехмерной модели участка определения анатомо-топографических параметров челюстно-лицевой области.
Методы и алгоритмы, используемые для решения поставленных задач
Результатом проведения операции СКТ является массив послойных срезов формата DICOM. Файл формата DICOM представляет собой набор тегов и значения пикселей, которые позволяют произвести визуализацию изображения.
Для определения необходимых параметров (ширины и высоты кости, а также плотности костной ткани) необходимо реализовать возможность построения сечения по всем снимкам, в предполагаемом месте установки имплантата. Место установки определяется врачом вручную, путем проведения на изображении снимка линии сечения. В результате построения сечения мы получим изображение, на котором требуемый участок челюсти будет отображен без искажений его формы и размеров.
Пример построения линии сечения приведен на рис. 1.
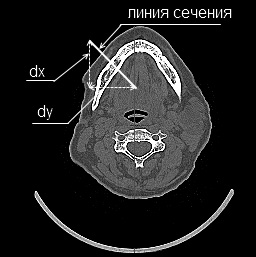
Рисунок 1 – Построение линии сечения (dx, dy – число пикселей соответствующих катетов в прямоугольном треугольнике).
Построение сечения снимков сводится к задаче создания изображения по промежуточным линиям. Каждая линия соответствует пикселям конкретного снимка КТ, а значения линий между снимками (неинформативные линии) заполняются значениями, соответствующими черному цвету.
Количество неинформативных линий на один срез можно рассчитать по формуле (1), исходя из информации (тэгов), которая содержится в каждом файле DICOM [4].

где К – количество неинформативных линий на срез;
D – физическое расстояние между срезами (тег (0018, 0088) – Spasing Between Slices);
T – толщина одного среза (тег (0018,0050) – Slice Thickness).
Соответственно высота полученного изображения сечения определяется по формуле (2).

где H – высота изображения в пикселях;
z – количество снимков, по которые строится сечения.
Ширина изображения сечения представляет собой длину проведенной линии, которая может быть рассмотрена как гипотенуза прямоугольного треугольника. Тогда число пикселей в линии определяется как максимальное из значений катетов (3).

где W – ширина изображения в пикселях;
dx, dy – число пикселей соответствующих катетов в прямоугольном треугольнике.
Далее на полученном изображении сечения определяются параметры, необходимые для выбора конкретного типа пластины или имплантата: ширина и высота кости, плотность костной ткани. Предварительно необходимо указать участок на изображении построенного сечения, внутри которого будут определяться указанные параметры.
Плотность костной ткани определяется в области, которая соответствует месту внедрения имплантата. Данная область может быть определена двумя способами: путем автоматического выделения и, если результат первого способа является неудовлетворительным, путем ручного выделения интересующего участка.
В качестве метода для автоматического выделения используем метод разрастания областей из семян [5]. Семена отмечают объекты, которые необходимо выделить. Области постепенно разрастаются, сравнивая все незанятые соседние пиксели с текущей областью.
В качестве меры схожести используется разность между яркостью пикселя и средней яркостью области. Пиксель с наименьшей такой разностью добавляется в соответствующую область. Процесс продолжается пока все пиксели не будут добавлены в один из регионов. В нашем случае зерном является любой из пикселей, принадлежащих выбранному участку кости. Выбор начального местоположения зерна определяется пользователем. В большинстве случаев данный метод используется для обнаружения всех объектов на изображении.
Для рассматриваемой задачи необходимо модифицировать алгоритм: если после просмотра всех ближайших соседей текущего пикселя ни один из них нельзя отнести к объекту, прекратить продвижение в данном направлении.
Результат применения операции сегментации приведен на рис 2.

Рисунок 2 – Выделение объекта на изображении: а) исходное изображение, б) изображение после выделения объекта и отсечения пикселей, не принадлежащих объекту.
Далее осуществляется проход по всем пикселям, принадлежащим информативным линиям, внутри полученной области и находится сумма их значений. Полученная сумма делится на число просуммированных пикселей, таким образом, находится среднее арифметическое значений яркости пикселей выделенной области.
Плотность костной ткани выражается в единицах шкалы Хаунсфилда [6], для перевода в которую полученное среднее значение яркости пикселей области необходимо пересчитать по формуле (4).

где HU – значение в единицах Хаунсфилда;
PV – среднее значение яркости пикселей области;
Slope – (тег (0028, 1053) – Rescale Slope);
Intercept - (тег (0028, 1052) – Rescale Intercept).
Для определения высоты и ширины кости необходимо получить значение проведенной пользователем линии в физических единицах длины. Соответственно, необходимо рассчитать физический размеров пикселя (ширины и высоты).
Высота и ширина пикселя изображения сечения в физических единицах длины могут быть рассчитаны, как отношение реальной высоты/ширины построенного среза массива снимков СКТ, к числу пикселей, которые используются для отображения высоты/ширины сечения массива снимков (5).

где RSizePix – реальный размер пикселя сечения (высота или ширина);
RLength - реальный размер сечения (высота или ширина);
PixelNmb – размер сечения в пикселях (высота или ширина).
Тогда длина линии, которая определяет ширину или высоту кости рассчитывается по формуле (6):

где Length - реальная длина проведенной линии;
RSizeХ, RSizeY - физическая ширина и высота пикселя изображения среза;
dx, dy – число пикселей соответствующих катетов в прямоугольном треугольнике.
На основании описанных выше параметров, производится поиск наиболее подходящей имплантируемой конструкции (в зависимости от решаемой задачи это может быть как дентальный имплантат, так и титановая пластина для остеосинтеза) в базе имплантатов, входящей в состав разрабатываемой СКС.
Полученные параметры дают представление о локализации имплантируемой конструкции и пространственных размерах области ее установки, которые могут быть использованы при визуализации имплантата в трехмерной модели.
Область построения трехмерной модели в пространстве представляет собой параллелепипед, расположенный внутри другого, образованного полным массивом снимков текущего обследования пациента. Такой параллелепипед задается минимум двумя прямоугольниками, по одному на проекцию, которые задаются с помощью параметров: высоты (Height), ширины (Width) и длины (Length). Каждый из этих параметров может быть рассчитан по следующему принципу (7):

где X’- размер соответствующего ребра параллелепипеда (длина, ширина высота);
Х – размер соответствующего параметра имплантата;
h – расстояние, увеличивающее размер области в двух направлениях.
Эти прямоугольники связаны между собой размером одной из сторон, которая является общей гранью параллелепипеда, а также координатами по одному из направлений перемещения прямоугольника. Соответственно изменение координаты Y на горизонтальной проекции трансформируется в изменение координаты X на профильной проекции.
В качестве алгоритма построения трехмерной модели используется подход, предложенный в работе [7]. Для реализации поставленной задачи алгоритм был модифицирован. Так, вместо построения трехмерной модели с фиксированными параметрами исходных данных (ширина и длина изображения, число изображений в массиве снимков), создана модель с задаваемыми параметрами. Т.е. ширина и длина области изображения, участвующей в создании трехмерной модели, а также число таких изображений, задаются, исходя из значения определенных ранее параметров имплантации.
Пример задания участка построения трехмерной модели и его основные параметры показаны на рис. 3.
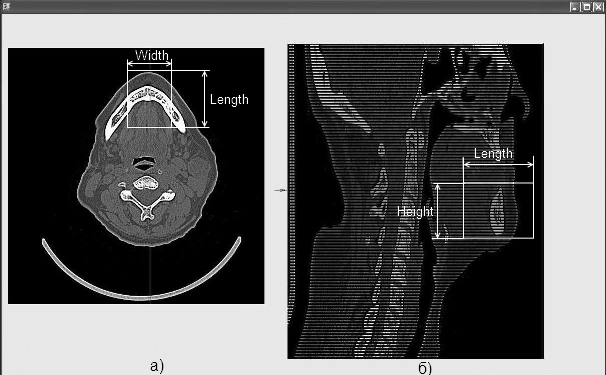
Рисунок 3 – Пример задания требуемой области на двух проекциях: а) исходный снимок (горизонтальная проекция) б) изображение сечения (вертикальная проекция).
Результат построения трехмерной модели участка челюстно-лицевой области приведен на рис. 4.

Рисунок 4 – Трехмерная модель нижней челюсти.
Результаты исследования.
Результаты применения метода определения плотности костной ткани (описанного ранее) сведены в таблицу 1.
| Пациент | Локализация сечения | Площадь области при автоматическом выделении (пкс) | Площадь области при ручном выделении (пкс) | Разница площадей при различных способах выделения (ручном и автоматическом) (%) | Плотность (Hounsfield) |
| Пациент 1 | Нижняя челюсть | 1850 | 1990 | 7 | 1990 |
| Пациент 2 | Нижняя челюсть | 2040 | 1940 | 5 | 1300 |
| Пациент 3 | Верхняя челюсть | 1340 | 1285 | 4,1 | 870 |
| Пациент 4 | Нижняя челюсть | 1805 | 1715 | 5 | 1200 |
| Пациент 5 | Нижняя челюсть | 970 | 920 | 5 | 1310 |
Разница между значениями площади выделенной области при автоматическом определении и ручном составила в среднем 5 %, что не оказывает решающего воздействия на величину значения плотности. Соответственно, рассмотренный алгоритм выделения области дает результаты, приемлемые для поставленной задачи.
Полученные значения плотности костной ткани по шкале Хаунсфилда согласуются с данными справочных источников [8], что дает возможность использовать предложенный алгоритм для поставленной задачи.
Построение трехмерной модели участка челюсти позволяет существенно снизить вычислительные затраты для данного этапа работы системы и, соответственно, уменьшить время построения трехмерной модели. Это достигается за счет того, что при обработке изображений осуществляется проход не по всем пикселям снимка, а лишь по пикселям выделенной прямоугольной области. Также на снижение вычислительных оказывает влияние то, что в построении трехмерной модели принимают участие не все изображения из массива снимков, а только те, которые входят в состав участка определения параметров имплантации.
Таблица 2 показывает результаты построения трехмерной модели всего массива снимков и трехмерной модели области определения параметров имплантации.
| Пациент | Область построения модели | Число снимков, шт | Размер области, пкс | Число полигонов, шт | Время создания, с |
| Пациент 1 | Весь массив снимков | 66 | 512х512 | 366672 | 66 |
| Выделенная область | 15 | 125х100 | 4500 | 2 | |
| Пациент 2 | Весь массив снимков | 65 | 512х512 | 359833 | 45 |
| Выделенная область | 20 | 110х110 | 4700 | 3 | |
| Пациент 3 | Весь массив снимков | 109 | 512х512 | 601780 | 51 |
| Выделенная область | 25 | 90х115 | 6300 | 4 | |
| Пациент 4 | Весь массив снимков | 130 | 512х512 | 728983 | 145 |
| Выделенная область | 35 | 105х80 | 500 | 6 | |
| Пациент 5 | Весь массив снимков | 62 | 512х512 | 344549 | 59 |
| Выделенная область | 19 | 70х80 | 2900 | 2 |
На рис. 5 показан сравнительный график результатов экспериментов.

Рисунок 5 – Графическое представление результатов экспериментов.
Выводы
Описанные в данной статье математические методы и алгоритмы помогут получить набор анатомо-топографических параметров (плотности, длины и ширины кости в месте повреждения), необходимых для работы СКС на этапе подготовки к хирургическому вмешательству.
Рассмотренный алгоритм построения трехмерной компьютерной модели проблемного участка ЧЛО с учетом размеров и локализации имплантата визуализирует результаты обработки данных пациента, которые передаются на рассмотрение врача для дальнейшего использования при проведении операции.
Результаты работы СКС предоставляют помощь в выборе типа и размеров дентального имплантата (титановой пластины), а также повышают точность позиционирования имплантата. Правильное определение указанных параметров снизит вероятность осложнений в послеоперационном периоде.
Список используемых источников
- Дентальная имплантация. Интернет-ресурс:http://www.mfs.dsmu.edu.ua/Implantaciya.html
- Травматические повреждения челюстно-лицевой области. Интернет-ресурс:http://www.mfs.dsmu.edu.ua/Travma.html
- Имплантация зубов и цифровые технологии. Интернет-ресурс: http://medici.ru/print/6605.html
- DICOM Standard. Интернет-ресурс:http://medical.nema.org/standard.html
- Gonzalez R. C., Woods R. E. Digital Image Processing. Prentice Hall 2002, pp. 813.
- Converting CT Data to Hounsfield Units. Интернет-ресурс:http://www.idlcoyote.com/fileio_tips/hounsfield.html
- В.Г. Адамов, К.В. Меркулова, О.Л. Толстих. Моделювання тривимірних об'єктів для збільшення ефективності проведення остеосинтезу // Вестник Херсонского государственного технического университета. – Херсон: ХГТУ, 2012. – № 1(44). – С. 323–331.
- Hounsfield scale. Интернет-ресурс:http://en.wikipedia.org/wiki/Hounsfield_scale