Прилипание и слипание: механизмы, техника измерений и методы восстановления
Автор:Бхарат Бхушен
Автор перевода:Митина Маргарита
Источник:Bharat Bhushan — Adhesion and stiction: Mechanisms, measurement techniques, and methods for reduction
Адгезия твердых тел происходит при контакте неровностей двух контактирующих твердых тел. Присутствующая на границе тонкая пленка жидкости при небольшом угле контакта, может привести к так называемой жидкой опосредованной адгезии. Это может привести к высокой адгезии при нормальной нарузке и большому статическому трению при скольжении, что обычно называют залипание
. Проблема высокой клейкости особенно важна при контакте двух очень гладких поверхностей в условиях небольшой нагрузки. В статье представлен критический и всеобъемлющий обзор механизмов адгезии и клейкости, различные методы измерения, и методы, используемые для уменьшения прилипания в магнитных запоминающих устройствах, а также в микро/наноэлектромеханических системах.
II. Механизмы в паре твердых тел и жидкой опосредованной адгезии
Когда две твердых поверхности сведены, может произойти объединение через прилипание или сцепление. Чтобы разделить эти два твердых тела и преодолеть адгезию требуется конечная нормальная сила; смотреть Рис. 4 [3,4]. Отношение нормальной растягивающей силы W', которая необходима для разделения (обычно известная как сила адгезии) к первоначально примененному нормальной усилию сжатия W, часто упоминается как коэффициент прилипания, μ'.
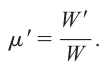
W' обычно увеличивается линейно с увеличением W, а μ'обычно возрастает с увеличением продолжительности статического контакта и скорости отрыва.
Адгезия происходит как в твердых соединениях, так и в соединениях с участием двух твердых тел с жидкостью или липким веществом между ними. Если две сплошные поверхности чистые и все химические пленки и адсорбаты удалены, то обычно возникает сильная адгезия или сцепление одного твердого тела с другим. Поверхностные примеси или тонкие пленки в большинстве случаев уменьшают адгезию; однако, в некоторых случаях происходит наоборот. У хорошо смазанных поверхностей, как правило адгезия проявляется слабо.
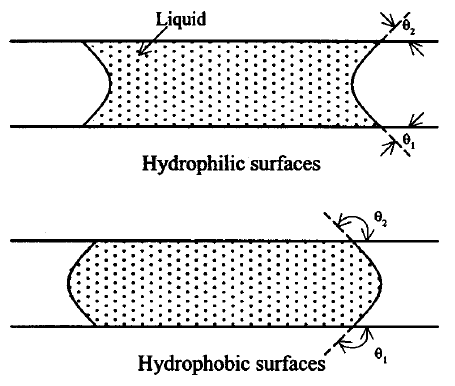
Рис. 1. Менисковое формирование тонкого слоя жидкости между двумя плоскими поверхностями.

Рис. 2. a) Схематическая иллюстрация тела, скользящего на горизонтальной поверхности, где W — нормальная нагрузка (усилие) и F — тангенциальная сила, которую испытывает тело; и (b) тангенциальная сила в зависимости от времени или смещения. Fstatic — сила, необходимая для начала скольжения и Fkinetic — сила, необходимая для поддержания скольжения.
Адгезия может быть желательной или нежелательной. Сильная адгезия необходима для соединения вместе двух поверхностей. Однако, во многих инженерных решениях, таких как рычаги и вращающиеся машины, адгезия является нежелательной. Результатом адгезии являются трение и износ. В некоторых устройствах контролируемая адгезия не требуется.
А. Контакт двух твердых тел
Близость микронеровностей приводит к адгезионному контакту, вызванному межатомными силами. Предположительно в природе адгезия бывает физической или химической [2-6,7,8,9,10,11-13]. Химическое взаимодействие включает ковалентные связи, ионные или электростатические связи, а также металлические связи. Физическое взаимодействие включает водородные связи и Ван–дер–Ваальсовы связи в результате межмолекулярных сил (вторичные силы притяжения). Водородные и Ван–дер–Ваальсовы связи намного более слабы, чем в молекулах, которые подвергаются химическому взаимодействию, потому что в этих связях нет никакого электронного обмена. Силы Ван–дер–Ваальса присутствуют всегда, когда две микронеровности находятся в непосредственной близости. При контакте двух твердых поверхностей граничная связь может быть более сильной, чем связующая сила в более слабом из двух материалов. В этом случае, разделение этих двух образцов приведет к передаче твердых частиц от материала с меньшей связующей силой к материалу с большей. Адгезия — функция материальной пары и состояния соединения, таких как кристаллическая структура, кристаллографическая ориентация, растворимость одного материала в другом, химическое взаимодействиедействие и разделение агрегатов, чистота поверхности, нормальная нагрузка, температура, продолжительность контакта (время покоя или время жизни), и уровень разделения [10, 14].

Рис. 3. Схематическая иллюстрация нормального отрыва двух твердых тел; W — нормальная сжимающая сила (нагрузка) действующая с определенной продолжительностью и W' — нормальная растягивающая сила, необходимая для разделения поверхностей.
Для чистых поверхностей, лишенных оксидной и других поверхностных пленок от адсорбированных газов, наблюдается значительная адгезия между металлическими поверхностями; такие условия могут быть достигнуты при сверхвысоком вакууме. Поверхностные пленки, образованные при физическом поглощении, хемосорбции, химических реакциях и от присутствия загрязнителей в среде, обычно уменьшают адгезию двух взаимодействующих поверхностей [10, 15-17]. В присутствии атмосферного воздуха даже благородные металлы адсорбируют кислород и водняной пар; эта пленка может быть толщиной не больее нескольких молекул. Небольшие количества загрязнений могут более эффективно уменьшать адгезию одних металлов, чем других. Например, очень небольшое количество кислорода (достаточное, чтобы создать монослой) может прпривести к заметному уменьшению адгезии железа, тогда как намного больше кислорода требуется, чтобы произвести сопоставимое уменьшение адгезии меди [3, 4, 10].
Температура влияет на адгезивную силу контакта. При высоких температурах размягчение поверхностей приводит к большей текучести, податливости и увеличению реальной области контакта, что приводит к более сильной адгезии. Высокие температуры могут также привести к диффузии через поверхность. В контакте металл–металл, высокая температура может привести к увеличенной растворимости, а при контакте полимер–полимер, усиливается взаимная диффузия, которая приводит к более сильной адгезии.
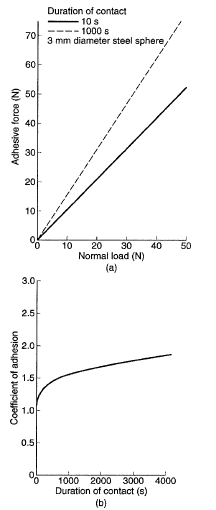
Рис. 4. (a) Сила адезии как функция от нормальной нагрузки и (b) коэффициент адгезии как функция от продолжительности контакта чистой стальной сферы на индии (См. 34).
Если две поверхности соприкачаются из–за поверхностной шероховатости, то реальная область контакта обычно значительно меньше, чем геометрическая. Адгезия зависит от реальной области контакта, которая является функцией нормальной нагрузки, поверхностной шероховатости и механических свойств [3, 4]. Сила адгезии, как правило, линейно возрастает с увеличением нормальной нагрузки; см. на Рис. 4(а) [18]. Материалы с более высокой шероховатостью, модуль эластичности и/или твердости и отсутствия податливости, показывают пониженную реальную область контакта, что приводит к уменьшению адгезии. Любая вязкоупругая или вязкопластичная деформация (сдвиг) при нагрузке увеличивает реальную область контакта как функция от продолжительности контакта, что приводит к увеличению адгезии; см. Рис. 4(b) [18, 19]. Реальная область контакта также может увеличиться в результате межатомного притяжения (Ван–дер–Ваальсовы или ВдВ силы) в случае мягкого тела, такого как эластомер, при контакте с твердой поверхностью, оба являются гладкими, то разделение микронеровности находится на молекулярном уровне (1–10 нм) [1]. Сначала контакт происходит на вершинах микронеровностей. Далее они приближаются в результате Ван–дер–Ваальсовых сил, при нормальном давлении порядка 1 атм, когда контакты микронеровности разделены на 1–10 нм. Этот процесс продолжается и может привести к очень большой площади контакта при отсутствии нормальной нагрузки (Рис. 5). Этот механизм также частично ответственен за свойства тонких полимерных пленок, таких как пищевая пленка. Конечно, этот механизм был бы недействительным для пары твердых материалов и/или грубых поверхностей.

Рис. 5. Схема, показывающая, как реальная область контакта между гладким эластомером и гладкой твердой поверхностью увеличивается до размеров большей части геометрической области.
Другое явление в реальной области контакта — эластичное восстановление. Когда нормальная сила уменьшается для двух поверхностей в близком контакте, контакт частично разорван эластичными силами в процессе, известном как эластичное восстановление; посмотрите Рис. 6 [16]. Более низкий модуль упругости привел бы к менее эластичному восстановлению и наоборот. Податливость также играет роль: чем больше податливость, тем большее удлинение контактов и, как следствие, менее эластичное восстановление. Поэтому, эластичность и податливость влияет на реальную область, по которой происходит адгезия и влияет на адгезию и трение. Эластичное восстановление в большей степени ответственно за более низкую адгезию чистых поверхностей, чем теоретические значения.
Силы сцепления значительно увеличиваются, если смещение (сила) сдвига добавляется к нормальной нагрузке. Когда тангенциальная сила приложена к нагруженным металлическим экземплярам, происходит рост реальной области контакта пластичного слоя под влиянием объединенных, нормальных и тангенциальных напряжений [3, 4], и любое относительное скольжение может привести к проникновению поверхностных слоев, что в других условиях невозможно при контакте металла с металлом [14, 16]. Даже твердые металлы, подвергнутые скольжению или скручиванию при сжатии могут показать высокую степень адгезии.
Теперь мы обсудим различные физические и химические взаимодействия, ответственные за адгезию пары твердых тел.
1. Ковалентная связь
Ковалентная связь состоит из пары электронов (с противоположно вращающимися магнитными полями), которые совместно используются двумя атомами [3, 4, 19, 20]. Когда ковалентные твердые частицы находятся в близком контакте, следует ожидать, что связь через поверхность будет подобна связи внутри тела. У большинства ковалентных твердых частиц есть верхний предел модуля упругости, и они как правило чрезвычайно твердые. Следовательно, часто довольно трудно получить большие площади контакта, даже если используются заметные сжимающие нагрузки. Однако на молекулярном уровне гладкие поверхности могут обладать большой реальной областью связи, что приводит к большей адгезии.

Рис. 6. Схематическое изображение сферы на относительно плоской поверхности с применением нормальной силы и сила отрыва.
2. Ионная или электростатическая связь
Ионные связи обазуются каждый раз, когда один или несколько электронов передаются от одного атома к другому. Передача электронов приводит к формированию отрицательных и положительных ионов. Кулоновское притяжение, в отличие от ионого, приводит к формированию ионных связей [3, 4, 19, 20]. Металлы, которые обладают относительно малым притяжеием их валентных электронов, склонны создавать ионные связи при объединении с неметаллами. Когда разделение равняется расстоянию между атомами, тогда связь напоминает связь в объеме материала. Если полимер (изолятор) контактирует с металлом, то появляется намного большая разность зарядов на поверхности. Это приводит к появлению электростатического притяжения в дополнение к Ван–дер–Ваальсовому взаимодействию между телами [9, 21-24]. На основе подробных экспериментов с полимерами, Дерягин и др. [9] утверждают это практически вся адгезия электростатическая изначально.
Передача заряда происходит при контакте и разделении двух поверхностей. Определенные сочетания материалов, как правило это непроводящие материалы, получают электрический заряд при трении, скольжении. Этот эффект обычно упоминается как ‘‘трибоэлектрический эффект’’, и является главным источником генерации статического заряда. Будучи электрически заряженным, неважно, отрицательно или положительно, при контакте с разряженным объектом или объектом противоположной полярности, происходит электрический разряд, искра. Эти неуравновешенные статические заряды будут затухать со временем и не приведут к постоянной адгезии.
3. Металлическая связь
Валентные электроны металлов не связаные ни с каким конкретным атомом в теле и способные свободно дрейфовать в любом направлении через сплошной металл, называемый делокализованными электронами. Они формируют электронное море или электронное облака. Остальные невалентные электроны и атомарные ядра формируют ионные ядра, которые создают положительно заряженную сеть, равную по величине к общему количеству зарядов в валентном электроне на атом. Экран свободных электронов и положительные ионные ядра взаимно отталкиваются под действием электростатических сил. Металл можно рассмотреть как содержащий периодическую структуру положительных ионов, окруженную морем валентных электронов (отрицательных). Притяжение между ними образует металлическую связь [3, 4, 19, 20].
Говоря в общем, наиболее чистые металлы крепко сцепляются друг с другом. Для разделения больше, чем скажем 2 нм, они связаны силами Ван–дер–Ваальса, которые увеличиваются с уменьшением разрыва. При маленьком расстоянии разрыва начинает действовать металлическая связь. Когда поверхности находятся на атомарном расстоянии друг от друга, обычно установлена полная металлическая связь и отталкивающие силы на близком растоянии также входят в обеспечение заключительного равновесия между этими двумя телами. Если чистые идентичные металлы (такие как золото) прижаты друг к другу с силой, приведшей к пластической деформации в месте контакта, ожидаемо что каждый проявит граничную силу, сопоставимую с усилием в объеме металла, поэтому сила, требуемая для разделения двух поверхностей должна быть большой; однако, на это обращают мало внимания. Эффект освобожденого упругого напряжения, поверхностная шероховатость и уровень чистоты некоторые — причины меньшей силы адгезии, чем ожидалось. Податливость металлов важна, особенно если нагрузка достаточна, чтобы произвести пластическую деформацию. Адгезия податливых материалов, таких как индий, свинец, медь и золото обычно более сильная, чем менее ковких металлов, например, гексагональных металлов с небольшим количеством систем скольжения и керамики.
Самоадгезию широкого диапазона металлов, можно распределить в довольно четко определенные группы в зависимости от структуры; например логично, что гексагональные металлы формируют плохо прилегающую группу. В частности кобальтовые выставки проявляют заметно более низкие силы сцепления, когда контактируют сами с собой. Как правило, подобные металлические пары с негексагональными структурами металлургически совместимы и показывают высокую адгезию, поэтому необходимо их избегать, особенно контакта железа с железом [3, 4, 25].
Направление поверхности оказывает влияние на адгезию. Так в плоскости при контакте с похожей плоскостью, проявляются более высокие силы адгезии, чем при контакте разнородных кристаллографических плоскостей того же металла с самим собой. Самая низкая сила адгезии обнаруживается при плотной упаковке, высокой плотности атомов и низкой энергии плоскости свободной поверхности. Поликристаллическая форма металла в контакте с самим собой демонстрирует более высокие силы слипания, чем монокристаллов в контакте с собой; это отражает влияние энергий на границах зерен.
В случае разнородных металлов, взаимная растворимость металлов повлияет на адгезию; взаимно нерастворимые металлы, как правило, демонстрируют плохую адгезию [25-27]. Тем не менее, если поверхности тщательно очистить, независимо от взаимной растворимости, адгезия усилится. Однако не всегда передача происходит от мягкого металла к твердому. В некоторых сплавах предпочтительна сегрегация одного из компонентов, которая происходит на свободной поверхности.
4. Водородная связь
Водород может существовать как в виде положительно заряженных, так и в виде отрицательно заряженных ионов. Положительный ион водорода или протон, является результатом удаления единственного электрона. Отрицательный ион, с другой стороны, формируется в следствии несовершенного экранирования положительно заряженного ядра и попадания одного электрона в нейтральный атом. Это несовершенная защита приводит к постоянному изменению диполя, который имеет слабую тенденцию приобретать еще один электрон в следствии чисто ионного притяжения. Это свойство атома водорода позволяет ему объединять два отрицательных иона, что в свою очередь известно как водородная связь [3, 4, 6, 19, 20]. Он играет важную роль в адгезии с полимерами, если присутствуют определенные полярные атомы способные продуцировать водородные связи. Водородные связи или мосты водорода являются сильнейшими вторичными силами притяжения.
Гидрофильные поверхности кремнезема в MEMS содержат адсорбированные слои воды. Когда две из этих гидратированных поверхностей вступают в тесный контакт, водородные связи могут образовывать между атомами кислородом и водорода из адсорбированного слоя воды. Водородные связи эффективно используются при склеивании сургучем.
5. Связь Ван–дер–Ваальса
Первые три типа связи, упомянутые до сих пор, являются относительно сильными первичными связями, которые следуют из водородных связей. Более слабыми, вторичными связями, которые также приводят к межатомному притяжению, являются силы Ван дер Ваальса. Они действуют между молекулами или внутри молекул с атомами, среди которыми химические связи не образуется [3, 4, 6, 19, 20]. Для полярных молекул они возникают во взаимодействиях диполь–диполь. Для неполярные молекул они возникают в результате взаимодействия колеблющихся диполей отдельных атомов (силы Лондона). Для двух параллельных поверхностей, которые находятся на расстоянии d, сила на единицу площади составит
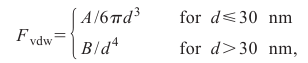
где А и В постоянные Гамакера. Для чисто Ван–дер–Ваальсовых тел, А составляет порядка 10-12 эрг (1 эрг = 10-7 Дж), что справедливо для большинства углеводородов. Это уравнение можно использовать вплоть до контакта атомов [28].
Существование сил Ван–дер–Ваальса между макроскопическими телами, такими как скрещенные цилиндры из слюды, было обнаружено рядом исследователей [6, 29]. Влияние шероховатости поверхности на силы Ван–дер–Ваальса изучали Мерадудин и Мазур [30]. На основании расчетов, они обнаружили, что шероховатость поверхности увеличивает величину сил Ван–дер–Ваальса в сравнении с значением для двух гладких поверхностей.
Перечень ссылок
- B. Bhushan, B.S. Sharma, and R.L. Bradshaw, ASLE Trans. 27,33 (1984).
- B. Bhushan, Tribology and Mechanics of Magnetic Storage Devices,2nd ed. (Springer, New York, 1996).
- B. Bhushan, Principles and Applications of Tribology (Wiley, New York, 1999).
- B. Bhushan, Introduction to Tribology (Wiley, New York, 2002).
- A.W. Adamson, Physical Chemistry of Surfaces, 5th ed. (Wiley, New York, 1990).
- J.N. Israelachvili, Intermolecular and Surface Forces, 2nd ed. (Academic, San Diego, 1992).
- J.J. Bikerman, The Science of Adhesive Joints (Academic, New York, 1961).
- R. Houwink and G. Salomon, Adhesion and Adhesives, 2nd ed. (Elsevier, Amsterdam, 1967).
- B.V. Derjaguin, N.A. Krotova, and V.P. Smilga, Adhesion of Solids (translated from Russian by R. K. Johnston) (Consultants Bureau, New York, 1978).
- D.H. Buckley, Surface Effects in Adhesion, Friction, Wear and Lubrication (Elsevier, Amsterdam, 1981).
- W.A. Zisman, Ind. Eng. Chem. 55,19 (1963).
- J. Mahanty and B.W. Ninham, Dispersion Forces (Academic, New York, 1976).
- Anonymous, Mater. Sci. Eng. 83,169 (1986).
- M. Sikorski, Trans. ASME D 85, 279 (1963).
- L.F. Cofin, Lubr. Eng. 50 (1956).
- F.P. Bowden and G.W. Rowe, Proc. R. Soc. London, Ser. A 233, 429 (1956).
- K.I. Johnson and D.V. Keller, J. Appl. Phys. 38, 1896 (1967).
- J.S. McFarlane and D. Tabor, Proc. R. Soc. London, Ser. A 202, 224 (1950).
- W.D. Callister, Materials Science and Engineering—An Introduction,5th ed. (Wiley, New York, 1999).
- M. Hein and S. Arena, Foundations of College Chemistry, 10th ed. (Wiley, New York, 2003).
- A. Johnsen and K. Rahbek, J. Inst. Electr. Eng. 61, 713 (1923).
- S.M. Skinner, R.L. Savage, and J.E. Rutzler, J. Appl. Phys. 24, 438 (1953).
- D.K. Davies, J. Phys. D 6, 1017 (1973).
- A. Wahlin and G. Backstrom, J. Appl. Phys. 45,2058 (1974).
- E. Rabinowicz, Friction and Wear of Materials, 2nd ed. (Wiley, New York, 1995).
- D.V. Keller, Wear 6,353 (1963).
- D.V. Keller, J. Adhes. 4,83 (1972).
- P. Richmond and B.W. Ninham, J. Low Temp. Phys. 5, 177 (1971).
- B.V. Derjaguin, N.V. Chugrev, and J. M. Muller, Surface Forces (Consultants Bureau, New York, 1987).
- A.A. Meradudin and P. Mazur, Phys. Rev. 22, 1684 (1980).