Аннотация
Збыковский А. Е., Адамов В. Г. Исследование методов оценки жизнеспособности кератиноцитов. Выполнен анализ методов оценки жизнеспособности кератиноцитов. Выбран метод обработки изображений. Также выбран метод получения изображения инвариантного к масштабированию и углу наклона камеры.
Ключевые слова: методы обработки изображений, определение жизнеспособности, кератиноциты.
Постановка проблемы. Лечение трудно заживающих ран, язв и ожогов – одна из областей медицины, где достаточно давно и широко применяются и продолжают развиваться методы клеточной терапии.
В 1975 году было предложено применение культивируемых клеток кожи (кератиноцитов) при лечении ожогов. Кератиноциты – клетки, из которых состоит самый верхний, постоянно обновляющийся слой кожи – эпидермис. Чаще всего используется аутотрансплантация – т. е. у пациента берут маленький кусочек кожи, из него выделяют кератиноциты, выращивают их в культуре и закрывают полученным пластом раневую поверхность. Трансплантация выращенных эпидермальных пластов является одним из наиболее сложных и ответственных этапов технологии лечения, от правильного выполнения которой зачастую зависят результаты лечения.
Ниже приведены основные причины неудачных трансплантаций эпителиальных пластов [3]:
- недостаточная готовность пластов к пластике. Оптимальным является пласт, состоящий из 8–12 слоев клеток. Преждевременная или поздняя пересадка малоэффективны;
- пересадка незрелого (молодого) пласта. Как правило, поверхность культурального флакона зарастает клетками неравномерно. Обработка диспазой такой культуры приводит к неравномерному снятию пласта, с дырками. Эффективность такой трансплантации невысокая;
- трансплантация перезрелого клеточного пласта. При наличии большого количества слоев клеток нарушается питание кератиноцитов базального слоя.
Образование клеточного пласта происходит в следующей последовательности: прикрепление и распластывание клеток, усиленное деление, формирование колоний и слияние колоний между собой на поверхности культурального флакона.
Одним из условий успешного приживления многослойного пласта кератиноцитов является их своевременная трансплантация на раны. Регулярный контроль жизнеспособности культивируемого пласта, поможет своевременно заметить возможные отклонения и принять решение о сохранении качественного фрагмента пласта или засевании матраса новой культурой. Проблема заключается в том, что несвоевременное освобождение матрасов от заведомо некачественных культур ведёт к потере значительных финансовых средств, а главное времени, которое зачастую является решающим фактором при лечении больных с обширными повреждениями кожного покрова. Количество оборудования для выращивания кератиноцитов, как правило, ограничено, а материал для пересадки, который нельзя сделать про запас, зачастую необходим в большом количестве и в сжатые сроки, например во время техногенных катастроф, которые распространены в нашей стране.
Цель статьи – выбор метода оценки жизнеспособности кератиноцитов.
Постановка задачи. Важным этапом для проведения успешной операции, является определение жизнеспособности материала.
Определение жизнеспособности может проводиться различными методами. Наиболее простым является добавление специальных красителей, которые проникают внутрь клетки только при повреждении её оболочки. Таким образом, окрашенные клетки признаются не жизнеспособными. Естественно, краситель добавляется не в весь полученный материал, а только в его образец с последующим расчетом уровня жизнеспособности всех забранных клеток.
Более сложные методики оценки жизнеспособности сводятся к определению возможности клеток осуществлять свои функции [1]. Для этого в первичной культуре вычисляют уровень содержания специфических веществ, которые вырабатываются клетками в нормальном состоянии. Снижение концентрации этих веществ указывает на то, что внешне неповреждённая клетка может оказаться функционально неполноценной, то есть не пригодной для дальнейшего использования. К недостаткам этих методов причисляют временные затраты и субъективность получаемых результатов.
Проанализировав существующие методы определения жизнеспособности выращиваемых кератиноцитов, можно прийти к выводу, что они оказывают физическое воздействие на клетки. Для этого необходимо регулярно выделять часть (пусть и небольшую) выращиваемой культуры. Таким образом, появляется задача разработки метода, не оказывающего физического воздействия на клетки.
Решение задачи. Для решения задачи оценки жизнеспособности кератиноцитов была выбрана методика обработки их изображений, так как использование этой методики не требует физического воздействия на клетки.
Входными данными в разрабатываемой системе будут снимки матрасов с клетками размером 512×512 пикселей, полученные при помощи камеры, установленной на микроскопе. Пример снимка представлен на рис. 1.
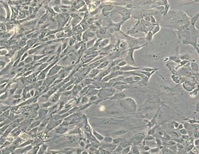
Рисунок 1 – Пример входных снимков
Далее должны быть получены его характерные признаки, которые можно будет использовать для классификации. Изображение слоя кератиноцитов имеет сложную текстуру. Также существует влияние оператора при получении снимков, так как микроскоп можно настроить на разный масштаб и повернуть его под разным углом. Поэтому существует потребность сделать изображение наклон‑ и масштаб‑инвариантным. Подобные задачи рассматривались в работе [2], при исследовании фибробластов. Для решения этой проблемы планируется исходное изображение подвергнуть лог‑полярному преобразованию.
Алгоритм лог‑полярного преобразования изображений кератиноцитов разделён на 2 основных этапа. На первом этапе радиус наибольшего круга (r) внутри данного изображения используется как сканирующая линия выборки (сэмплирования) S раз от 0° до 360° для получения эквивалентной S×[N/2] полярной формы (см. рис. 2a). Так, формально, полярная форма p(a, r) данного изображения f(x, y) размером N×N может быть вычислена как:
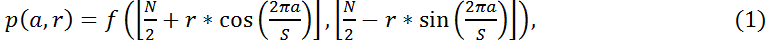
для a = 0, …, S – 1, и r = 0, …, [N/2] – 1.
На втором этапе логарифмическая функция применяется ко всем значениям радиуса в полярной форме, и их выходные величины квантуются на R состояний. Получаем лог‑полярное изображение размером S×R для заданного N×N изображения, как показано на рис. 2b.
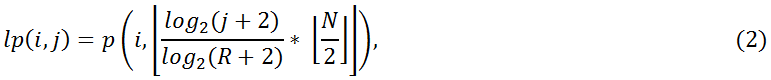
для i = 0, …, S – 1, и j = 0, …, R – 1.
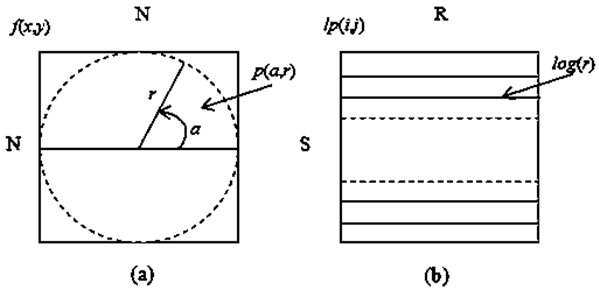
Рисунок 2 – Схематическое представление получения параметров для лог‑полярного преобразования: (а) – получение параметров полярной формы p(a, r), (b) – получение параметров лог‑полярного изображения
Далее из полученного лог‑полярного изображения планируется извлечь информативные признаки: удельную энергию и удельную энтропию. Для этого планируется использовать вейвлет преобразование.
Выводы. Был проведен анализ существующих методов оценки жизнеспособности кератиноцитов и обоснован метод обработки изображений. По результатам проведенных исследований был разработан алгоритм обработки изображений и определения информативных признаков с целью оценки жизнеспособности выращиваемых кератиноцитов. В дальнейшем планируется проведение машинных экспериментов с эталонными снимками кератиноцитов, с целью проверки эффективности выбранного метода.
- Смирнов С. В., Киселев И. В., Васильев А. В., Терских В. В. Современные методы клеточной терапии при лечении ожогов. [Текст]/ Смирнов С. В., Киселев И. В., Васильев А. В., Терских В. В. // Хирургия. Журнал им. Пирогова Н. И. – С. 25.
- Меркулова Е. В. Создание модели процесса определения жизнеспособности культивируемых фибробластов для автоматизированной системы. [Текст]/ Меркулова Е. В. // Вестник Херсонского Государственного технического университета. – Херсон: ХГТУ.– 2004 р. – № 1 (19).
- Клеточные технологии в лечении ран, язв и ожогов/ Интернет‑ресурс. – Режим доступа: http://www.cmbt.su/rus/cells/diseases/wounds_and_burns.html.