Введение.
Основной причиной хронических заболеваний верхних дыхательных путей является нарушение функции мерцательного эпителия с последующим развитием процессов, приводящих к повреждению слизистой оболочки. Трансплантация культуры клеток эпителия на повреждённую поверхность слизистой оболочки верхних дыхательных путей позволит добиться восстановления целостности и функции эпителиального покрова, тем самым предупредить рецидивирование и хронизацию заболеваний. В последние годы перспективным и быстроразвивающимся направлением в трансплантологии для восстановления утраченной структуры и функции повреждённых органов является использование клеточных культур и тканей. Исследования показали, что трансплантация лишь клеток отдельных органов и небольших фрагментов тканей в определённой степени может решить задачи органной пересадки. При этом удаётся избежать нежелательных эффектов, которые присущи трансплантации целых органов, а пересадка 3–5% клеток или тканей от объёма соответствующего органа могут полностью обеспечить его функцию [1, 2]. В настоящее время активно используются и разрабатываются методы клеточной терапии в кардиологии, коррекции нейродегенеративных заболеваний и травматических повреждений с использованием трансплантации стволовых клеток и клеток предшественников [3]. Наиболее широкое практическое применение получили культуры клеток эпидермиса для восстановления кожного покрова ожоговых больных [4, 5, 6, 7]. Используя культивируемый эпителий удавалось путём поэтапной имплантации восстановить до 50% эпидермиса при ожогах 90% всей поверхности тела [4]. Современные клеточные технологии для восстановления кожного покрова основаны на выращивании в культуре эпителиальных пластов кератиноцитов или фибробластов для приготовления живых эквивалентов кожи и их трансплантации на поражённые участки кожи [6, 7]. Имеются данные по использованию аллогенных фибробластов в оториноларингологии [8]. В настоящее время разработаны технологии культивирования большинства клеток вне организма. Предложены питательные среды для их роста с использованием различных факторов роста: эпидермальный фактор роста, фактор роста тромбоцитов, фактор роста кератиноцитов и т. д. [9, 10, 11, 12, 13, 14]. Shaw и др. подробно описаны методики получения первичных и пассируемых культур клеток эпителиальной ткани, однако используемые способы требуют совершенствования, оптимизации. Исследования по культивированию эпителия слизистой оболочки верхних дыхательных путей не многочисленны и для избирательного роста эпителиальных клеток необходимо определение видовой специфичности клеток в культуре.
Цель исследования: оптимизация условий культивирования эпителиальных клеток слизистой оболочки гортани при использовании фактора роста кератиноцитов (KGF).
Материалы и методы.
Источником для получения культур эпителиальных клеток гортани явились 2 биопсийных образца слизистой гортани человека, полученные от пациентов разного возраста (19 и 40 лет). Образцы слизистой оболочки гортани получали из удаленных тканей (для гистологического исследования) во время хирургических вмешательств в асептических условиях. Образцы ткани помещались во флаконы с питательной средой ДМЕМ (Дульбекко модифицированная питательная среда Игла), содержащей антибиотики: гентамицин (150 мкг/мл) и амфотерицин Б (10 мкг/мл), тотчас же транспортировались в лабораторию, хранились при + 4 °С не более 4‑х часов.
Для отделения эпителия слизистой оболочки, образцы ткани подвергали обработке 0,25% раствором диспазы в течение 18–20 часов при + 4 °С. Затем отделяли поверхностный слой по линии базальной мембраны. Кусочки ткани эпителия слизистой оболочки измельчали на отдельные фрагменты, обрабатывали 0,25% раствором трипсина (Sigma, США) в течение 30 мин при + 37 °С. По истечении указанного времени флаконы извлекали из термостата, ферменты нейтрализовали добавлением 10% эмбриональной сыворотки. Полученные суспензии клеток пропускали через стерильные фильтры с диаметром пор 2007 мкм, затем клетки осаждали центрифугированием при 1200 об/мин в течение 10 минут. Осадки ресуспендировали в питательной среде ДМЕМ с 10% сыворотки и гентамицином – 50 мкг/мл. Количественный выход жизнеспособных клеток определяли при их окраске 0,5% раствором трипанового синего и подсчете в камере Горяева. Посевная доза клеток составляла 500 тысяч в 1 мл ростовой среды.
Культивирование клеток проводили в СО2‑инкубаторе при 37 °С. Смену среды осуществляли через каждые 3 дня. Наблюдение за ростом клеток проводили в течение 10–12 дней с использованием светового микроскопа.
В работе применяли Дульбекко модифицированную питательную среду Игла с низким содержанием Са2+ (0,05 мм), (Sigma, США). В качестве добавок к питательной среде использовали:
- KGF, 20 нг/мл (Stem Сеll Technologies, Канада).
- Эмбриональная сыворотка, 10% (Sigma, США).
Для культивирования эпителиальных клеток использовали пластиковые (полистирол) флаконы, с площадью ростовой поверхности 2 см2, обработанные коллагеном типа 1А и обладающие высокой адгезивной способностью, предназначенные для культивирования эпителиальных клеток (фирма Соstar, США).
В постановке прямого метода флуоресценции антител и метода проточной цитофлуориметрии использовали моноклональные антитела к альфа интегринам СD49f, меченные FITC (Stem Сеll Technologies, Канада).
Для анализа методом прямой иммунофлуоресценции и проточной цитофлуориметрии клетки в культуральной среде центрифугировали в пробирках 10 минут при 1200 об/мин, надосадок удаляли. Осадок ресуспендировали в форфатном буфере Дульбеко объёмом 200 мкл. К осадку в виде клеток дабавляли моноклональные антитела СD49f (Stem Сеll Technologies, Канада) и ставили на 30 минут в холодильник при + 2–4 °С. После контакта с антителами часть клеток исследовали в флуоресцентном микроскопе общепринятым методом. Другую часть клеток анализировали на проточном цитофлуориметре FacsCalibur (Becton Dickinson).
Результаты.
Для получения культуры обогащенной эпителиальными клетками, важным условием является подбор ростовой среды с факторами роста, которые стимулировали бы преимущественный рост эпителиальных клеток. С этой целью нами оценено влияния фактора роста кератиноцитов на эпителиальные клетки слизистой гортани в условиях культуры. При использовании в качестве питательной среды Дульбеко модифицированную среду Игла с низким содержанием кальция и магния и c 10% сывотки эмбрионов коров, а также добавлением KGF в дозе 20 нг/мл, обеспечивался интенсивный рост и пролиферация клеток. При этом небольшая часть диссоциированных клеток слизистой гортани адгезировалась и распластывалась на флаконе покрытом коллагеном типа 1, остальные клетки образовывали пролиферирующие колонии (конгламераты) клеток в суспензии. Количество колоний клеток увеличивалось и достигало своего максимального количества на 7–14 день. Для длительного поддержания в культуре и накопления их биомассы, клетки рассевались в соотношении 1:2 с добавлением свежей ростовой среды, содержащей KGF в той же дозе. Культивирование клеток и наблюдение за ними проводили в течение 2,5‑х месяцев с 5‑ю пересевами (пассажами). Индекс пролиферации клеток (отношение количества выросших клеток к посеянным) составлял от 2 до 3. Морфологический анализ клеток в динамики роста культур выявил постоянство их фенотипов, при использования ростовой среды, содержащей KGF.
Как видно из данных, представленных на рисунке 1, конгломераты клеток представлены однотипными или находящимися в стадии деления округлыми клетками, являющимися предшественники эпителиальных клеток, которые способны к размножению. Единичные клетки или группы адгезированных клеток представлены несколькими фенотипами – дифференцированными клетками, имеющими крупные размеры, кубовидной или полигональной формы, с небольшим центрально расположенным ядром (рис. 1, 2). Выявлено, что крупных размеров кубовидной формы клетки содержат вакуоли и по всей вероятности принадлежат к секреторным клеткам, продуцирующим муцин (рис. 12).
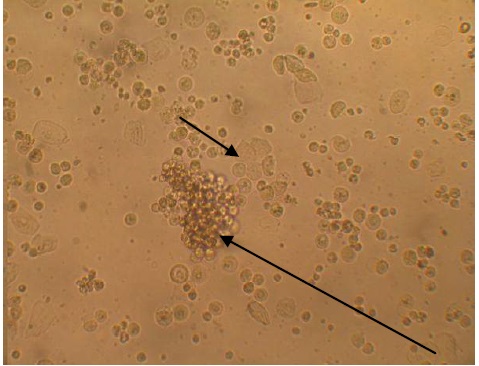
Рисунок 1 – Морфология культуры клеток эпителия гортани человека. 7‑й день культивирования; длинная стрелка – колония пролиферирующих клеток‑предшественников; короткая стрелка – группа эпителиальных клеток в стадии терминальной дифференцировки. Световая микроскопия живой культуры, увеличение 200×
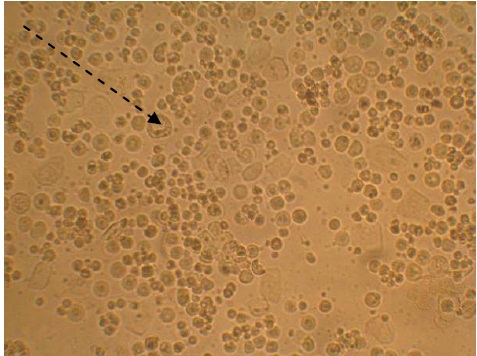
Рисунок 2 – Морфология культуры клеток эпителия гортани человека. 14‑й день культивирования; прерывистая стрелка – секреторные клетки. Световая микроскопия живой культуры, увеличение 200×
Фибробластоподобных клеток визуально не выявлено. Для установления природы клеток проведено их фенотипирование с использованием моноклональных антител к альфа интегринам (СD49f). С использованием метода флуоресцирующих антител нами было установлена экспрессия рецептора альфа- интегрина на поверхности культивируемых клеток. Как видно из рисунка 3, клетки в разной степени экспрессируют данный маркер, что выражается интенсивностью свечения клеток. Отмечено небольшое содержание маркера или полное его отсутствие в дифференцированных, адгезированных и распластанных клетках полигональной формы, что подтверждает их переход в терминальную стадию дифференцировки. Небольших размеров округлые клетки, одиночные или в составе кластеров, имеют ярко выраженное свечение, что свидетельствует об их принадлежности к стволовым и клеткам предшественникам эпителиальных клеток.
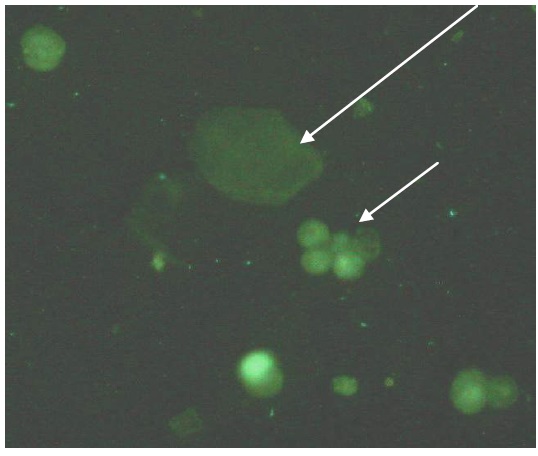
Рисунок 3 – Экспрессия молекулы CD49f на поверхности эпителиальных клеток слизистой оболочки гортани. Длинная стрелка – эпителиальные клетки в стадии терминальной дифференцировки; Короткая стрелка – колония пролиферирующих клеток‑предшественников; Люминисцентаная микроскопия, прямой метод флуоресцирующих антител, увеличение 400×
Методом проточной цитофлуориметрии был проведен количественный анализ клеток, экспрессирующих маркер CD49f. Как видно из цитограммы светорассеяния клеток (рис. 4), культура представлена гетерогенной популяцией клеток. Для последующего анализа, в цитограмме было выделено 3 области (R1, R2 и R3), соответственно размеру клеток. В каждой из областей клетки анализировались и высчитывался процент клеток экспрессирующих молекулы адгезии CD49f. Как видно из цитограммы флюоресценции в координатах FL1 и FL2 (рис. 5) наблюдается высокая степень экспрессии данного маркера на поверхности эпителиальных клеток. Среднее значение количества клеток экспрессирующих маркер CD49f составляет 96%.
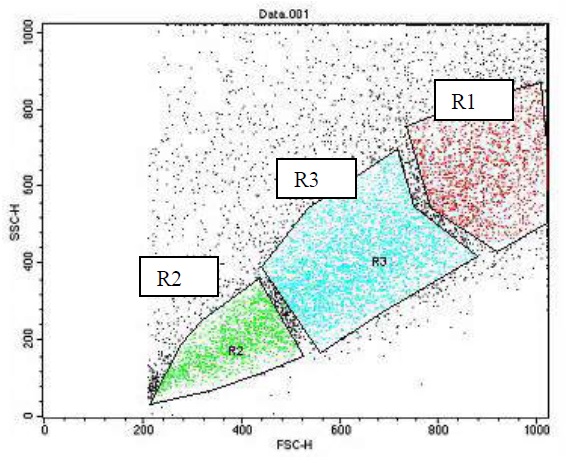
Рисунок 4 – Цитограмма светорассеяния эпителиальных клеток слизистой гортани в культуре (14 дней роста in vitro). Метод проточной цитофлуориметрии
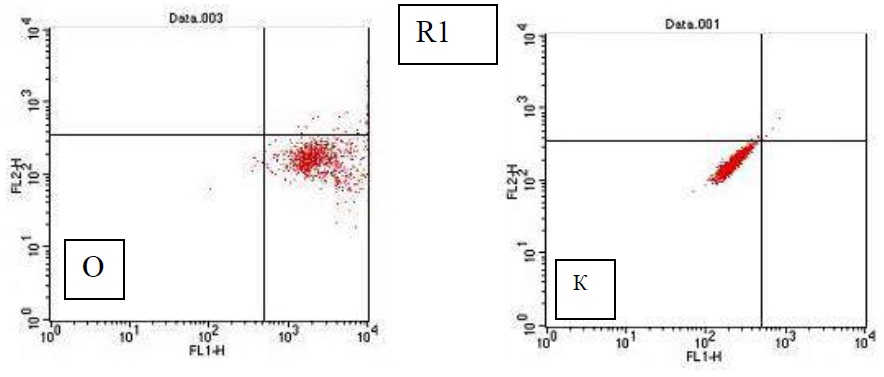
Рисунок 5 – Цитограммы флюоресценции в координатах FL1 и FL2 эпителиальных клеток слизистой гортани в культуре области R1 (14 дней роста in vitro). К – контроль, О – опыт. Метод проточной цитофлуориметрии
Заключение.
Таким образом, полученные результаты позволяют сделать следующие выводы:
- Клетки слизистой оболочки гортани имеют рецепторы к фактору роста кератиноцитов, который стимулируют их пролиферацию и их накопление в условиях культуры.
- Фенотипический состав полученных в культуре эпителиальных клеток с использованием моноклональных антител CD49F выявил их гетерогенный состав: клетки предшественники эпителиальных клеток (с высокой прлиферативной активностью) формируют колонии, обладающие адгезией к субстрату и продуцирующие муцин.
- Разработанные условия культивирования обеспечивают накопление биомассы клеток, которые в течение 10–14 дней обеспечивают прирост в 2–3 раза.
Дальнейшие исследования позволят изучить возможность применения данной культуры клеток в эксперименте и клинической практике.
Список литературы:
- Грищенко В. И. Клеточная и тканевая трансплантация // Лiкування та дiагностика. – 2001. – № 3. – С. 14–18.
- Трансплантация продуктов эмбриофетоплацентарного комплекса в оториноларингологии: первые итоги и перспективы / А. С. Журавлёв, Е. В. Пущина, М. В. Калашник, Альмашни Зияд // Журн. вушних, носових i горлових хвороб. – 2003. – № 3.– С. 27–31.
- Пыко И. В. Мезенхимальные стволовые клетки костного мозга: свойства, функции, возможности использования в регенеративной и восстановительной терапии / И. В. Пыко, С. В. Корень, З. Б. Квачева, А. С. Федулов // Медицинский журнал. – 2007. – № 4 – С. 18–22.
- Грин Г. Использование культур клеток для лечения болезней // В мире науки.– 1992.– № 1.– С. 52–59.
- Терских В. В. Эпидермальные кератиноциты человека и животных: Проблемы культивирования и трансплантации / В. В. Терских, А. В. Васильев. – М.: Наука, 1995. – 104 с.
- Малахов С. Ф., Парамонов Б. А., Емельянов А. В., Васильев А. В., Терских В. В.Новые подходы к лечению тяжелых ожогов: трансплантация выращенных в культуре кератиноцитов // Военно‑медицинский журнал,– 1997, – Том 318– № 9, – стр. 16–19.
- Туманов В. П. Лечение ожоговых ран при использовании культивированных клеток кожи человека // Педиатрия.– 1999. – 5.7 – С. 52–59.
- Проблемы применения аллотрансплантатов в оториноларингологической практике / Д. А. Затолока, Т. А. Путилина, А. С. Затолока, В. В. Батов // Клинико‑лабораторные аспекты метаболической терапии: Сб. ст. II Респ. конф. – Витебск, 1999. – С. 165–167.
- Иммобилизованные клетки и ферменты. Методы: Пер. с англ. / Под ред. Дж. Вудворда.– М.: Мир, 1988. – 215 с.
- Культура животных клеток. Методы: Пер. с англ. / Под ред. Р. Фрешни.– М.: Мир, 1989. – 333 с.
- Epithelial cell culture. A Practical Approach / Edited by A.J. Shaw.– Oxford University Press, 1996. – 218 s.
- Li A., Simmons P. J., Kaur P. Identification and isolation of candidate human keratinocyte stem cells based on cell surface phenotype // Proc. Natl. Acad. Sci. USA. – 1998. – Vol. 95, – P. 3902–3907.
- Peter H. Michelson. Keratinocyte growth factor stimulates bronchial epithelial cell proliferation in vitro and in vivo / Peter H. Michelson, Margaret Tigue, Ralph J. Panos, Peter H. S. Sporn // Am.&Physiol Lang Cell Mol. – 2007. – Vol.277, – P. 737–742.
- Robinson C. B. Culture of Conducting Airway Epithelial Cells in Serum‑Free Medium / C. B. Robinson, R. Wu // J. Tiss. Cult. Meth– 1991. – Vol. 13. – P 95–102.