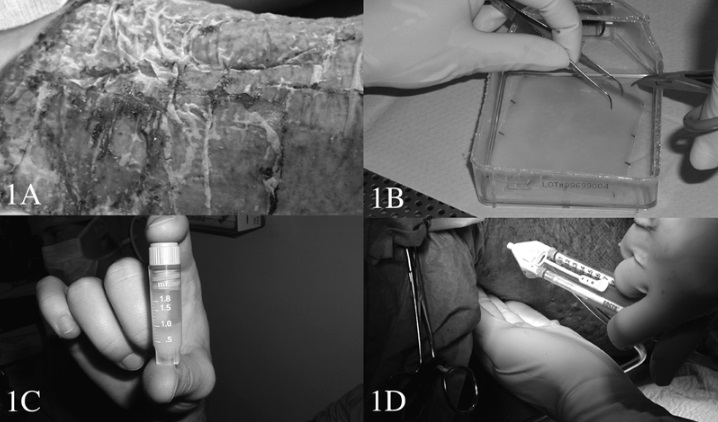
Рисунок 1 – A – Пересадка пласта, выращенного на подложке. Фото сделано через пять дней после трансплантации; B – Освобождение пласта от подложки; C – Флакон для хранения культивируемых кератиноцитов; D – Трансплантация клеток с помощью шприца.
Авторы: Camilla Fredriksson, Gunnar Kratz and Fredrik Huss
Перевод: Збыковский А. Е.
Источник: Трансплантация культивированных человеческих кератиноцитов в суспензии отдельных клеток
Аннотация
Трансплантации культивированных кератиноцитов, проведенная в суспензии отдельных клеток полезна в лечении ожогов. Сокращение времени, необходимое для культивирования, а также тот факт, что кератиноциты в виде суспензии можно транспортировать из лаборатории к пациенту в небольших флаконах, делает его привлекательным. Мы нашли несколько опубликованных данных в литературе о выживании клеток после трансплантации кератиноцитов в суспензию, а также сравнительное исследование, учитывающие распространенные способы применения. Первичные кератиноциты человека были пересажены в пробирку стандартным образом и с использованием различных методов. Кератиноциты были подсчитаны до и после трансплантации. Выживаемость клеток варьировалась в диапазоне от 47% до 90%, в зависимости от методики. Однако дальнейшие анализы показали, что различия в численности уменьшились после 8 дней культивирования.
Введение
Искусственно выращенные кератиноциты используются уже более 20 лет для лечения ожогов и других повреждений кожи. В 1975 году Рейнвальд и Грин предложили надежный метод культивирования клеток эпидермиса человека. Культивированные эпидермальные пласты пересаживаются на поврежденную поверхность кожи (рис. 1А). Выращивание таких пластов кератиноцитов требует очень много материальных и физических затрат, что ограничивает их использование. Толщина пласта составляет всего 8–10 слоев клеток, что делает его хрупким и трудно транспортабельным. Это означает, что он должен быть размещен на поддерживающей подложке, чтобы можно было легко транспортировать его из лаборатории к пациенту (рис. 1В). Если пласт был отделен от культурального сосуда, он должен быть пересажен в тот же день. Это значит, что рана должна быть подготовлена к пересадке немедленно. Так как пересаженные пласты довольно неустойчивы и склонны к «пузырям», тщательный контроль необходим не только на этапе его созревания и пересадки, но и во время приживления и смены стерильных повязок. Производство слоистых трансплантатов неизбежно влечет некоторую степень созревания и дифференцировки, что снижает их способность к пролиферации, а это, в свою очередь, может повлиять на ранозаживляющий потенциал. Внешние факторы, включая подготовку раны, состояние питания и перевязки могут существенно влиять на итоговый успех операции.

Рисунок 1 – A – Пересадка пласта, выращенного на подложке. Фото сделано через пять дней после трансплантации; B – Освобождение пласта от подложки; C – Флакон для хранения культивируемых кератиноцитов; D – Трансплантация клеток с помощью шприца.
Изучение этих недостатков привели к прогрессивному развитию методов искусственного выращивания кожи и более широкому использованию суспензий отдельных клеток кератиноцитов, которые пересаживаются вместо пластов. В 1998 году, описан новый метод, в котором было использовано аэрозольное устройство для распыления эпителиальных клеток на раны у свиней. Было отмечено, что раны заживали быстреечем при пересадке пластов. Наварро и др. подтвердили это в своих опытах. Дополнительные преимущества трансплантации такого вида являются сокращение времени за счет того, что не требуется отделять пласты от колбы с культурой и пересаживать их на рану. Кератиноциты в суспензии могут быть перевезены из лаборатории к пациенту в нескольких маленьких флаконах (рис. 1С) и храниться (замороженными) в клинике до тех пор, пока пациент не будет готов к пересадке. Суспензии отдельных клеток кератиноцитов можно пересадить пациенту с на раневую поверхность с или без фибрина – клея (рис. 1D).
Материал и методы
Клеточная культура
Кератиноциты человека были изолированы и размножены в пробирке. Лоскуты кожи от хирургических отходов были переданы в лабораторию в марле, смоченной в физиологическом растворе. Кератиноциты были изолированы в течение 24 часов. Ткань выдерживали при + 8 °С до использования. Кожу промывали дважды в фосфатном буферном растворе (PBS) с антибиотиками и mycotics (50 МЕ/мл пенициллина, 50 мкг/мл стрептомицина). Подкожный жир был удален с помощью ножниц, а остальные ткани (дермы и эпидермиса) разрезали примерно на 2 части по 1 см и инкубировали в 15 мл (16,7 мг/мл, 1,04 ед/мл) диспазы® в течение 18 часов при + 8 °С. После инкубации эпидермис был снят с дермы с помощью плоскогубцев и помещен в раствор (0,02% ЭДТА (2 мл) и 0,25% трипсина (2 мл)). Ткань инкубировали в 37 °С при 95% влажности и 5% диоксида углерода в течение примерно 10–15 минут, в течение которых она была неоднократно извлечена из инкубатора и растерта в порошок с помощью пастеровской пипетки для диссоциации клеток. После инкубации и растирания, действие трипсина ингибируется для передачи клеточной суспензии в специальной среде (10 мл модифицированной Дульбекко среде Игла (DMEM), дополненной 10% фетальной телячьей сывороткой и пенициллином‑стрептомицина) и центрифугирования в течение 5 минут. Надосадочную жидкость была удалена, а клеточный осадок ресуспендировался в 15 мл культуральной среды и высевался в колбу 75 см2 (BD Falcon, Стокгольм, Швеция). Культуральная среда была использована для кератиноцитов с добавлением 200 μl/100 мл экстракта бычьего гипофиза, 3,3 μl/100 мл фактора роста эндотелия и пенициллин‑стрептомицина. Среду меняли через день на протяжении всего исследования. Когда слияние было достигнуто, первичная культура была разделена путем промывки культуры дважды 2 мл 0,02% ЭДТА, с последующим добавлением 0,02% ЭДТА/2 мл и 0,25% трипсина 2 мл и инкубирована в течение 10–15 минут. Эффект трипсина затем подавляется. Надосадочную жидкость удаляли, а клеточный осадок ресуспендировали в культуральной среде 12 мл и разделяли на три колбы с культурой по 75 см2. Клетки второго прохода были использованы в исследовании, а культуры инкубировали в 37 °C, 95% влажности и 5% диоксида углерода.