Аннотация
Был сформулирован новый механизм антиоксидантной активности бакминстерфуллерена C60, основанный на поглощении протонов и слабой разобщенности дыхания и фосфорилирования митохондрий. В настоящем исследовании мы подтверждаем эту гипотезу, используя компьютерное моделирование на основе функциональной теории плотности. Геропротекторная активность фуллерена значительно выше, чем у самых мощных нейтрализаторов активных форм кислорода. В этой работе предлагается, что C60 обладал способностью приобретать положительный заряд, поглощая несколько протонов, и этот комплекс мог проникать в митохондрии. Такой процесс обеспечивает легкое расцепление дыхания и фосфорилирования. Это, в свою очередь, приводит к снижению производства АФК.
Введение
Реактивные виды кислорода (АФК) способны вызывать окислительное повреждение ДНК, липидов и белков и, как известно, являются ключевыми регуляторами клеточной передачи сигналов. Несмотря на критику со стороны ряда исследователей [1], теория свободных радикалов занимает центральное место в современных биологических концепциях старения [2]. Способность замедлять старение характерна для многих антиоксидантов [3 – 5]. Хорошо известная способность свежих овощей, фруктов, красных вин и специй стимулировать продолжительность жизни во многом определяется наличием таких соединений, как депротонированные ксантоны [6], каротиноиды [7], антоцианы и пираноантоцианины [8], а также флавоноиды и терпеноиды [9]. Эти соединения обладают широким спектром оксирадикальной активности гашения, основанной на реакциях одноэлектронного переноса, переноса атома водорода, последовательного переноса электрона через протон, переноса протонной связью электронов, образования радикального аддукта и хелатирования железа [5, 9 – 13].
В недавнем исследовании Баати [14] показали, что пероральное введение суспензии фуллерена С60 в оливковом масле замедляет старение крыс. При этом медиана и максимальная продолжительность жизни увеличиваются примерно вдвое. Кроме того, было показано, что крысы, обработанные фуллереном C60, продемонстрировали высокую устойчивость к тетрахлорметану. Токсичность этого вещества опосредуется генерацией АФК [15]. В соответствии с этим фактом и результатами биохимических испытаний было высказано предположение, что фуллерен C60 обладает высокой антиоксидантной активностью в естественных условиях. Благодаря свободнорадикальной теории старения, высокоактивная антиоксидантная активность может быть основой уникальных антивозрастных (геропротекторных) свойств.
Известно, что фуллерен C60 способен инактивировать гидроксильные радикалы, присоединяясь к двойным связям [16]. Однако этот механизм не может объяснить достаточное (почти в два раза) увеличение продолжительности жизни крыс. Такого рода антиоксидантная активность также связана с природными фенольными антиоксидантами, которые не о бладают высокой активностью замедления старения [17]. Мы предполагаем, что существует дополнительный механизм, участвующий в антивозрастной активности фуллеренов. Дыхательная цепь, расположенная во внутренней митохондриальной мембране, является основным источником супероксидных анионных радикалов, которые приводят к каскаду других токсичных АФК. В связи с этим митохондриально–направленные антиоксиданты, такие как липофильные катионы (ионы Скулачева) с антиоксидантной нагрузкой [18], являются наиболее эффективными противовозрастными средствами (геропротекторами) среди синтетических соединений.
Аккумуляция ионов Скулачева в митохондриях основана на разнице трансмембранного потенциала, возникающей в результате активности цепи переноса электронов. Внешняя сторона внутренней мембраны митохондрий имеет положительный заряд, а внутренняя сторона имеет отрицательный заряд. Таким образом, липофильные катионы концентрируются в митохондриях с помощью сил электрического поля [18]. Липофильные свойства фуллерена С60 хорошо известны [19]. Кроме того, Вонг–Экабут с помощью молекулярно–динамического моделирования [20] показали, что фуллерен C60 способен проникать в мембрану и накапливаться в середине липидного бислоя. Однако при моделировании не учитывается возможное присутствие фуллеренового и/или мембранного заряда. Мы предполагаем, что фуллерен способен поглощать протоны и получать положительный заряд, что позволяет доставлять его в митохондрии. Таким образом, образование супероксидных анион–радикалов снижается за счет легкой разобщенности дыхания и фосфорилирования [21]. В настоящем исследовании мы проводим теоретический анализ способности фуллерена C60 приобретать положительный заряд и поглощать протоны, чтобы доказать, что предложенный механизм действительно может иметь место.
Методы
Все компьютерное моделирование проводилось в рамках теории функционала плотности (density functional theory, DFT) для решения уравнения Шредингера [22], которое ранее использовалось для исследования
антиоксидантов [23]. В настоящей работе использовался DFT, реализованный в коде ADF 2012 [24]. Первоначально от одного до семи протонов было размещено вне фуллерена, а затем
наиболее вероятная атомная конфигурация была найдена путем минимизации полной энергии системы в процессе оптимизации геометрии, то есть путем нахождения стабильной конфигурации
системы, которая соответствует минимум суммарной энергии. Для обменно–корреляционной части молекулярного потенциала использовалось общее градиентное приближение (GGA) в
формах GGA–BLYP [25] и GGA–BLYP–D3 [25, 26], но все окончательные результаты были получены с использованием потенциала GGA–BLYP. Основными наборами являются DZ (двойные–ζ) в
расчетах, включая молекулы воды вокруг C60 и TZP (тройные–ζ) в расчетах без учета молекул воды вокруг системы C60 плюс–протоны
.
Результаты
На первом этапе моделировалось взаимодействие между одиночным протоном и фуллереном. Протон располагался снаружи С60 над одним из пятиугольников на расстоянии около 1 Å от
плоскости пятиугольника. В результате протон переходит в фуллерен и, наконец, оказывается внутри фуллерена на расстоянии около 1,1 Å от ближайшего атома углерода (Рис. 1 (а)).
Затем в эту систему было добавлено больше протонов; некоторые из них были первоначально размещены над пятиугольниками, но большинство были помещены над шестиугольниками.
Первые два протона были расположены на максимально возможном расстоянии друг от друга. Все остальные были равномерно распределены вокруг фуллерена. Во всех случаях протоны
были поглощены
фуллереном, и так было до тех пор, пока седьмой протон не был добавлен в систему – он оттолкнулся от фуллерена. Таким образом, максимальное количество
протонов внутри фуллерена состоит из шести протонов (рис. 1 (б)).

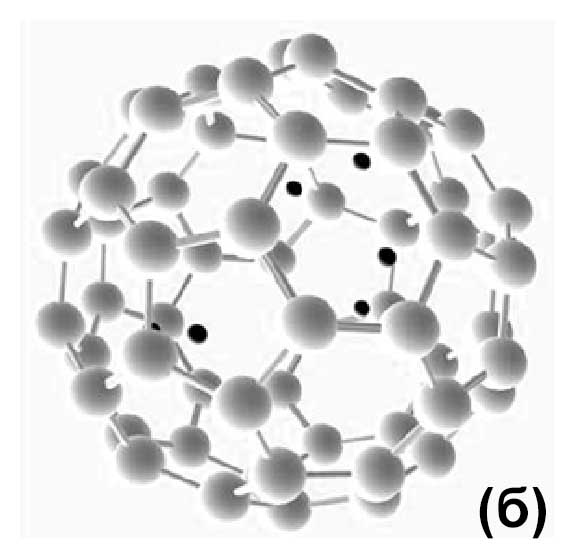
Рисунок 1 – Результаты оптимизации геометрии DFT для одного (а) и шести (б) протонов и фуллерена. Первоначально протоны были размещены вне фуллерена, а затем была найдена конфигурация с минимальным значением полной энергии в результате оптимизации геометрии DFT. В результате все протоны оказались внутри фуллерена. Для моделирования использовался обменно–корреляционный потенциал GGA–BLYP. Атомы углерода показаны серым цветом, а протоны – черным.
Очень важно знать распределение заряда по С60 для каждой конфигурации протонов. На рисунке 2 показано распределение для двух, четырех и шести протонов внутри фуллерена. Видно, что при наличии двух протонов на поверхности фуллерена практически нет заряда. При добавлении четырех–шести протонов поверхность фуллерена приобретает положительный заряд.
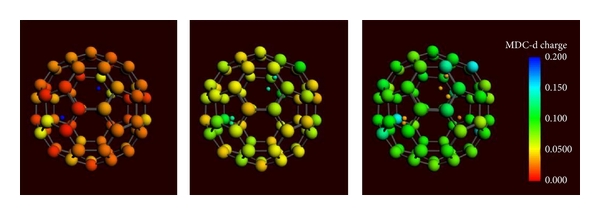
Рисунок 2 – Распределение заряда для двух, четырех и шести протонов внутри фуллерена. Заряд фуллерена с двумя протонами внутри равен нулю (красный цвет), в то время как фуллерены с четырьмя или шестью протонами внутри получают положительный заряд (зеленый и синий цвета). Протоны теряют свой положительный заряд, начиная с положительного заряда (синий цвет) до почти нулевого (оранжевый цвет).
В таблице 1 приведена информация об энергиях связи и зарядах VDD [27] для каждого протона, добавленного в систему. Как заряды на протонах, так и относительно большие расстояния C–H позволяют предположить, что протоны взаимодействуют с фуллереном по донорно–акцепторному механизму и не образуют прочных химических связей.
Таблица 1 – Энергии связи и заряды VDD для различных количеств протонов, добавляемых в фуллерен. |
|||||||||||||||||||||||||||||||||||||||
Важно знать, повлияет ли присутствие других молекул вблизи фуллерена на способность протонов проникать в фуллерен или нет. Для этого мы провели моделирование с участием молекул воды, которые наиболее распространены в организмах. Хотя известно, что в присутствии как протонов, так и воды появятся ионы гидроксония, молекулы воды могут быть выбраны. В такой среде происходит обмен протонов между ионами гидрония, поэтому в течение небольшого промежутка времени протоны свободны. Моделирование проводилось для фуллерена с одним протоном, расположенным над пятиугольником, и 47 молекулами воды, случайно распределенными вокруг фуллерена. Было показано, что молекулы растворителя не влияют на способность фуллерена поглощать протон. РассужденияСогласно нашей модели, фуллерен C60, накапливающийся в митохондриях, обеспечивает высокую активность по удалению радикалов в этом субклеточном
компартменте, названном Скулачевым Специфика, связанная с генерацией АФК митохондриями, связана с тем, что чем выше мембранный потенциал (чем больше разница в концентрации протонов внутри и снаружи митохондрий), тем выше уровень супероксидного аниона производство. Как было показано [29], существует крутая зависимость митохондриальной генерации супероксид–анион–радикалов от трансмембранного потенциала (Δψ). Даже небольшое (10–15%) снижение Δψ привело к десятикратному снижению скорости производства АФК. Поэтому так называемые мягкие разобщители окислительного фосфорилирования представляют собой вещества, которые могут перемещать некоторые протоны внутри митохондрий и могут обладать превосходным кислородозащитным эффектом, хотя они не являются антиоксидантами с точки зрения химии [19]. Моделирование DFT позволило нам предложить следующий механизм. Молекулы фуллерена С60 попадают в пространство между внутренней и наружной
мембранами митохондрий, где из–за диффузии образуется избыток протонов. В этом отсеке фуллерены загружаются протонами и приобретают положительный
заряд, распределенный по их поверхности. Такие ВыводыПредполагаемая способность фуллеренов С60 приобретать положительный заряд позволяет отнести их к митохондриально–направленным соединениям. Ключевая роль
митохондрий в клеточной регуляции делает такие Список литературы
1. P. Back, B. P. Braeckman, and F. Matthijssens, 2. A. Bratic andN. G. Larsson, 3. M. J. Jackson, 4. G. Nguyen and A. Torres, 5. D. M. Small, J. S. Coombes, N. Bennett, D. W. Johnson, and G. C. Gobe, 6. A. Martinez, E. Hernandez–Marin, and A. Galano, 7. E. Hernandez–Marin and A. Galano A, 8. S. Alcaro, S. G. C. hiodo, M. Leopoldini, and F. Ortuso, 9. M. Leopoldini,N. Russo, and M. Toscano, 10. J. R. Leon–Carmona and A. Galano, 11. A. Martinez, A. Galano, and R. Vargas, 12. A. Galano and A.Martinez, 13. M. Leopoldini,N. Russo, S. Chiodo, and M. Toscano, 14. T. Baati, F. Bourasset, N. Gharbi et al., 15. M. K. Manibusan, M. Odin, and D. A. Eastmond, 16. G. V. Andrievsky, V. I. Bruskov, A. A. Tykhomyrov, and S. V. Gudkov, 17. R. Banks, J. R. Speakman, and C. Selman, 18. M. V. Skulachev, Y. N. Antonenko, V. N. Anisimov et al., 19. Y. Xiao and M. R. Wiesner, 20. J. Wong–Ekkabut, S. Baoukina, W. Triampo, I.–M. Tang, D. P. Tieleman, and L. Monticelli, 21. S. S. Korshunov, V. P. Skulachev, and A. A. Starkov, 22. F. M. Bickelhaupt and E. J. Baerends, 23. E. R. Johnson and G. A. Dilabio, 24. G. te Velde, F. M. Bickelhaupt, E. J. Baerends et al., 25. S. Grimme, J. Antony, S. Ehrlich, and H. Krieg, 26. C. Lee, W. Yang, and R. G. Parr, 27. C. Fonseca Guerra, J.–W. Handgraaf, E. J. Baerends, and F. M. Bickelhaupt, 28. V. P. Skulachev, 29. F. F. Severin, I. I. Severina, Y. N. Antonenko et al., | |||||||||||||||||||||||||||||||||||||||