Флуоресценция хлорофилла: что это такое и что означают параметры
Gary A. Ritchie
Аннотация
Хотя результаты измерений флуоресценции хлорофилла (ФХ) в наземных растениях становятся широко освещаемыми в литературе, теория, терминология и интерпретация этих данных часто неясна и сбивают с толку на практике. В этой статье описаны лежащие в основе физиологические основы флуориметрии хлорофилла, а также обсуждаются протоколы измерений и само оборудование. Толкование флуоресценции хлорофилла объясняются с использованием ранее неопубликованных данных получено из саженцев питомника пихты Дугласа.
Введение
Оптимальное физиологическое качество саженцев имеет решающее значение для успешного восстановления, роста растения в первый год жизни и озеленения. Тестирование рассады – важный инструмент для обеспечения стабильного роста высококачественных саженцев, доставляемых для посадки на поля (Танака и др., 1997). Однако тестирование рассады не дёшево и требует много времени.
В течение многих лет учёные искали быстрый тест
на жизнеспособность саженцев – тест, который можно было бы выполнить быстро и легко, сразу же после влияния стрессовых факторов ‑ это укажет на уровень повреждения, нанесенного растению, и будет предсказывать последующую производительность. Одной из новых техник, разработанных с этой целью является измерение флуоресценции хлорофилла (ФХ).
ФХ является многообещающим параметром, поскольку отражает внутренние механизмы световой реакции фотосинтеза, которые очень чувствительны к стрессу (Krause and Weis 1991). Поскольку растения подвергаются разного рода стрессам (например, холод, повреждение питательными веществами, дефицит, болезни), их можно обнаружить, а иногда и диагностировать, анализируя флуоресцентное излучение, исходящее от хлорофилла а в Фотосистеме II (ФСII) световой реакции (например, Strand and Oquist 1988; Adams and Perkins 1993; Mohammed and others 1995 и ссылки, содержащиеся в нем). Кроме того, анализ ФХ является быстрым, неразрушающим и объективным.
Хотя эти методы были разработаны в 1930‑х годах (Govindje 1995), они не использовались при выращивании растений до недавнего времени из‑за высокой стоимости и не портативности необходимых инструментов. Пришествие микропроцессоров, миниатюризации передовых технологий, аккумуляторов, привели к разработке относительно недорогих, портативных флуориметров, способных выполнять сложные полевые измерения.
Цель работы: изложить информацию, касательно физиологических основ флуоресценции хлорофилла так, чтобы любой интересующийся, или человек которому предстоит столкнуться с этим на практике мог без труда разобраться в данных; предоставить базовые, сезонные и суточные ключевые параметры для нормальных
саженцев пихты Дугласа, которые можно использовать для интерпретации полученных результатов ФХ на практике.
Физиологические основы флуоресценции хлорофилла
Когда луч солнца попадает на лист, одна часть энергии отражается, другая передается через лист, а остаток поглощается листом. Чтобы избежать повреждений, лист должен каким‑то образом рассеять или использовать всю эту поглощенную энергию. Этот процесс называется энергетическим тушением
. Распознаются три конкурентных вида тушения. Первый тип называется фотохимическим тушением (qP), при котором световая энергия преобразуется в химическую, которая позже используется для стимуляции фотосинтеза. Так как растениям те для фотосинтеза часто требуется меньше количество света, по отношению к поглощенному, большая часть этой дополнительной энергии рассеивается в виде тепла. Это называется нефотохимическим тушением (qN). И наконец, небольшая, но важная часть избыточной энергии выделяется как флуоресцентное излучение молекул хлорофилла. Это называется тушением флуоресценции (qF).
Иногда при сильном освещении растение может быть не в состоянии погасить всю поглощенную энергию. Когда это происходит, избыток энергии питает биохимические реакции, которые вызывают свободные радикалы, такие как перекиси и другой токсичные виды кислорода. Растение производит антиоксиданты для очистки этих свободных радикалов и делают их безвредными. Однако эти системы улавливания свободных радикалов могут быть перегружены, в этом случае растение страдает от так называемого Фотоповреждения
(Демиг‑Адамс и Адамс, 2000). Иногда мы видим это в рассадниках. Хорошим примером будет цуга (Tsuga heterophylla), выращиваемая в теплицах, которая демонстрирует опаливание
иглы после пересадки в голый рассадник.
Световая энергия попадает в лист растения и улавливается
светособирающими пигментами (рисунок 1). В зависимости от длины волны захваченного света, он входит в одну из двух реакций центры, называемые Фотосистема I (PSI) и PSII, которые расположены на мембранах хлоропластов. Когда Хламолекула в ФС II поглощает фотон энергии, один из его электронов поднимается до более высокого энергетического состояния. Пока в этом состоянии захватывается пулом акцепторов электронов, из которого он направляется вниз по цепи переноса электронов в ФСI, где происходит аналогичный процесс (PSI и PSII названы в том порядке, в котором они были обнаружены, а не в порядке реакция). В PSI фотохимический процесс генерирует НАДФН, который обеспечивает энергию для превращения СО2 в сахар в так называемом цикле Кальвина
. Таким образом, световая реакция преобразует поглощенную световую энергию в накопленную химическую энергию.
Другой ключевой компонент световой реакции называется расщепление воды
. Чтобы восполнить потерянные электроны из Chla в PSII растение расщепляет молекулы воды, высвобождая атомы кислорода в атмосферу и создания электронов, которые поступают в PSII.
По одной из многих причин некоторые из возбужденных электроны из Chla в ФС II не захватываются бассейном акцепторов и распадаются обратно в свое основное состояние. Энергия теряется в этом процессе распада и испускается как флуоресцентный свет (тушение флуоресценции). Это показано на рисунке 1 в виде волнистой линия. Именно это излучение флуоресцентного света измеряется во флуоресценции хлорофилла.
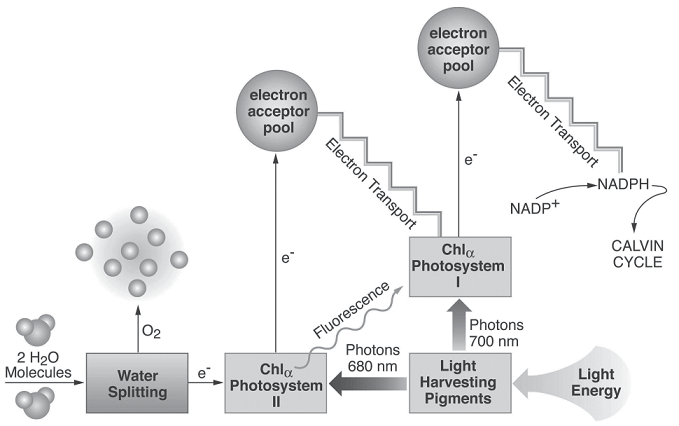
Рисунок 1 – Упрощенная диаграмма световой реакции
фотосинтеза. Флуоресценция хлорофилла, происходящая из хлорофилла в Фотосистеме II.
Измерение флуоресценции хлорофилла
Каутские флуорометры
Впервые о наблюдении флуоресценции хлорофилла сообщили Каутский и Хирш в 1931 году (Govindje 1995). Они акклиматизировали клетки растений к темноте в течение несколько минут, за это время от электронного транспорта освобождались все возбужденные электроны и акцепторный бассейн. Затем они облучали клетки короткими импульсами высокой интенсивности фотосинтетически активного света и следил за ростом и последующим падением флуоресцентного излучения с помощью чувствительного фотометра. Кривая, которую они в результате наблюдали, была похожа на кривую на рисунке 2. Эти наблюдения привели к развитию того, что сейчас известно как флуориметры Каутский
, которые генерируют кривые, аналогичные кривым на рисунке 2.
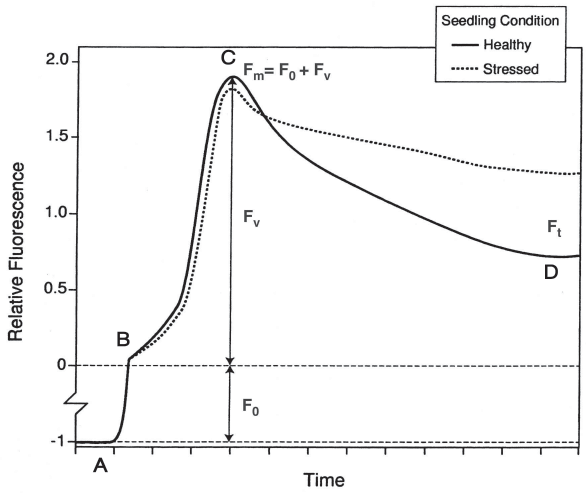
Рисунок 2 – Типичная кривая эмиссии хлорофилла для листа, снятая при помощи флуориметра Каутский
. А – активация светового импульса; B – выброс хлорофилла, когда все реакционные центры открыты; C – пик излучения; D – выброс, приближающийся к устойчивому состоянию. Fo – это флуоресценция, исходящая от светособирающего комплекса. Fm – максимальная флуоресценция. Fv, переменная флуоресценция = Fm – Fo. Ft – стабильная флуоресценция. Если лист
испытывает значительный стресс, скажем, из‑за повреждений от холода кривая эмиссии может напоминать верхнюю пунктирную линию.
На кривой Каутского
(рис. 2) выбросы возрастают до точки Fo, которая представляет собой флуоресценцию, при которой все реакционные центры открыты и qP максимально. Затем происходит резкий подъем к точке максимальной флуоресценции (Fm). Подъем от Fo до Fm называется переменной флуоресценцией
или Fv. Fm непостоянен, проделывая путь к заметному снижению, затем постепенно выравнивается до установившееся состояние, – Ft. Обратите внимание: когда растение находится под значительный стрессом, пик эмиссии не ослабевает в течение длительного периода времени. Это свидетельство того, что здоровые клетки не способны гасить
световую энергию убитых или поврежденных клеток.
Ключевое наблюдение было сделано Дженти и другими (1989). Они показали, что отношение Fv/Fm является прямой мерой Оптимальной квантовой эффективности
растения. Это очень важное свойство растения, показывающее, насколько эффективно идет световая реакция. Имеет теоретический максимум значение около 0,83. Многие исследования с использованием флуориметров типа Каутского сообщают об этой величине в первую очередь (например, Fisker and others 1995; Binder andFielder 1996; Перки и прочее 2001; Перки и прочее 2004 г.).
Амплитудно‑импульсная модуляция (PAM) флуориметры
В 1980‑е годы в Германии разработали новый флуориметр, называемый амплитудно‑импульсно модулируемым (ПАМ) флуориметром (Шрайбер и др., 1995). В этом приборе за начальным световым импульсом следует серия быстрых импульсов насыщающего света очень высокой интенсивности (до 6000 мкмоль/м2/с), которые подавляют пулы акцепторов, сводя на нет qP. Разница в эмиссии флуоресценции между пиками и кривой затухания флуоресценции, следовательно, равны qN. Это часто называют анализом тушения
, потому что он предоставляет отдельные оценки трех компонентов тушения. Оказалось, этот вид анализа мощный инструмент для оценки стрессов растений. Теоретически qP представляет собой более желательную
форму тушения, при которой световая энергия преобразуется в химическую энергию (рисунок 1). Напротив, qN можно рассматривать как резервное
тушение, или отвод избыточной энергии без выгоды для растения. Пока растения обычно полагаются на qP и qN для рассеивания энергии, когда они испытывают стресс, qP, как правило, остается относительно неизменным, тогда как qN имеет тенденцию к увеличению. Мы увидим примеры этого позже.
Оборудование – флуориметры обоих типов (Каутского и PAM) содержат аналогичные компоненты. К ним относятся источник света, два фильтра, фотодатчик и оптоволоконный кабель с прикрепленным листовым зажимом (рисунок 3). Устройство взаимодействует с ноутбуком. Перед измерением исследуемый лист затемняется на 20–30 минут. Зажим для листьев прикреплен к листу, источник света испускает сильный импульс, который распространяется сначала через фильтр, пропускающий фотосинтетически активное излучение, затем через кабель к створке. Флуоресцентный свет, излучаемый листом, проходит обратно по кабелю, через второй фильтр к фотодетектору, который измеряет его интенсивность в течение примерно 5 минут. Запись и расчеты параметров КФ производятся компьютером. Из этого анализа флуориметры Каутского дают значения, указанные в приложении 1A; Флуориметры ПАМ выдают эти же значения, плюс те, которые показаны в приложении 1B. Стоит заметить, что флуориметры Каутского не в состоянии оценить коэффициенты тушения, что сильно ограничивает их полезность.
Нормальные значения
параметров ФХ
Обсуждения с другими учеными, а также изучение литературы по ФХ привели к созданию таблицы 1. В ней приведены параметры, которые часто считаются нормальным
для параметров ФХ, показанных в приложении 1. Затем они будут использоваться в качестве шаблона для сравнения приведенных ниже значений пихты Дугласа.
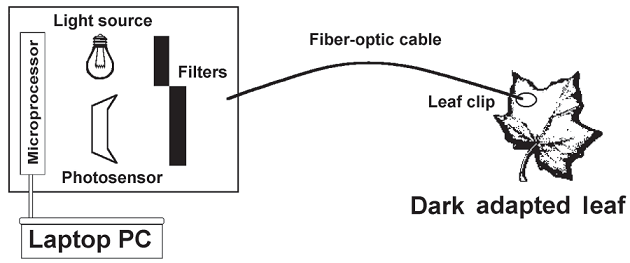
Рисунок 3 – Схема типичного флуориметра хлорофилла. Активный импульс, генерируемый источником света, распространяется к адаптированному к темноте листу по оптоволоконному кабелю. Эмиссия флуоресценции от листа возвращается через кабель к фотосенсору. Кривая выбросов и параметры выбросов генерируются микропроцессором. Прибор взаимодействует с портативным компьютером.
Таблица 1 – Нормальные значения
параметров ФХ в растениях, взятые из литературы и Mohammed (2005). См. Приложение для определения параметров.
| Параметр | Нормальноезначение |
Стрессовоезначение |
|---|---|---|
| Fo | 0.2 – 0.4 | > 0,7 указывает на низкое поглощение хлорофилла из‑за разрушения или изменения конфигурации хлорофилла. |
| Fm | 1.2 – 1.5 | - |
| Ft | Ft ~ Fo | малый Ft |
| Fv/Fm | примерно 0.70 – 0.83 | <0.6 |
| Y | 0.4 – 0.6 | 0.1 – 0.2 |
| qN | 0.4 – 0.6 | Затянувшиеся значения > 6.0 |
| qP | 0.7 – 0.8 | Затянувшиеся значения < 6.0 |
| ETR(in full sun) | <300 электронов мкмоль/m2/s | - |
Эмиссия ФХ здорового саженца пихты Дугласа
Весной 1997 года мы пересадили 1 + 0 саженцев пихты Дугласовой прямо из морозильника в рассадник на западе Вашингтона, где они выращивались как рабочая культура. Мы контролировали ФХ этих ростков на регулярной основе в течение 1 года выращивания с использованием PAM флуориметра. Температурные и световые условия также регистрировались в течение периода измерения.
Немедленное излучение флуоресценции после пересадки
Первое, что мы отметили, это то, что саженцы оправились от хранения в морозильной камере довольно быстро. Fo, Fm и Fv/Fm стабилизировались в течение 3 дней (рисунок 4). Во время посадки Fо варьировал от 0,2 до 0,4, что считается нормальным для большинства растений (таблица 1), тогда как Fm начинал с низкого, но сразу же поднимался в пределах своего нормального диапазона (приблизительно от 1,2 до 1,5) и остался там. Fv/Fm началось примерно с 0,60, но поднялось до почти 0,80 в течение 1 дня так и осталось. Значение Fv/Fm 0,60 было относительно низким (помните, что оптимум – 0,83), но вероятно, недостаточно низким, чтобы указывать на значительный стресс.
Коэффициент тушения qP оставался в пределах примерно от 0,7 до 0,8 за период (рисунок 5). qN началось с очень низкого значения и резко увеличилось через 2 дня после посадки, ненадолго превысив qP. Затем он постепенно снижался, пока примерно через 2 недели не достиг стабильного состояние около 0,5, что находится в пределах нормы. Этот предполагает, что некоторые ферменты, необходимые для одной из qN реакций могли ухудшиться при хранении в замороженном состоянии, но были возобновлены через несколько дней после посадки. Позднее, летом qN повысилось до уровня qP по мере увеличения интенсивности полуденного света.
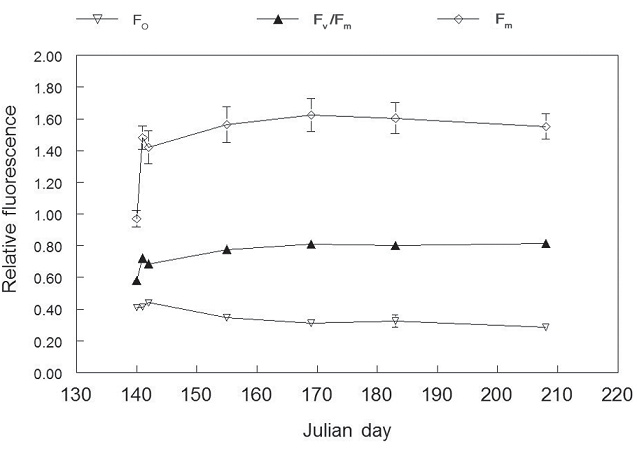
Рисунок 4 – Fo, Fm и Fv/Fm однолетних саженцев пихты Дугласа сразу после их удаления из замороженное хранение и пересадка в рассадник (Julian Day 140). Каждая точка данных представляет среднее значение ±1 SE для девяти саженцев
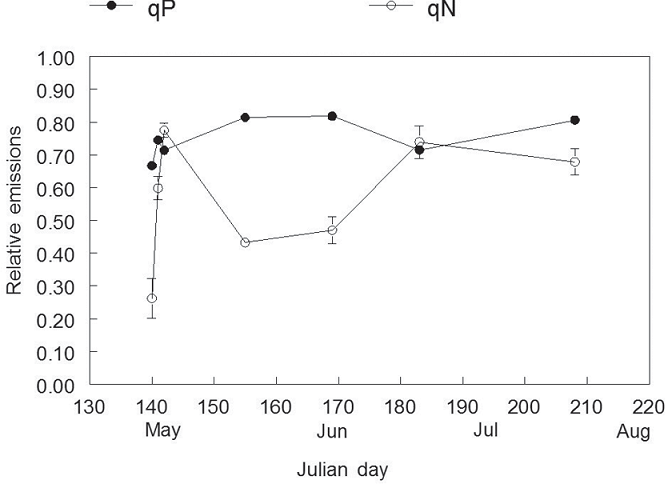
Рисунок 5 – Коэффициенты гашения qP и qN для однолетних саженцев пихты Дугласа сразу после их удаление из замороженного хранилища и пересадка в рассадник (Julian Day 140). Каждая точка данных представляет собой среднее значение ±1 SE для девяти ростков
Суточные показатели эмиссии флуоресценции
Суточные показатели ФХ различались между облачностью и солнечностью дней. Например, в прохладные пасмурные дни, когда прибывает фотосинтетически активная радиация (ФАР) не превышала 200 мкмоль/м2/сек (при ярком солнечном свете около 2000 мкмоль/м2/сек), Fv / Fm и qP оставалось около 0,80 весь день, в то время как qN оставалось ниже 0,6 (рисунок 6). Это говорит о том, что при низкой интенсивности света фотохимическое тушение израсходовало
большую часть поступающей световой энергии, поэтому растению не приходилось сильно полагаться на qN для рассеивания энергии. Напротив, в яркий солнечный день (полуденный PAR = 1800 мкмоль/м2/сек), а Fv / Fm и qP осталась около 0,80, qN резко выросла, превысив qP(рисунок 7). Объяснение здесь таково, что qP был насыщенный, так что резервное гашение было вызвано, чтобы помочь рассеивать лишнюю энергию. Небольшие понижения Fv / Fm и qP ближе к вечеру также указывает на небольшой стресс.
Коэффициенты гашения являются очень чувствительным индикатором напряжения (Lichtenthaler and Rinderle 1988); qP – относительно фиксированное свойство, медленно меняющееся в ответ на свет. С другой стороны, qN податлев, меняющийся быстро по мере увеличения или уменьшения стресса. Это указывает на отличную чувствительность, с которой саженцы смогли быстро реагировать на быстрые изменения интенсивности света.
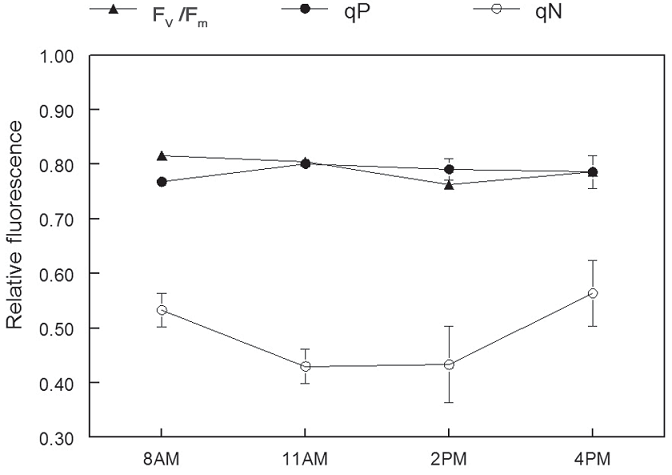
Рисунок 6 – Суточные показатели Fv/Fm, qP и qN для 2‑летних саженцев пихты Дугласовой в темный, пасмурный день. Каждая точка данных представляет собой среднее значение ± 1 SE для девяти ростков
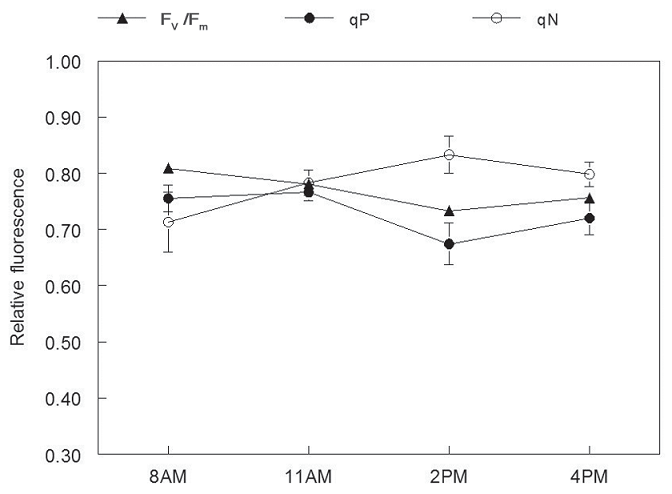
Рисунок 7 – Суточные показатели qP и qN для 2‑летних сеянцев пихты Дугласа в яркий солнечный день. Каждая точка данных представляет собой среднее значение ±1 SE для девяти саженцев
Реакция на холодную погоду – в самом начале исследования, мы надеялись на зимний арктический фронт, который заметно влияют на рассаду, так чтобы их реакцию на такое событие можно было пронаблюдать. К сожалению (или к счастью), во время очень мягкой зимы 1997–1998 годов этого не случилось. Произошел только один холодный снежный эпизод в течение недели с 7 по 15 января (рисунок 8).
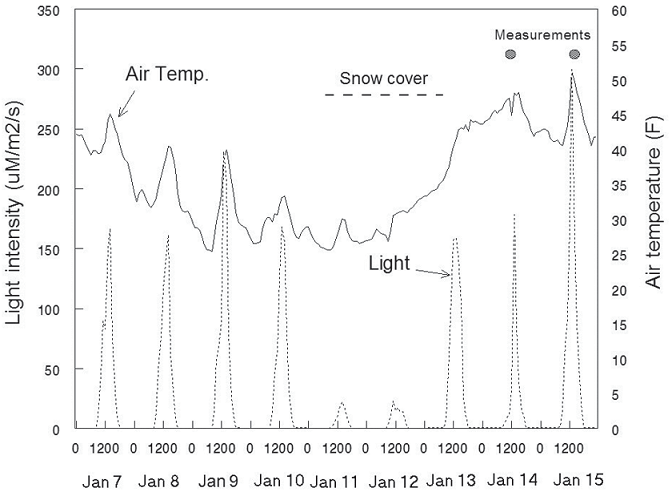
Рисунок 8 – Запись температуры воздуха, силы света и снежного покрова для холодного периода в январь 1998 г. Саженцы ели Дугласа были засыпаны снегом с 11 по 13 января. Крупные точки указывают время измерения выбросов ФХ на этих ростках.
Ночью 9 января температура стала опускаться ниже нуля и оставались ниже нуля четыре ночи подряд. С 10 по 11 января выпало несколько дюймов снега, блокируя почти весь свет от рассады. Снег растаял и температура начала подниматься до 40 °F (4 °C) 13 января. Показаны некоторые ключевые отклики ФХ на это событии в контексте общих сезонных моделей на рисунке 9.
После начальной фазы восстановления после пересадки Fv/Fm оставалась около 0,80 в течение года и не показывала каких либо последствий холодов; qP также остался высоким в течение года. Однако он показал резкое, но временное, снижение до 0,15 сразу после холодов. Напротив, qN значительно варьировалось, будучи относительно высоким в солнечные летние месяцы и ниже осенью, зимой и весной. Во время холодов, когда qP упало, qN резко увеличилось.
Низкие температуры, которые были во время холодов не были смертельными для саженцев пихты Дугласовой в то время года, для которых температура LT10 и LT50 составляет приблизительно –15 °C (5 °F) и –18 °C (–0,4 °F), соответственно (Ю. Танака, неопубликованные данные). Следовательно, значительный ущерб не ожидался. Имея это ввиду, предлагается следующее объяснение. Холод (возможно, в сочетании с 3 днями полной темноты под снегом) привел к легкому и кратковременный стрессу у ростков. Это проявилось как временное нарушение qP, которое было компенсировано резким увеличением qN. Этот стресс утих с возвращением к более светлым и теплым условиям, и параметры ФХ быстро вернулись к норме. Важным моментом является то, что Fv/Fm не отреагировал на это событие, что свидетельствует о его устойчивости и стабильности.
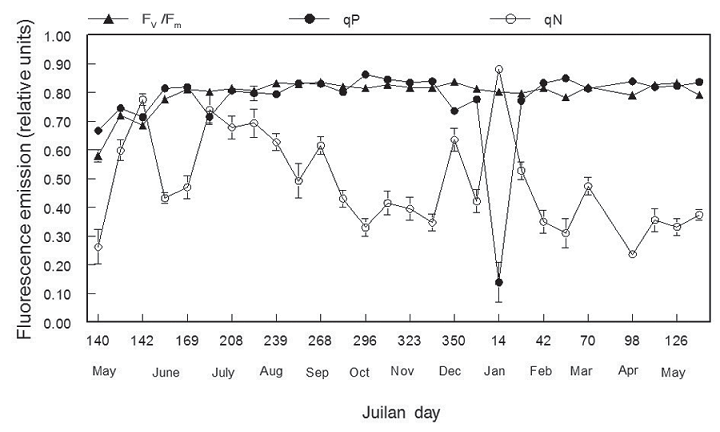
Рисунок 9 – Сезонные показатели Fv / Fm, qP и qN для саженцев дугласовой пихты, показывающий изменения в qP и qN сразу после холода в середине января (см. рисунок 8). Каждая точка данных представляет среднее значение ± 1 SE для девяти саженцев
Из‑за своей надежности Fv / Fm часто используется для количественной оценики ущерба от сильного замораживания. Пример этого взят из работы Перкс и др. (2004). Oни подвергали листву саженцев пихты Дугласовой ФХ‑анализу после воздействия отрицательных температур в феврале, начале и конце марта, и в апреле. В каждую дату отрицательные температуры понижали Fv/Fm с примерно 0,8 до ниже 0,4 (рисунок 10). Поскольку всходы продолжали отвердевать, значения Fv/Fm стали более восприимчивы к низким температурам. Например, воздействие температуры –20 ° C (–4 ° F) не повлияло на Fv / Fm в феврале, но в конце марта та же температура снизила Fv/Fm до 0,2. Авторы предполагают, что Fv/Fm после замораживания может обеспечить простое, быстрое и точное прогнозирование переносимости холода.
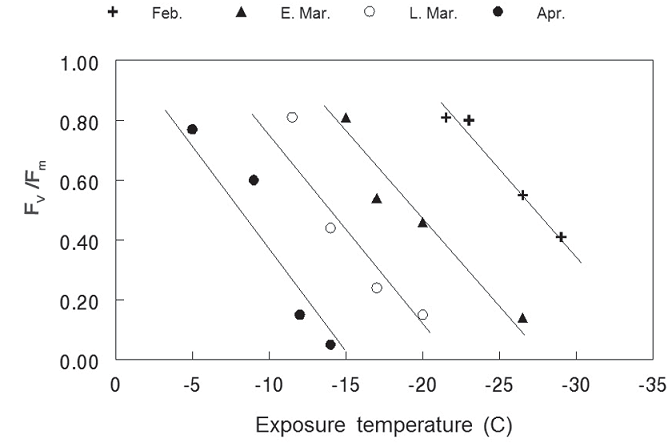
Рисунок 10 – Значения Fv / Fm, измеренные на пихте Дугласа после воздействия мороза в феврале, в начале и конце марта, и в апреле
Выводы
У растений выработались замысловатые механизмы рассеивания, или гашения, поглощенной ими световой энергии. Часть этой энергия используется в фотосинтезе (фотохимическое тушении, qP), а остаток рассеивается нефотохимически (qN) или в тушение флуоресценции (qF). Стресс, вызванный высокой и низкой температурой, болезнями, неправильным питанием и т. д. снижает способность растения управлять тушением энергии. Таким образом, измеряя и интерпретируя три компонента тушения с использованием флуоресценции хлорофилла (ФХ), можно обнаружить повреждения, вызванные тонкими, временными стрессами, а также длительным тяжелым стрессом. Три важных параметры ФХ, которые часто упоминаются в литературе – это qP, qN и Fv/Fm.
qP имеет нормальный диапазон от 0,7 до 0,8. Дневная изменчивость низкая, но сезонная изменчивость может быть от умеренной до высокой. qP часто падает во время или после стрессовых событий, но может быстро восстанавливаться, поскольку поврежденные ткани и реакции восстанавливаются растением.
qN имеет гораздо более широкий диапазон нормальных значений, варьирующийся от примерно 0,3 до 0,7. Суточная и сезонная изменчивость высока, поэтому qN очень чувствительный индикатор стресса. Очень легкие стрессы могут вызвать относительно большие изменения qN.
Fv / Fm (оптимальный квантовый выход) имеет нормальный диапазон от 0,7 до 0,8, является сезонно и суточно стабильным, и поэтому надежный индикатор повреждения растения. Только сильный стресс может вызвать значительное снижение Fv / Fm. По этой причине это часто используется для обнаружения серьезных повреждений от холода. Когда это значение падает ниже 0,6, это может быть поводом для беспокойства.
Поврежденные или подвергшиеся стрессу растения могут восстанавливаться быстро, поэтому важно измерять параметры ФХ на в течение нескольких дней после стрессовых событий чтобы сделать выводы о повреждении растений. Если Fv/Fm остается низким, а qN высоким в течение нескольких дней, это означает, что вероятно нанесен значительный ущерб фотосинтетической системе.
Приложение 1А – Параметры эмиссии флуоресценции хлорофилла, полученные с помощью флуориметра Каутский
.
| Параметр | Определение | Описание |
|---|---|---|
| Fo | Оригинальная флуоресценция | Флуоресценция, исходящая от светособирающих пигментов листа; обычно считается флуоресценцией фонового уровня, которая обнуляется при измерении флуоресценции хлорофилла ФСII. |
| Fv | Переменная флуоресценция | Высота пика флуоресценции над Fo после воздействия актиничного света пульс. |
| Ft | Флуоресценция в стабильном состоянии | Высота пика флуоресценции через 5 минут после окончания светового импульса. |
| Fm | Максимальная флуоресценция | Fv+Fo |
| Fv/Fm | Оптимальный квантовый выход | Оценка отношения молей связанного углерода на моль поглощенной световой энергии (Дженти и др., 1989); теоретическое максимальное значение для фотосинтеза C3 составляет примерно 0,830. |
Приложение 1B – Дополнительные параметры эмиссии ФХ, полученные с помощью PAM флуориметра.
| Параметр | Определение | Описание |
|---|---|---|
| qP | Фотохимическое тушение | Поглощенная световая энергия, которая рассеивается (гасится) потоком электронов в световой реакции |
| qN | Нефотохимическое тушение | Поглощенная световая энергия, которая в значительной степени рассеивается за счет ощутимой потери тепла и других нефотохимические механизмов |
| Y | Эффективный квантовый выход | Фактический квантовый выход в определенный момент времени; Y обычно намного ниже, чем оптимальный квантовый выход |
| ETR | Скорость переноса электронов | Эмпирическая оценка скорости потока электронов по пути электронного потока |
Ссылки
1. Adams GT, Perkins TD. 1993. Assessing cold tolerance in Picea
using chlorophyll fluorescence. Environmental and Experimental
Botany 33:377-382.
2. Binder WD, Fielder P. 1996. Chlorophyll fluorescence as an indicator
of frost hardiness in white spruce seedlings from different
latitudes. New Forests 11:233-253.
3. Demmig-Adams B, Adams WW III. 2000. Harvesting sunlight
safely. Nature 403:371-374.
4. Fisker SE, Rose R, Haase DL. 1995. Chlorophyll fluorescence as a
measure of cold hardiness and freezing stress in 1+1 Douglas-fir
seedlings. Forest Science 41:564-575.
5. Genty B, Briantais J-M, Baker NR. 1989. The relationship between
the quantum yield of photosynthetic electron transport and
quenching of chlorophyll fluorescence. Biochimica et Biophysica
Acta 990:87-92.
6. Govindjee. 1995. Sixty-three years since Kautsky: Chlorophylla
fluorescence. Australian Journal of Plant Physiology 22:131-160.
Krause GH, Weis E. 1991. Chlorophyll fluorescence and photosynthesis:
the basics. Annual Review of Plant Physiology 42:313-
349.
7. Lichtenthaler HK, Rinderle U. 1988. Chlorophyll fluorescence signatures
as vitality indicators in Forest decline research. In:
Lichtenthaler HK, editor. Applications of chlorophyll fluorescence.,
Dordrecht (Netherlands): Kluwer Academic. p 143-149.
8. Mohammed GH. 2005. Personal communication. Sault Ste Marie
(ON): Ontario Forest Research Institute. Retired.
9. Mohammed GH, Binder WD, Gilles SL. 1995. Chlorophyll fluorescence:
a review of its practical Forestry applications and instrumentation.
Scandinavian Journal of Forest Research 10:383-410.
10. Perks MP, Monaghan S, O’Reilly C, Mitchell DT. 2001. Chlorophyll
fluorescence characteristics, perFormance and survival of freshly
liFted and cold stored Douglas-fir seedlings. Annals of Forest
Science 58:225-235.
11. Perks MP, Osborne BA, Mitchell DT. 2004. Rapid predictions of cold
tolerance in Douglas-fir seedlings using chlorophyll fluorescence
aFter freezing. New Forests 28:49-62.
12. Schreiber U, Bilger W, Neubauer C. 1995. Chlorophyll fluorescence
as a nonintrusive indicator For rapid assessment of in vivo
photosynthesis. In: Schultze E-O, Caldwell MM, editors. Ecophysiology
of photosynthesis. Berlin, Heidelberg, New York:
Springer-Verlag. p 48-70.
13. Strand M, Oquist G. 1988. Effects of frost hardening, dehardening
and freezing stress on in vivo chlorophyll fluorescence of seedlings
of Scots pine (Pinus sylvestris L.). Plant, Cell and Environment
11:231-238.
14. Tanaka Y, Brotherton P, Hostetter S, Chapman D, Dyce S, Belanger
J, Duke S. 1997. The operational planting stock testing program
at Weyerhaeuser. New Forests 13:423-437.