Аннотация
Предложены адсорбенты диоксида серы на основе оксидов и карбонатов щелочноземельных металлов, модифицированных солями ще- лочных металлов. Установлен факт активации процесса хемосорбции и предложен вероятный механизм процесса.
Преимущественно загрязнение атмосферы оксидами серы происходит при сжигании нефти, угля, природного газа, древесины. Сера в составе топлива не является главной составной частью. Количество серосодержащих соединений в угле и нефти может меняться от долей до 5-6 % , а также зависит от типа его, и от места добычи. Сернистый ангидрид является продуктом сгорания топлива.[1]
Важными источниками диоксида серы также являются металлургическая промышленность и переработка полиметаллических руд. Металлы в рудах находятся преимущественно в форме сульфидов (сфалерит, пирит, цинковая обманка,галенит), значительно меньше их находится в форме сульфатов железа, магния, кальция. Сернистый ангидрид преобладает среди других газообразных соединений серы техногенного происхождения, по разным источникам, это превышение колеблется от 1,5 до 8 раз. Отходы некоторых заводов содержат 4-10 % диоксида серы.[2]
Было изучено влияние выбросов теплоэлектростанции на здоровье людей, проживающих в районах с различной интенсивностью загрязнения атмосферного воздуха. В результате чего было установлено наличие неблагоприятного влияния выбросов на санитарно-бытовые условия и здоровье населения в зоне задымления при максимальной концентрации SО2 в атмосфере 3,3-4,0 мг/м3 и пыли 2,5-4,6 мг/м3. Общее число жалоб и частота заболеваний верхних дыхательных путей по некоторым формам в этой зоне оказалась в два раза выше, чем в относительно чистом районе. В основной группе школьников (зона задымления) у большинства детей отмечено пониженное содержание гемоглобина, выявлено наличие SO2 в крови (от следов до 0,02 мг), высокая заболеваемость конъюнктивитами (13,3% по сравнению с 3,8% в контрольном районе).
В частности, вредное действие SО2 усиливается с возрастанием влажности воздуха и его запыленности.Исследования многих медицинских учреждении показали зависимость заболеваемости от загрязненности воздушного бассейна.Преобладающими оказались болезни органов дыхания. Установлены признаки хронической интоксикации двуокисью серы. [3]
Методы очистки газовых выбросов от SO2 принято разделять на «мокрые» и «сухие». Абсорбция диоксида серы с применением жидкой фазы осуществляется при сравнительно низких температурах.
Процессы, основанные на взаимодействии газа с твердой фазой, протекают обычно при высоких температурах. Для очистки дымовых газов от диоксида серы используют твердые хемосорбенты путем их введения в пылевидном состоянии в топки или газоходы теплоэнергетических агрегатов. В качестве хемосорбентов могут быть использованы известняк, доломит или известь. Для увеличения активности хемосорбентов вводят специальные добавки в виде неорганических солей. К сухим способам относится поглощение диоксида серы углеродными поглотителями (активные угли и полукоксы) при температуре (110 - 150) °С.[4]
В [5] предложены адсорбенты диоксида серы на основе оксидов и карбонатов щелочноземельных металлов, модифицированных солями щелочных металлов. Установлен факт активации процесса хемосорбции и предложен вероятный механизм процесса.
Цель данной работы состояла в разработке адсорбентов диоксида серы, работающих в широком интервале температур. В качестве объекта исследования были выбраны реакции SO2 с твердофазными системами, содержащими соединения щелочноземельных металлов активированные солями щелочных металлов.
В [6] установлено, что нитрат лития значительно ускоряет реакцию:
СаО + СО2 > СаСО3. (1)
По данным [6] причиной активации реакций в системе СаО - LiNO3 - СО2 является разупорядочивание кристаллической решетки нитрата лития с образованием ионов лития, которые проникают в кристаллическую решетку СаО и вызывают ее дестабилизацию. В таком состоянии окись кальция интенсивно присоединяет диоксид углерода (ІV) при температуре ~200 °С. Наиболее подвижен в такой разрыхленной решетке СаО ион кислорода, который легко образует карбонат-ион с СО2:
О2- + СО2 > СО22-
Таблица 1 - Температуры начала взаимодействия соединений щелочноземельных металлов с диоксидом серы.
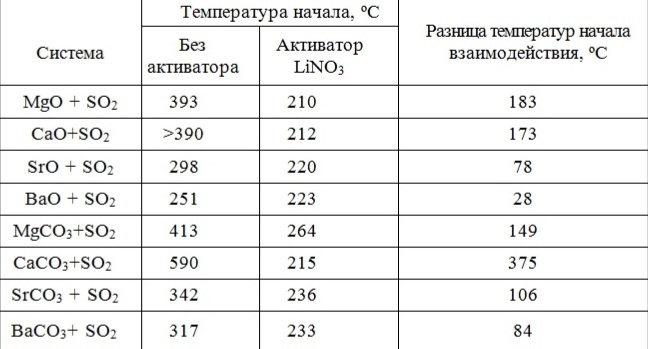
В [7] установлено, что нитрат лития может активировать также не только взаимодействие СаО с СO2, но и реакцию:
СаО + SО2 > CaSO3, (2)
Было установлено, что LiNO3 значительно ускоряет взаимодействие SО2 и с оксидами других щелочноземельных металлов (табл.1). Однако с практической точки зрения более важным явился тот факт, что соединения лития активируют как реакцию:
СаСО3 + SО2 > CaSO3 + CO2, (3)
так и аналогичные реакции с карбонатами других щелочноземельных металлов (табл.1). Этот факт является весьма важным при извлечении SO2 из дымовых газов. Как известно, одним из основных компонентов дымовых газов является СО2, концентрация которого значительно превосходит концентрацию SO2. Очевидно, что оксиды металлов будут в основном реагировать по схеме (1), что понизит эффективность адсорбции диоксида серы. При использовании же активированного СаСО3 будет осуществляться селективное извлечение из газа только SO2. Немаловажным является и тот факт, что СаСО3 является основной составной частью многих природных минералов, в то время как СаО нужно получать в результате энергозатратных технологических операций. Установлено, что помимо нитрата лития активирующее влияние на реакцию (3) оказывают и нитраты других щелочных металлов (табл.2).
Таблица 2 - Зависимость температуры начала взаимодействия систем СаСО3 - МеNO3 и СаО - МеNO3 с SO2
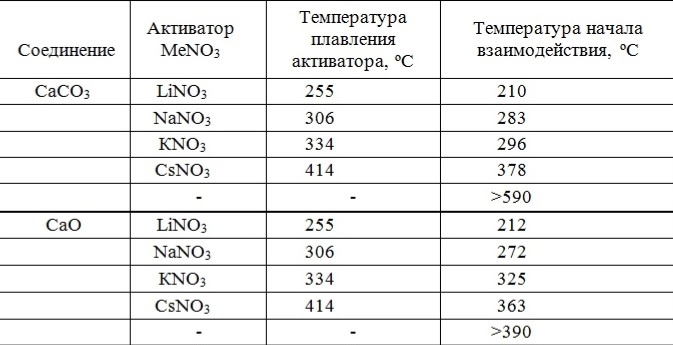
При этом наблюдается практически линейная зависимость между температурой плавления нитрата щелочного металла и температурой начала интенсивного взаимодействия систем СаСО3 - МеNO3 и СаО - МеNO3 с SO2 (рис.1).
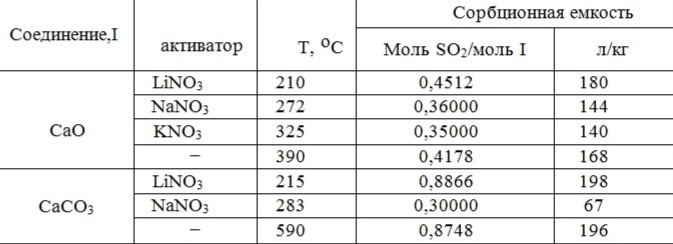
Таблица 3 – Сорбционная способность CaO и CaCO3 по отношению к SO2
Взаимодействия активированного СаСО3 с SО2 может быть представлено следующей вероятной схемой:
МеNO3 > МеNO3*,
МеNO3* + n CaCO3 > n CaCO3 • МеNO3,
n CaCO3• МеNO3* + n SO2 > МеNO3*+ CaSO3 + CO2.
где МеNO* – нитрат металла с разупорядоченной кристаллической структурой; n СаСО3•МеNO3 – активный комплекс.
Обращает на себя внимание тот факт, что, несмотря на то, что согласно уравнению (2) количество адсорбированного SO2 должно составлять 1 моль на 1 моль CaO или CaCO3, в реальных условиях эта величина (табл.3) меньше. Если в случае с CaCO3 она приближается к 1, то для СаО она существенно меньше.
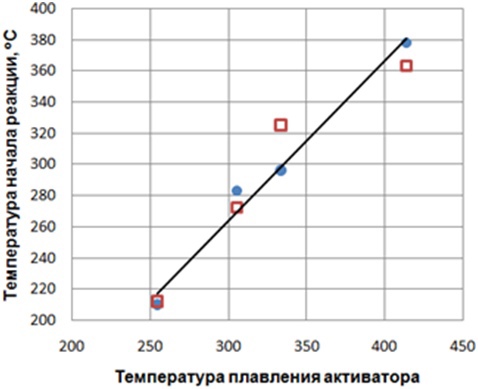
Рисунок 1 – Зависимость температуры начала взаимодействия систем СаСО3 - МеNO3 и СаО - МеNO3 с SO2 от температуры плавления активатора.
Причина, вероятно, заключается в том, что в случае с СаО осуществляется реакция присоединения, что приводит к увеличению плотности образца и затруднению доступа SO2 к поверхности СаО. Реакция (3) является реакцией обмена без существенного увеличения плотности и пористости образца.
Таким образом, системы на основе карбонатов щелочноземельных металлов активированных солями щелочных металлов могут быть взяты за основу при разработке высокоэффективных адсорбентов диоксида серы из дымовых газов в широком диапазоне температур.
Список использованной литературы
- Лазарев, Н.В. Вредные вещества в промышленности – Л.: Химия, 1997. – 592с.
- Рихтер, Л.А.Охрана водного и воздушного бассейнов от выбросов тепловых электростанций – М.: Энергоиздат. – 1981. – 296 с.
- Баркер, К.Загрязнение атмосферного воздуха / К.Банкер, Ф.Кеби. – М.: 1962 – 243с.
- Альтшулер, В.С. Высокотемпературная очистка газов от сернистых соединений / В.С. Альтшулер, А.А. Гаврилова. – М.: Наука, - 1976. – 243с.
- Шаповалова Т.В., Куликовская О.В. Модель взаимодействия в системах LiNO3 – СаО и LiNO3 – СаО – СО2 // Научные труды ДонНТУ. Серия: Химия и химическая технология. – 2010. – Вып. 15 (163). – С. 76 – 86.
- Шаповалов В.В., Куликовская О.В. Изучение влияния иона лития на системы щелочноземельных металлов «MeO – СO2» и «MeO – SO2». Третья международная научная конференция “Химическая термодинамика и кинетика”, Великий Новгород, 27-31 мая 2013 г. – 56-57с.
- Шаповалов, В.В., Сопина, Ю.С., Шаповалова Т.В. Адсорбенты диоксида серы на основе активированных соединений щелочноземельных металлов: науч. ст. – ДонНТУ.