Аннотация
Выявлена эффективность поглощения диоксида серы оксидом и карбонатом кальция импрегнированных нитратом натрия в качестве активатора. Установлены температуры начала взаимодействия с диоксидом серы систем NaNO3 - CaCO3, NaNO3 – CaO.
Ключевые слова: диоксид серы, оксид кальция,карбонат кальция, нитрат натрия, хемосорбция, активация процесса.
Общеизвестно, что диоксид серы SO2 относится к вредным веществам, отрицательно воздействующим как в чистом виде на биологические и техногенные объекты, так и особенно после его превращения в атмосфере в серную кислоту. Сегодня существует два основных направления снижения выбросов оксида серы энергетическими установками, сжигающими серосодержащее топливо: - предварительное (перед сжиганием) снижение содержания серы в исходном топливе (десульфуризация топлива); - очистка дымовых газов от оксидов серы с помощью специальных установок [1].
В мокром способе вследствие кислотных свойств сорбцию SO2 проводят веществами основной природы, из которых наиболее доступными являются суспензии или растворы гидроксидов и карбонатов щелочноземельных металлов, в основном кальция [1,2]. Использование водных растворов ограничено низкой температурой очищаемого газа, в то время как, например, отходящие дымовые газы имеют температуру около 200 °С.
К сухим способам относится поглощение диоксида серы углеродными поглотителями (активные угли и полукоксы). Так по данным [3] рекомендуется горячие дымовые газы с температурой 250-500 °С пропускать через графитовый механический фильтр, на котором происходит частичное восстановление оксида азота NO и диоксида серы SO2 по реакциям:
Процесс усложняется образованием кроме СО2 и оксида углерода СО, который рекомендуется окислять до СО2 на гопкалите [3].
Применение в качестве реагента недорогих и недефицитных природных твердофазных материалов затруднено из-за их низкой химической активности в приемлемом интервале температур. Так, например, известь или карбонаты кальция в виде мела, известняка или доломита используют при высокой температуре, добавляя их непосредственно в топку печи [4].
Несмотря на большое количество работ посвященных проблемам очистки газов от SO2, поиск новых сорбентов является весьма актуальным.
Цель исследования состояла в получении высокоактивных хемосорбентов диоксида серы на основе оксида и карбоната кальция активированных нитратом натрия.
Методика проведения эксперимента и описание лабораторной установки дифференциально-термического анализа приведены в [5].
Принципиальное отличие диоксида серы от диоксида углерода заключается в том, атом S+4 в составе SO2 обладает выраженными как восстановительными, так и окислительными свойствами. Поэтому реакции SO2 могут протекать как с изменением, так и без изменения степени окисления серы.
Обращает внимание на себя тот факт, что не смотря на значительно большую активность CаО по сравнению с СаСО3, в количественном соотношении оксид кальция, является худшим адсорбентом диоксида серы, по сравнению с карбонатом кальция. В случае с СаСО3 взаимодействию с SO2 предшествует разложение СаСО3 до оксида кальция и СО2. При этом плотность вещества уменьшается и увеличивается его пористость, что способствует проникновению молекул диоксида серы к поверхности СаО. При этом плотность вещества практически не изменяется по сравнению с исходным карбонатом кальция. В случае с оксидом кальция происходит не обменная реакция СО2 на SO2, а присоединение SO2 к СаО.
На рис. 1. представлена схема взаимодействия соединений кальция с диоксидом серы.
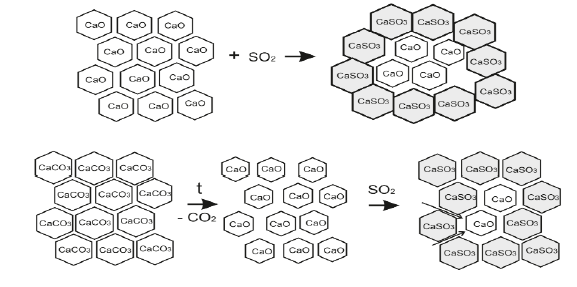
Рисунок 1 – Схема взаимодействия соединений кальция с диоксидом серы
При этом геометрическая плотность образца возрастает, а пористость, соответственно, уменьшается. Это приводит к прекращению доступа диоксида серы к поверхности оксида кальция. Аналогией данного процесса является процесс нейтрализации Н2SO4 оксидом кальция и карбонатом кальция. CaCO3 эффективно нейтрализует серную кислоту в отличие от CaO, вследствие образования газообразного диоксида углерода, который разрушает нерастворимую пленку сульфата кальция и обеспечивает доступ серной кислоты к поверхности карбоната кальция.
Недостатком использования карбоната кальция и оксида кальция в качестве адсорбентов диоксида серы является весьма высокие температура взаимодействия с SO2. Для CaCO3 она составляет более 590 °С, а для CaOболее 390 °С.
Для изучения взаимодействия в системе SO2-CaO-NaNO3 и SO2-CaCO3-NaNO3 готовились образцы путем спекания нитрата натрия с СаСО3 или СаО.
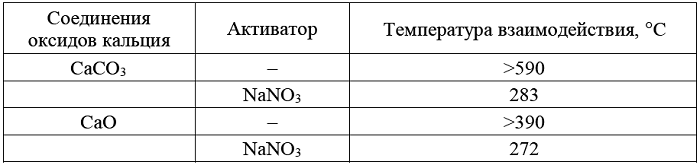
Таблица – Влияние активатора на температуру начала взаимодействия СаСО3 и CaO с диоксидом серы
Реакции взаимодействия соединений кальция с диоксидом серы в присутствии нитратов
протекают значительно более интенсивно, чем с индивидуальными СаСО3 или СаО и их начало характеризуется более низкими температурами (таблица).
Взаимодействие диоксида серы с системой NaNO3 – CaO начинается при температуре 272°С. На ИК-спектрах продуктов реакции присутствуют полосы поглощения при 950-970 см-1 и 700-720 см-1, характерные для валентных колебаний S=O сульфит ионов. Полоса поглощения при 1100-1150 см-1 относится к колебаниям S=O сульфат ионов. В ИК-спектре проявляются полосы поглощения нитрат иона NO3-, которые перекрывают полосы поглощения вазелинового масла. Данные свидетельствуют о протекании реакций типа:
Взаимодействие системы NaNO3 - СаСO3 c диоксидом серы начинается при температуре 283 °С. На ИК-спектрах продуктов реакции присутствуют полосы поглощения при 950-970 см-1 , 700-720 см-1, 1100-1120 см-1 характерные для валентных колебаний S=O сульфит- и сульфат ионов. Также проявляются полосы поглощения N-O нитрат иона NO3-.
Как следует из выше сказанного, в результате взаимодействия оксидов и карбонатов с SO2 одним из продуктов взаимодействия являются сульфит кальция, сульфит-ион SO32- содержит в своем составе серу, в промежуточной степени окисления +4, что обуславливает как окислительные так и восстановительные свойства иона.
Катализатором ускоряющим процесс взаимодействия СаО и СаСО3 с SO2- являются нитрат натрия. Нитрат ион NO3- содержит в своем составе азот в высшей степени окисления +5. То есть он является только окислителем. Однако хорошо известно, что нитрат-ион под действием высоких температур разлагается до нитрит иона NO2-, в котором азот находится в промежуточной степени окисления +3, т.е обладает как окислительными так и восстановительными свойствами.
Следовательно, в рассматриваемых системах имеет место сложное сочетание частиц, обладающими как окислительными, так и восстановительными свойствами, которые могут по-разному проявляться в зависимости от концентрационных и теплофизических характеристик процесса.
Из этого следует, что в процессе взаимодействия SO2 с карбонатами и оксидами в присутствии нитратов щелочных металлов будут происходить не только реакции взаимодействия оксидов и карбонатов с SO2 в присутствии «нейтрального катализатора», но и осуществляться превращения катализатора в результате взаимодействия его с продуктами реакции карбонатов и оксидов с SO2.
Выводы
Выявлена эффективность поглощения диоксида серы оксидом и карбонатом кальция импрегнированных нитратом натрия в качестве активатора.
Установлены температуры начала взаимодействия с диоксидом серы систем NaNO3 - CaCO3, NaNO3 - CaO.
С научной точки зрения результаты исследования представляют интерес для разработки методов активации гетерогенных твердофазных систем. Результаты могут быть использованы для разработки эффективных адсорбентов кислых газов.
Список использованной литературы
- Соловьев А.К., Михеев В.О., Пуликов П.С. Очистка дымовых газов от оксидов серы // Вестник Сибирского государственного
индустриального университета - 2014. - № 3(9). - С. 33-36.
- Патент 2438761. Российская Федерация, МПК B01D53/50. Способ и система комплексной сухой и мокрой очистки дымового газа:
2009100163/05: заявл. 09.05.2007: опубл. 10.01.2012 / Гэнсли Раймонд Р. (US), Рейдер Филип К. (US) – 3 с.
- Патент 2676642. Российская Федерация, МПК B01D 53/02(2006.01). Способ комплексной очистки дымовых газов: № 2018104414:
заявл. 05.02.2018: опубл. 09.01.2019 Бюл. № 1/ И.Г. Ткаченко, С.Г. Шабля, С.В. Твардиевич [и др.] - 10 с.
- Патент 2341729. Российская Федерация, МПКF23C10/10. Способ снижения выделений диоксида серы из бойлера с циркулирующим
псевдоожиженным слоем: 2007102271/06: заявл. 21.06.2005: опубл. 20.12.2008/ КиннуненПертти (FI).
- В.В. Шаповалов, Ю.Н. Ганнова, Т.В. Шаповалова, А.А. Берестовая Адсорбенты диоксида серы на основе CaO и CaCO3,
активированных нитратом лития / // Научный вестник НИИГД Респиратор. – 2021. - № 3(58). – С.96-106.