 |
 |
 |
|
||||||||
| Dissertation | Links | Library | Inet search results | |||||
Сульфирование и
сульфохлорирование, их значение для химфармпромышленности (ХФП), препараты,
реагенты, кинетика, механизм, особенности и закономерности проведения реакций,
технология получения основных продуктов, техника безопасности при их синтезе,
экология.
В мире производится огромное количество алкилбензолсульфонатов, кроме того арил- и гетарилсульфокислоты и сульфохлориды служат в качестве интермедиатов в синтезе многих лекарственных препаратов. В молекуле ряда природных продуктов также имеется сульфогруппа. Таким образом, реакции сульфирования и сульфохлорирования в ряду ароматических и гетероциклических соединений широко используются в основном органическом синтезе и химфармпромышленности.
Значение реакций сульфирования и сульфохлорирования, препараты
В состав хрящевой ткани входит полисахарид - хондроитинсерная кислота (ХНСК), мономерами которой являются эфиры серной кислоты глюкороновой кислоты и N–ацетилгалактозамина. Препараты хонсурид и румалон, экстракты хрящевой ткани, содержат ХНСК. Хонсурид используется для лечения долго не заживающих ран, а румалон применяют при дегенеративных изменениях хрящей (артрозы, спондилезы). Мукополисахарид гепарин с молекулярной массой около 16000, является полимером глюкороновой кислоты и глюкозамина, этерифицированного серной кислотой. Гепарин вырабатывается базофильными клетками человека и животных. Препарат обладает антикоагулирующим действием, понижает содержание холестерина в сыворотке крови. Его применяют при терапии инфаркта миокарда, тромбозов магистральных вен и артерий, сосудов головного мозга.


гепарин
натрия* кальция добензилат*
поликрезулен*
(доксиум, доксилек)
ПАБК
сульфаниламиды
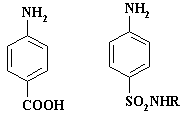
В отличие от нитро- и нитрозогрупп, сульфогруппа не часто встречается в синтетических лекарственных средствах. Один из сульфосодержащих препаратов – кальция добензилат* (доксилек, доксиум - 2,5-дигидроксисульфонат кальция), который применяют для профилактики и остановки капиллярных кровотечений. Второй - поликрезулен* (ваготил), использующийся в качестве вяжущего, антимикробного и прижигающего средства. Однако производные сульфокислот – сульфаниламиды, составляют большой класс антибактериальных средств. Группа SO2NH2 обладает фармакофорными свойствами, она моделирует карбоксигруппу, так как ее радиус и величина рКа очень близки к остатку СООН. Как известно п-аминобензойная кислота (ПАБК) является витамином для ряда микроорганизмов, она служит предшественником фолиевой кислоты. Для эукариот витамином является сама фолиевая кислота. Молекула стрептоцида – п-аминобензолсульфонамида (R = H) является структурным аналогом п-аминобензойной кислоты. В результате конкурентного ингибирования сульфаниламидные препараты предотвращают нормальное включение ПАБК в фолиевую кислоту у чувствительных микроорганизмов. Тем самым задерживают рост и приводят к их гибели. Сульфаниламидные препараты являются антиметаболитами, п-аминобензойная кислота – метаболит. Формулы основных лекарственных препаратов приведены в разделе «реакции хлорсульфирования», так как основным способом их получения является взаимодействие фенилуретилансульфохлорида с аминами.
Кроме того, реакции сульфирования ароматических и гетероциклических соединений имеют определенное значение в синтезе ряда лекарственных средств. Проведение реакций сульфокислот с нуклеофилами позволяет синтезировать циано-, амино- и гидроксисоединения. Так сульфокислоты с помощью реакции щелочного плавления превращаются в фенолы. Восстановление сульфокислот позволяет синтезировать тиофенолы. Ипсо-замещение сульфогрупп на нитрогруппы рассматривалось в разделе «Реакции нитрования». И, наконец, в синтезе лекарственных препаратов применяют такую особенность реакции сульфирования, как ее обратимость. Эти направления использования сульфокислот отражены на схеме:

Подробности каждого из представленных видов превращений рассмотрены в соответствующих разделах. В данном разделе приведены примеры использования сульфокислот при получении некоторых лекарственных веществ.
Препарат неостигмин бромид* (прозерин,
N-м-
диметилкарбамоилоксифенилтриметиламмоний метилсульфат) применяют при
двигательных нарушениях после травм мозга, параличей различной этиологии, в
глазной практике при глаукоме. Ретросинтез препарата представлен на следующей
схеме:

Второй пример получения гидроксипроизводного из сульфокислоты – синтез хинозола, контрацептивного препарата, а также исходного соединения при получении нитроксолина (см. раздел 2.3.2.). Метод получения хинозола разработан в ВУХИНе:

Третий пример – препарат клофелин - 2-(2,6-дихлорфениламино)-имидазолин гидрохлорид - гипотензивное средство, применяющееся при лечении гипертонического криза. Фрагмент ретросинтеза клофелина представлен на следующей схеме:

Получить индивидуальный
2,6-дихлоранилин непосредственно из анилина невозможно, так как при хлорировании
анилина образуется смесь 2,4-, 2,6-дихлоранилинов и 2,4,6-трихлоранилина.
Поэтому необходимо блокировать п-положение с помощью легко удаляемой
электроноакцепторной группировки. Тогда при проведении хлорирования может
образоваться только 2,6-дихлорпроизводное. В данном случае в качестве защиты
используют сульфогруппу.
Таким образом, реакции
сульфирования и хлорсульфирования имеют значение при разработке альтернативных
методов синтеза лекарственных средств. К сожалению, технологические особенности
процессов таковы, что при их проведении возникают проблемы. Необходимо
рассмотреть общие закономерности и механизм реакций, а также особенности их
проведения с различными классами субстратов.
Сульфирование относится к
реакциям электрофильного замещения. Частицами, атакующими субстрат реакции,
являются HSO3+, H2S2O7,
SO3 и H3SO4+ которые возникают в
растворе олеума или концентрированной серной кислоты в результате автопротолиза:
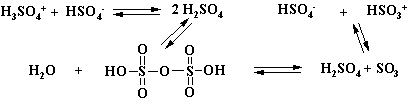 (уравнение
1)
(уравнение
1)При этом наблюдается ионизация моногидрата лишь на 0,2 – 0,5%. При разбавлении 100% серной кислоты водой происходит ее ионизация по следующему уравнению:
![]() (уравнение 2)
(уравнение 2)
Концентрация реакционноспособных частиц во многом зависит от используемого реагента.
Реагенты, использующиеся при проведении реакции сульфирования
1. Концентрированная серная
кислота - 92-94% H2SO4 (купоросное масло);
2. Моногидрат - 98-100%
H2SO4;
3. Жидкий олеум – 6-25%
свободного SO3 (H2S2O7), 60-65% свободного
SO3 (H2S2O7);
4. Хлорсульфоновая кислота –
HOSO2Cl;
5. Молекулярные комплексы сульфотриоксида с пиридином или диоксаном:

Механизм реакции сульфирования
Обширные кинетические
исследования последних лет позволили выяснить закономерности реакции
сульфирования. Механизм реакции рассмотрен на примере, в котором в качестве
реагента участвует сульфотриоксид, а субстрат реакции - бензол. Так же, как и
для других реакций электрофильного замещения, исходные продукты образуют
p-комплекс. После преодоления
энергетического барьера - s-аддукт.

p-комплекс
s-аддукт
Кинетические исследования
реакции сульфирования хлорбензола и пентадейтерохлорбензола в моногидрате или
олеуме показали, что величина константы скорости реакции для хлорбензола больше
в 1,2 раза. Таким образом, наблюдается кинетический изотопный эффект.
Следовательно, лимитирующей стадией процесса является отрыв протона и
К2 << К1 и К-1. В отличие от реакций
нитрования и нитрозирования, отрыв протона происходит через более высокий
барьер, чем при образовании s-аддукта. Кинетическое
уравнение реакции в общем виде может быть представлено в следующем общем
виде:
![]() (уравнение
3),
(уравнение
3),
где: Х+ одна из атакующих
электрофильных частиц. Однако при проведении сульфирования в 96% серной кислоте
кинетический изотопный эффект уже отсутствует. Таким образом стадией,
лимитирующей процесс, становится образование s-аддукта. В этом случае
кинетическое уравнение процесса сульфирования не отличается от уравнения реакции
нитрования:
V = d[ArX]/dt =
K1[Ar-H][X+] (уравнение 4)
Было найдено, что при переходе от 100% серной кислоты к 99,5% скорость реакции уменьшается на несколько порядков. Это объясняется тем, что концентрация реакционноспособных частиц существенно снижается из-за ионизации серной кислоты согласно уравнению 2, так как увеличение концентрации гидросульфат ионов HSO4- сдвигает равновесие, изображенное в уравнении 1, в сторону серной кислоты. Кинетическое уравнение реакции может быть представлено в следующем виде:
![]() (уравнение 5)
(уравнение 5)
Основной реакционноспособной частицей становится ион H3SO4+, активность которого существенно ниже, чем пиросерной кислоты. Снижение реакционной способности атакующей частицы приводит к увеличению региоселективности процесса. Был предложен одностадийный механизм реакции через циклическое переходное состояние:
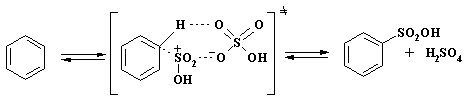
Показано, что этот механизм не противоречит кинетическим исследованиям во всей изученной области составов сульфирующих агентов.
Особенности реакции сульфирования, побочные реакции
Первой и основной особенностью сульфирования является то, что эта реакция в условиях проведения процесса обратима:
![]()

Электронная плотность на
атоме углерода, связанном с сульфогруппой, в бензолсульфокислоте выше, чем на
аналогичном атоме углерода в нитробензоле. Поэтому вероятность ипсо-атаки
протона при сульфировании значительно больше. При нитровании обратимость реакции
наблюдается только в растворах концентрированной хлорной кислоты, а в случае
сульфирования это происходит даже в разбавленных растворах серной кислоты.
Поэтому приходится подбирать такую концентрацию серной кислоты, чтобы равновесие
было сдвинуто вправо. Количество серной кислоты должно быть существенно больше
стехиометрического как для связывания выделяющейся воды, так и для смещения
равновесия в сторону целевого продукта. Был разработан эмпирический показатель
p-сульфирования – это
концентрация отработанной серной кислоты после завершения процесса
сульфирования, выраженная в процентах SO3, при которой наблюдается
максимальный выход сульфокислоты. Для многих ароматических соединений была
найдена величина p-сульфирования, которая для
каждого из субстратов реакции имеет свое значение. Так для бензола величина
p-сульфирования составляет
66,4% SO3, для толуола – 58 и
нитробензола – 82. Коэффициент p-сульфирования используется
для расчета количества серной кислоты, необходимой для моносульфирования 1
кг-моля ароматического соединения по следующей формуле:
![]() (уравнение 6),
(уравнение 6),
где: а – концентрация
SO3 в исходном сульфирующем
агенте.
Использование этой формулы
позволяет найти количество серной кислоты различной концентрации или олеума. В
качестве примера рассчитаем количество 92, 94 и 100% серной кислоты и 20%
олеума, необходимой для моносульфирования 1 кг-моля бензола. Для этого
необходимо найти величину а
(концентрацию SO3) в каждом из
реагентов.
Для 92%
H2SO4: в 100 кг раствора содержится 92 кг
H2SO4
H2SO4
SO3
98
80
92
х
х =
75,1% SO3 ,
В 100 кг кислоты содержится
75,1 кг сульфотриоксида и 24, 9 кг Н2О. Аналогично ведется расчет
количества SO3 и воды для серной кислоты
другой концентрации.
Для 20% олеума: в 100 кг
содержится 20 кг SO3 и 80 кг H2SO4. В этом
количестве серной кислоты содержится 65,3 кг SO3. Всего в 100 кг
олеума содержится 85.3 кг SO3 (величина «а») и 14, 7 кг Н2О.
Рассчитаем количество серной кислоты, необходимой для моносульфирования 1 кг-моля бензола по уравнению 6:
Х = 308; 261; 176,8 и 142,2 кг соответственно для 92, 94, 100% H2SO4 и 20% олеума.
После проведения реакции концентрация отработанной серной кислоты во всех рассматриваемых случаях составляет величину равную p - 66,4 % SO3, что соответствует 81,34 % серной кислоте. Согласно уравнению реакции при моносульфировании 1 кг-моля бензола расходуется 1кг-моль сульфотриоксида:
С6Н6 +
SO3 =
С6Н5SO3H
Исходя из полученных
расчетов можно найти количество отработанной серной кислоты. Так при
использовании 92% серной кислоты останется 228 кг отработанной кислоты (308 – 80
= 228). Это является типичным примером составления материального баланса
химического процесса. Результаты расчета представлены в таблице:
|
Реагент |
А |
Х, кг |
Количество
отработанной кислоты с концентрацией p, кг |
|
92%
H2SO4 |
75,1 |
308 |
228 |
|
94%
H2SO4 |
76,7 |
261 |
181 |
|
100%
H2SO4 |
81,6 |
176,8 |
97 |
|
20% SO3 |
85,3 |
142,2 |
62 |
Как видно из приведенных в
таблице результатов при использовании реагентов с большим содержанием
SO3 количество отработанной
серной кислоты уменьшается. При использовании моногидрата количество отходов
уменьшается по сравнению с 92% кислотой более чем вдвое.
Однако, уже при
использовании 20% олеума, наблюдается побочный процесс образования сульфонов,
которые не находят квалифицированного применения. Для снижения количества
сульфонов, как следует из уравнения 5, добавляют сульфат натрия.
ArSO3H
+ SO3 ®
ArSO2+ + HSO4-
ArSO2+
+ С6Н6
®
Ar-SO2-Ar
При разработке регламента производства необходимо экспериментально подбирать концентрацию сульфирующего агента. Однако всегда имеется определенное количество отработанной кислоты, что осложняет экологическую обстановку. Укрепление отработанной кислоты олеумом экономически нецелесообразно и чаще всего приходится нейтрализовать кислоту мелом с получением гипса, или отправлять ее на станцию нейтрализации и далее на биоочистку.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ
Изомерный состав продуктов
зависит как от концентрации SO3 в сульфирующем агенте, так
и от температуры. Наиболее отчетливо это проявляется при сульфировании
нафталина. Взаимодействие нафталина с олеумом при температуре 800С в
основном приводит к получению 1-нафталинсульфокислоты, проведение реакции при
1200С в 96% серной кислоте дает 2-нафталинсульфокислоту.
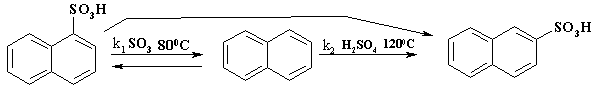
Электронная плотность в
a-положении нафталина выше,
чем в b-положении, поэтому
первоначально атака сульфирующего агента осуществляется по a-положению цикла. Это можно
представить на молекулярной диаграмме реакции. Из-за малых величин энергии
активации при образовании p-комплексов, они на
диаграмме опущены.
![]()
![]()
![]() D
D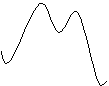 G
1
2
G
1
2
1 – сульфирование в
положение 1 нафталина
2 - сульфирование в
положение 2 нафталина
![]()
Из приведенной диаграммы
видно, что свободная энергия активации в первом случае меньше, чем во втором.
Следовательно, константа скорости реакции
k1 > k2. Однако реакция обратима, а
свободная энергия 2-нафталинсульфокислоты меньше, чем a-изомера (см. энергетическую
диаграмму реакции). Поэтому при повышении температуры происходит накопление в
реакционной массе b-изомера. Исследование
кинетики реакции с помощью 35S серной кислоты показало,
что превращение a-изомера в b-изомер происходит как
межмолекулярно с десульфированием, так и внутримолекулярно за счет 1,2-сдвига.
Сульфирование олеумом при низкой температуре идет при кинетическом контроле
реакции, а серной кислотой при более высокой температуре при термодинамическом
контроле.
Сульфирование толуола при
различных температурах дает преимущественно о-, м- или п-толуолсульфокислоты, или их смесь.
Результаты представлены в таблице 2.
Сульфирование толуола. Табл.
2.
|
Сульфирующий
агент |
Температура,
0С |
Изомерный состав, % | ||
|
|
|
Орто- |
Пара- |
Мета- |
|
78% H2SO4 |
25 |
21 |
77 |
2 |
|
74%
H2SO4 |
140 |
3 |
37 |
60 |
|
74%
H2SO4 |
200 |
2 |
5 |
93 |
|
65
- 72% H2SO4 |
110* |
7 |
90 |
3 |
|
98%
H2SO4, NaHSO4 |
90 |
3 |
96 |
1 |
|
96%
H2SO4 |
40 |
87 |
10 |
3 |
* азеотропная отгонка воды с
толуолом, избыток толуола.
Проведение реакции при
кинетическом контроле (96% H2SO4, 400С) приводит
в основном к получению о-изомера,
который может быть использован для синтеза сахарина. При избытке толуола, или в
присутствии гидросульфата натрия в основном образуется п-толуолсульфокислота, из которой
получают п-крезол. При
термодинамическом контроле образуется в основном м-толуолсульфокислота.
В настоящее время наиболее
многотоннажным производством является получение алкилбензолсульфонатов (АБС),
общей формул: СnH2n+1C6H4-SO3Na (n³10), которые используются в
качестве анионных поверхностно-активных веществ (ПАВ). Ожидается, что в мире в
2000 г. будет произведено до 2,7 млн. т. АБС. Огромный масштаб производства
диктует то, что сульфирование должно быть практически безотходным и процесс
непрерывным. Сульфирование даже высокопроцентным олеумом неприемлемо, так как на
1 т. АБС образуется 1,5 т. 70% серной кислоты и в полученной реакционной массе
содержится до 15% кислоты, нейтрализация которой при получении сульфоната
приводит к повышенному расходу гидроксида натрия.
Имеется два варианта
производства АБС – сульфирование газообразным SO3 и жидкой смесью
SO2 и SO3. При сульфировании
протекают следующие процессы:

Первая стадия - образование
пиросульфокислоты идет с большой скоростью, скорость второй на порядок ниже
(0,03 л моль-1с-1). Основной примесью являются сульфоны.
При длине углеродной цепочки 10 – 14 атомов их выход составляет менее 1%.
Также практическое значение
имеет синтез и 1,3-бензолдисульфокислоты для получения резорцина,
использующегося при лечении некоторых кожных заболеваний. Сульфирование бензола
осуществляют в две стадии. На первой стадии сульфируют бензол 98-100% серной
кислотой при 50-600С, а затем добавляют 60% олеум и нагревают до
800С. Лучшие результаты получены при сульфировании 65% олеумом в
присутствии сульфата натрия для предотвращения образования сульфонов. Расход
сульфирующего агента снижается, дисульфокислоту не выделяют и используют в виде
60% водного раствора для последующего проведения щелочного плавления.
Хлорбензол сульфируют
моногидратом при 80-1000С, сульфокислоту не выделяют и в том же
растворе проводят нитрование с получением 3-нитро-4- хлорбензолсульфокислоты.
Как отмечалось в разделе
2.3.1., 3-нитробезолсульфокислоту получают сульфированием нитробензола. Реакцию
проводят при 100-1100С в 65% олеуме, образуется только один изомер.
Полученный продукт используют в синтезе метаниловой кислоты (м-аминобензолсульфокислоты).
Сульфирование п-нитротолуола олеумом
90-1000С дает 4-нитро-2-толуолсульфокислоту, из которой получают красители.
Сульфирование ариламинов во
многом отличается от других ароматических соединений. Первой стадией получения препарата
прозерин является сульфирование
диметиланилина. Уже в 92% серной кислоте диметиланилин ионизирован на 100%. При
этом неподеленная электронная пара в нем блокирована протоном, нет ее сопряжения
с ароматическим циклом. Диметиламмониевая группа становится электроноакцепторным
заместителем, ориентирующем электрофильный агент в м-положение бензольного ядра. Реакцию
проводят в 18% олеуме при 60 – 660С.

Столь жесткие условия
реакции диктуются тем, что электронная плотность в м- положении ниже, чем в нитробензоле.
Для получения о- или п-изомеров необходимо сульфировать
ациланилиды с последующим снятием ацильной защиты. В этом случае протонирования
аминогруппы не наблюдается. Ациламиногруппа ориентирует электрофильные агенты
в о- и п-положение ароматического цикла. Однако
так же, как и при нитровании солей аминов, можно избежать введения ацильной
защиты.
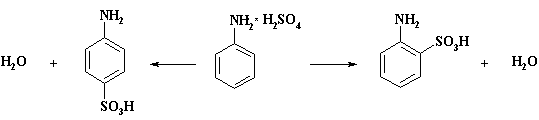
Так при запекании сухого
сульфата анилина, полученного из анилина и серной кислоты в бензоле, при 140 –
1600С образуется ортаниловая кислота (о- аминобензолсульфокислота). При 180 –
1900С образуется сульфаминовая кислота (п- аминобензолсульфокислота). Следует
отметить, что реакция региоселективна, отходов практически нет. По одному из
рассматриваемых механизмов реакции сульфат анилина вначале превращается в
производное сульфаминовой кислоты Ph-NH-SO3H, внутримолекулярная
перегруппировка которого дает сульфаниловую либо ортаниловую кислоты. Нельзя
исключить и второй вариант - диссоциацию сульфата анилина на анилин и серную
кислоту без выхода ее из клетки кристалла и затем сульфирование в о- или п-положение ароматического цикла. В
настоящее время нет решительных доказательств, свидетельствующих о преобладании
одного из них.
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ СУЛЬФИРОВАНИЯ
Тепловой эффект реакции составляет 121 – 168 кДж/моль. При сульфировании серной кислотой также как и при нитровании, выделяется вода, то есть наблюдается выделение тепла за счет разбавления серной кислоты. Однако скорость реакции сульфирования намного ниже, чем нитрования. Поэтому процесс сульфирования проводят при нагревании реакционной массы паром через рубашку. Из-за низкой скорости реакции «теплового взрыва» не происходит. При периодическом способе производства реакцию ведут в сульфураторах – чугунных или стальных аппаратах, снабженных якорной или рамной мешалкой, рубашкой для нагревания и охлаждения, загрузочными отверстиями, трубой для передавливания реакционной массы, гильзой термометра и пробоотборника.
Окончание реакции определяют по отсутствию исходного субстрата в отобранной пробе. Самым простым способом является растворение пробы в воде. Отсутствие эмульсии или суспензии означает, что реакция закончена, так как сульфокислоты растворимы в воде.
Оригинальным технологическим
решением является сульфирование бензола или толуола в парах. Субстрат реакции
испаряют в теплообменнике и пропускают через нагретую серную кислоту. При этом
часть его сульфируется и сульфокислота остается в реакционной массе. Большая
доля субстрата в виде азеотропной смеси улетает, пары конденсируют в
теплообменнике и в делительной воронке непрерывного действия отделяют воду.
Азеотропная смесь содержит 25% воды и 75% бензола. Таким образом, из реакционной
массы непрерывно удаляется вода и концентрация серной кислоты поддерживается
около 90%. Реакцию проводят до тех пор, пока в реакционной массе не останется 3
- 4% серной кислоты. Полное использование кислоты нецелесообразно из-за
образования дифенилсульфона. Сырой бензол промывают водой и щелочью и возвращают
в реакцию. Этот способ ценен тем, что существенно уменьшается количество
отработанной серной кислоты. Недостатком способа является большое количество
обращающейся в производстве легко воспламеняющейся жидкости (ЛВЖ).
Получение сульфаниловой
кислоты ранее проводили с помощью «сухого запекания» на противнях или в
трубчатых печах. В настоящее время реакцию проводят в обычном емкостном
аппарате. Смешивают эквимольное количество серной кислоты и анилина в
полихлорбензолах. Процесс ведут с непрерывной азеотропной отгонкой воды.
Сложной технологической
операцией является выделение сульфокислот. После окончания реакции сульфомассу
выливают или передавливают на воду, частично нейтрализуют и высаливают с помощью
добавлений сульфата или сульфита натрия. Осадок натриевой соли сульфокислоты
отфильтровывают.

В тех случаях, когда высаливание не помогает, сульфокислоту приходится выделять в виде труднорастворимых солей металлов. Если и этот способ не дает результата, то используют более сложную операцию. Реакционную массу нейтрализуют известью или мелом. Кальциевые соли сульфокислот растворимы в воде, а сульфат кальция (гипс) выпадает в осадок, его отфильтровывают. Водный фильтрат обрабатывают содой, мел выпадает в осадок, его отделяют. Водный фильтрат натриевой соли сульфокислоты упаривают досуха. Этот способ используют при получении прозерина, приведенный на схеме. Полученную натриевую соль 3-N,N- диметиламинобензолсульфокислоты направляют на щелочное плавление.
Оригинальное технологическое
решение используется в России для получения АБС. Сульфирование осуществляют
смесью диоксида (85%) и триоксида серы (15%). Жидкая сульфирующая смесь
поступает вместе с алкилбензолом в низ колонны, температура процесса 2…
-20С. Алкибензолсульфокислота, содержащая до 2% диоксида серы,
непрерывно вытекает из колонны и далее нагревается до 400С.
Удаляющийся газообразный диоксид смешивается с уходящим из колонны и
направляется на окисление в конвертор. Газообразный 100% SO2 смешивается с кислородом,
окисляется и конденсируется. Конденсат вновь направляется на сульфирование.
Таким образом удается получить продукт высокого качества и в процессе
практически полностью отсутствуют отходы. Алкилбензолзульфокислота передается на
стадию нейтрализации.
Хлорсульфоновая кислота (ХСК) является одним из сульфирующих агентов. Использование ХСК в апротонных растворителях приводит к результатам, отличающимся от сульфирования серной кислотой или олеумом. Так, при взаимодействии анилина, N-алкиланилинов с эквимолекулярным количеством ХСК в о-дихлорбензоле при 130-1400С образуются в основном п-сульфокислоты, с N,N-диалкиланилинами при 50 - 800С п-изомер получен с 90% выходом. Недостатком сульфирования с помощью ХСК является то, что в процессе реакции выделяется хлористый водород. Кроме того, ХСК дороже серной кислоты и олеума.
Однако в промышленном синтезе ХСК используется в основном для получения сульфохлоридов. Реакция хлорсульфирования идет в две стадии, первая из которых – сульфирование. При этом частично образуется и сульфохлорид. Вторая стадия включает в себя обмен гидроксигруппы сульфокислоты на атом хлора с ХСК:

Таким образом формально можно записать следующее уравнение:
![]()
Но вторая реакция обратима, для сдвига реакции вправо необходим 5-5.5 кратный избыток хлорсульфоновой кислоты.
Реакция сульфохлорирования является основной при получении ряда препаратов:

сахарин
пантоцид хлорамин Б
Препарат пантоцид получают из п-толуолсульфохлорида и используют для обеззараживания воды и ран в полевых условиях. Из о-изомера синтезируют сахарин, являющийся классическим подсластителем. При хлорсульфировании толуола при температуре 0 – 50С в основном образуется о-изомер, при 60 - 700С с добавкой NaCl получают до 80% п-изомера. Разделение изомеров осуществляют ректификацией. Хлорамин Б применяют в качестве дезинфицирующего средства, производят из бензолсульфамида. В химико-фармацевтической промышленности наиболее важным производством, в котором используют реакцию хлорсульфирования, является получение сульфаниламидных препаратов, их структура и применение представлены в таблице.
Сульфаниламидные
препараты
общей формулы:

|
T50 |
R1 = H, R |
Название |
Порядок приема |
|
5-6 ч |
Н |
Стрептоцид |
Не используется |
|
То же |
|
Cульфидин. И.Я.Постовский 1940\42 г |
Не используется |
|
10 ч |
|
Норсульфазол |
Используется в ветеринарии, очень мало в медицине 1 х 0,5 г через 4 ч |
|
10 ч |
|
Сульфадимезин |
Используется в ветеринарии, очень мало в медицине 1 х 0,5 г через 4 ч |
|
12 ч |
|
Cульгин |
Лечение кишечных инфекций 1-2 г на прием в первый день 6 раз, 2 -5 день по 3 раза |
|
10 ч |
|
Уросульфан |
Лечение инфекций мочевых путей по 0,5-1 г 3-5 раз в день |
|
ПРОЛОНГИ | |||
|
10-24 ч |
|
Cульфадиметоксин |
1 день 1,5 – 2 г в 1 прием, 2-ой день 1 г, с 3 по 5ый день по 0, 5 г |
|
24 ч |
|
Cульфамонометоксин |
тот же режим |
|
24 ч |
|
Сульфапиридазин |
тот же режим |
|
120 ч |
|
Cульфален |
2 г в один прием, 0,2 в день в течение 5и дней. |
|
|
R |
R1 |
|
|
|
|
|
Фтазин, при острой форме дизентерии, энтероколитов, колитов по 1 г 1-2 раза в день |
Т50 – время
полувыведения препарата из организма.
Синтез и свойства
салазодиметоксин и салазопиридазин рассмотрены в предыдущей главе.
Общим методом синтеза
сульфаниламидов является амидирование ацилбензолсульфонилхлорида. Схема
синтеза представлена на следующей
схеме:

Для проведения реакции
необходимо использовать ациланилид из-за того, что в растворе ХСК, в отличие от
раствора в апротонном растворителе, анилин протонирован на 100% так же как и в
серной кислоте. Выбор защитной ацильной группы обусловлен экономическими
причинами. По сравнению с ацетил-, форманилидом или фенилуретаном существенно
дешевле использовать фенилуретилан, который синтезируют из анилина и метилового
эфира хлоругольной кислоты.
Получение
фенилуретилансульфохлорида (ФУСХ) ведут периодическим способом. Тепловой эффект
реакции невысокий (43 кДж/моль). Сульфохлорирование фенилуретилана проводят при
температуре 30 – 400С, количество ХСК составляет 5-5,5 моль на 1 моль
фенилуретилана. В результате реакции выделяется газообразный HCl, поэтому сульфуратор должен
быть стальным или чугунным эмалированным, линия отвода HCl обычно выполнена из стекла
или поливинилхлорида. Перед началом проведения процесса осматривают аппаратуру,
проверяют на отсутствие влаги в аппарате и целостность эмали. Загрузка
фенилуретилана осуществляется шнековым питателем из закрытого бункера в
предварительно залитую из мерника хлорсульфоновую кислоту. По окончании реакции,
которое определяют по отсутствию исходного продукта в пробе, реакционную массу
передавливают в сборник. Состав массы – 26% ФУСХ, 51% ХСК и 15% серной кислоты.
Наиболее сложным
технологическим процессом является выделение ФУСРХ. Сульфохлориды нерастворимы в
разбавленных кислотах. Поэтому для их выделения реакционную массу после
проведения сульфохлорирования выливают на воду. Однако тепловой эффект реакции
ХСК с водой с получением серной кислоты и HCl составляет 132 ккал/моль,
при этом возможен побочный процесс – гидролиз ФУСРХ до сульфокислоты:
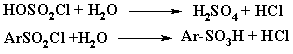
Эти факторы определяют технологию. Разложение
проводят в каскаде из двух реакторов. Из сборника реакционную массу с помощью
погружного насоса передают в первый реактор на воду. Температура процесса не
должна превышать 250С. Для этого проводят охлаждение реактора
рассолом через рубашку и раствор ФУРСХ в кислотах разбрызгивают через форсунку с
невысокой скоростью при эффективном размешивании массы в аппарате. Количество
воды подбирают так, чтобы концентрация серной кислоты составляла 89 – 90% для
наиболее полного удаления газообразного HCl. Полученный раствор медленно сливают
во второй реактор на воду. Условия разбавления те же – температура не выше
250С, эффективное размешивание и охлаждение. В конце процесса
концентрация серной кислоты составляет 60 – 70%, при этом наблюдается наиболее
полное выделение сульфохлорида. Полученную суспензию фильтруют на закрытом
нутч-фильтре, выложенном кислотостойкой керамической плиткой, промывают водой.
Полученную пасту передают на стадию амидирования. При получении 1 т ФУСХ
расходуется при разложении 1,4 т воды и около 1 т на промывку, образуется около
4 т 65% серной кислоты и около 1 т газообразного HCl. В Уральском филиале ВНИХФИ
разработана технология, которая позволяет снизить водопотребление. Разложение
реакционной массы осуществляется за счет того, ее выливают на 40 – 50% серную
кислоту. При этом существенно снижается тепловыделение на этой стадии и
улучшается качество целевого продукта. Однако имеется острая проблема утилизации
разбавленной серной кислоты. Была предпринята попытка совместить производство
ФУСХ с получением алкилбензолсульфонатов – СnH2n+1C6H4-SO3Na.
Разложение реакционной массы после завершения хлорсульфирования проводили с
помощью взаимодействия оставшейся хлорсульфоновой кислоты с додециловым спиртом
(n = 12).
HOSO2Cl +
C12H25OH =
HOSO2-O-C12H25
CH3OOC-NH-Ph-SO2Cl +
C12H25OH = CH3OOC-NH-Ph-SO2-
O-C12H25
Но наряду с додецилсульфатом образуется фенилуретилан-4-О-додецилсульфат, от которого не удается очистить целевой продукт.
Еще одна разработка по снижению количества отходов также не дала положительных результатов. Проводили сульфирование фенилуретилана олеумом и после завершения процесса добавляли фосфооксотрихлорид:

Но и в этом случае качество
полученного ФУСХ не отвечало ТУ (техническим условиям).
Выделяющийся в процессе
синтеза ФУСХ газообразный
HCl либо
направляют на другое производство (например папаверина), или поглощают водой с
получением чистой соляной кислоты. По коммуникациям, выполненнм из стекла или
поливинилхлорида, HCl поступает в сборник,
выполняющий функцию демпфера. И далее в углеграфитовый теплообменник типа
«Карабон», в который противотоком поступает 11% соляная кислота. На выходе
получают 25 - 30% кислоту. Не поглотившийся HCl поступает в каскад из двух
абсорберов. Последний орошается водой, а первый раствором слабой соляной кислоты
из последнего абсорбера, вытекающая из него 11% соляная кислота направляется в
сборник и далее на укрепление в теплообменник. Вся аппаратура выполнена из
стекла или поливинилхлорида, так как слабая соляная кислота высоко
коррозионноактивна.
Реакцию сульфохлорирования
используют в синтезе препарата гидрохлортиазид (гипотиазид, дихлотиазид). Это
лекарственное средство обладает гипотензивным и диуретическим эффектом, входит в
состав комбинированного эффективного гипотензивного препарата капозид. Первый
компонент каптоприл подавляет образование ангиотензина II и устраняет его суживающее
действие на кровеносные сосуды. Второй компонент - дихлотиазид за счет своего
диуретического действия вымывает ионы натрия из сосудистой стенки. Синтез
препарата приведен на схеме:

При сульфохлорировании м-хлоранилина на один моль хлоранилина
берут восемь молей кислоты, так как необходимо ввести две сульфохлоридные
группы. Следует отметить, что в отличие от синтеза ФУСХ, аминогруппу в
хлоранилине не защищают, так как ее основность ниже, чем в анилине, и в растворе
хлорсульфоновой кислоты имеется незначительная концентрация основания. Благодаря
наличию равновесия между солью и основанием реакция идет в о- и п-положение к аминогруппе. Для
предотвращения гидролиза сульфохлоридных групп в конце процесса добавляют
хлористый тионил или хлорид натрия. Сульфохлорид быстро отфильтровывают и пасту
передают на амидирование. Замыкание дигидротиазинового цикла ведут в 37%
формалине.
Помимо хлорсульфирования в
ХФП для получения сульфохлоридов используется и окислительное хлорирование
дисульфидов. Например, в синтезе диакарба. Препарат избирательно угнетает
активность карбоангидразы – фермента, участвующего в гидратации и дегидратации
углекислого газа. Применение диакарба в качестве диуретика показано при отеках
на почве сердечно-легочной недостаточности, когда необходимо понизить содержание
CO2 в крови. Его применяют при
лечении глаукомы, а также эпилепсии.
Фрагмент синтеза этого
препарата приведен на следующей схеме:

Окислительное хлорирование
проводят при пониженной температуре в эмалированной аппаратуре. Осадок
сульфохлорида отфильтровывают и пасту без сушки направляют на стадию
амидирования.
При организации производства
продуктов, в синтезе которых используется
сульфирование и сульфохлорирование, необходимо уделять большое внимание
вопросам охраны труда. Многие из исходных веществ токсичны и пожароопасны.
Концентрированная серная кислота, олеум и хлорсульфоновая кислоты при попадании
на кожу вызывают тяжелые химические ожоги. Поэтому вся аппаратура должна быть
выполнена в пожаробезопасном исполнении и хорошо герметизирована. Участок
производства снабжается местной вытяжной вентиляцией и душевой комнатой. При
попадании на кожу серной, а тем более хлорсульфоновой кислоты, вымыть пораженное
место сильной струей воды и раствором соды. Работающие используют суконную
спецодежду, так как шерсть мало разрушается при попадании кислот. При
проектировании необходимо предусмотреть максимальную механизацию, автоматизацию
производства и полное обеспечение современной контрольной и измерительной
аппаратурой. При загрузке кислот в мерники используют погружные насосы, мерник
снабжают линией перелива.
Уходящие токсичные газы –
HCl,
SO2, SO3 улавливают. Наиболее
сложной экологической проблемой является утилизация отработанной серной кислоты.
Для ее решения, особенно при производстве сульфохлоридов, необходима разработка
принципиально новых химических решений. Одним из вариантов утилизации
отработанной кислоты может служить совмещение производства сульфокислот или
сульфохлоридов с получением серной кислоты. Однако и в этом случае должна быть
разработаны способы очистки отработанной кислоты от примесей органических
соединений.