 |
 |
 |
|
||||||||
| Dissertation | Links | Library | Inet search results | |||||
Реакции
конденсации и циклизации.
Реакции конденсации - это реакции образования из простых молекул конденсированных циклических соединений, димеров, олигомеров или полимерных веществ.
Конденсация альдегидов, сложных
эфиров (реакции Кляйзена, Перкина) дает дикетоны, кетокислоты, гидрокси- и
ненасыщенные кислоты:

Для химфармпромышленности наибольшее значение имеют реакции синтеза гетероциклических веществ. Смысл реакции заключается в том, что в результате взаимодействия электрофильного конца цепочки с нуклеофильным фрагментом той же или другой молекулы образуются 5-, 6-, 7- или макрочленный цикл, либо полимерное вещество и при этом отщепляются малые молекулы (вода, сероводород, меркаптаны, спирты, аммиак, амины и т.п.), либо их ионы. Для составления плана синтеза, так же как и при нуклеофильном замещении, чрезвычайно важно предусмотреть все возможные варианты взаимодействия различных фрагментов молекулы. Кроме того необходимо знать общие закономерности построения связей между элементами C, N, S, O. Как никогда ранее при разработке плана синтеза применим ретросинтетический подход. В курсе мы с Вами неоднократно рассматривали реакции конденсации, разбирали какие группировки могут "генетически" возникать из различных фрагментов (например аминогруппа из нитро-, нитрозо- или азогрупп). Также как и при рассмотрении других реакций необходимо учитывать доступность сырья и экологические последствия проведения в зависимости от масштабов производства. Более подробно разберем синтез пуринового алкалоида теофиллина.

Нумерация атомов в молекуле
пуринового гетероцикла является исключением из общих правил: · · 1 - 6
относятся к пиримидиновому циклу, положения атомов 4,5,7-9 к имидазольному
циклу. Расчленим цикл на фрагменты. Пунктирной линией молекула теофиллина
разбита на отдельные части. Рассмотрим первый фрагмент:
1-N-метил-2-карбонил-3-N-метил; совершенно очевидно, что этому фрагменту
соответствует химический эквивалент 1,3-диметилмочевина. В общем случае
при нахождении в молекуле фрагментов N-CO-N с уверенностью в план синтеза
можно закладывать использование производных мочевины. Трехуглеродный
остаток - фрагмент 2- что он Вам напоминает?
O=C-C=C-N
HOOC-CH2-CN
Действительно производное малоновой кислоты: химический эквивалент циануксусная кислота. Прежде чем перейти к фрагментам три и четыре, необходимо сделать одно замечание. Конденсированный цикл имидазопиримидин - пурин - может быть получен вначале из пиримидинового, а имидазольный надстраивается из имидазольного с последующей надстройкой пиримидинового. В данном случае основой построения гетероцикла является пиримидиновый. Из фрагментов один и два уже можно построить пиримидиновый цикл - имеется шесть атомов. Атомы азота мочевины являются нуклеофильными центрами, а атомы углерода карбоксильной и нитрильной групп, имеющие пониженную электронную плотность, электрофильными центрами. Реакция конденсации идет в два этапа. См. раздел реакции ацилирования. Диметилмочевина и циануксусная кислота вступают в реакцию ацилирования в присутствии муравьиной кислоты, в результате которой образуется линейная молекула. На атоме азота мочевины имеется частичный отрицательный заряд, на атоме углерода нитрильной группы положительный. Однако величины этих зарядов недостаточно для прохождения реакции. Необходимо один

из них увеличить. Самым простым
является растворение в щелочи. Группа-NH имеет кислый характер и при
растворении в щелочи на атоме азота возникает целочисленный отрицательный
заряд. Его величины уже достаточно для нуклеофильной атаки по атому
углерода нитрила. В результате нуклеофильного присоединения к нитрильной
группе образуется аминоурацил (иминогруппа переходит в амино, т.к. при
этом происходит ароматизация цикла). Итак первую половину молекулы мы с
Вами синтезировали. Следующий этап - создание имидазольного цикла. В
положение С-5 необходимо ввести атом азота в виде аминогруппы. Аминогруппа
может быть получена из нитро-, нитрозо- или азогруппы. При исследовании
этих трех вариантов оказалось, что наиболее хорошие результаты получены
при нитрозировании. Аминогруппа в положении 6 цикла не диазотируются, т.к.
низка реакционная способность (повезло!). Следующий этап - восстановление
нитрозогруппы (см. хим. схему). За 40 лет существования этого производства
были испробованы все возможные методы. К сожалению трудно остановить
процесс только на восстановлении нитрозогруппы, не затрагивая двойную
связь, а ее восстановление дает в готовом препарате ничтожную примесь,
которая недопустима по своему биологическому действию. Работа
продолжается. Пытаются провести электрохимическое восстановление, но
результаты пока не совсем ясны. Сульфит-бисульфитный метод не дал
результатов - не хватает ОВ-потенциала реактантов восстановления.
Восстановление железом неприменимо из-за невозможности очистить препарат
от солей железа. При небольшом тоннаже (Германия) используют сульфид
аммония, но при увеличении тоннажа (РФ) производство становится
экологически опасным - очень трудно обезвредить большое количество
сероводорода. Долгое время применялось восстановление цинком в муравьиной
кислоте. Формиат цинка, являющийся продуктом реакции, отфильтровывают и
превращают в ценные цинковые белила. В настоящее время на Курском ХФК
внедрено каталитическое восстановление, что безусловно, является
существенно лучшим методом. Для завершения создания конечного продукта
необходимо ввести одноуглеродный остаток. При восстановлени в муравьиной
кислоте реактант уже есть - HCOOH. В процессе восстановления происходит
формилирование образующейся аминогруппы, формильное соединение при
нагревании циклизуется целевой продукт теофиллин. Мы с Вами подробно
разобрали последовательность реакций на одном примере. Для того, чтобы Вы
сумели разработать план ЛЮБОЙ конденсации, обратите внимание на общие
правила введения фрагментов и их происхождение (химические эквиваленты),
которые приведены далее:
Введение одноуглеродного фрагмента
с различными функциональными группами:
Фрагмент гетероцикла: Реагент:
Фрагмент
гетероцикла
Реагент

1.
При введении одноуглеродного
фрагмента с группой -R
реагенты - (см. 2)
2a.

4.

В примерах 1,2 и 4 и других по тексту группы X,Y в
гетероциклическом кольце
могут быть NH, S, O. В примерах 4 и
6 вместо группы NH-гетерцикла могут быть также S и O
6.

7.

В первом примере отщепляемые малые
молекулы - вода или спирт, во втором также вода, в третьем - сероводород,
в четвертом и пятом - аммиак, в шестом - и седьмом вода.
8.

Двухатомные фрагменты (в том числе
и двухуглеродные).с различными функциональными группами:
9. 10
11.

12
.
13.

14.

Примеры 9...14 более подробны будут
рассмотрены при синтезе конкретных
лекарственных препаратов.
Трехатомные фрагменты цикла с
различными функциональными группами:
15.

В первом примере X,Y, R = H, во втором X = =OH, Y =
COOC2H5, R = H

Использование циануксусной кислоты
для введения трехуглеродного фрагмента рассмотрено на примере синтеза
теофиллина.
В синтезе сульфадимезина используют для циклизации
ацетилацетон (3-С.)

Четырехатомные фрагменты,
использующиеся в реакциях конденсации:

Введение -СН= фрагмента в цикл с
помощью муравьиной кислоты было рассмотрено на примере синтеза теофиллина
(замыкание имидазольного цикла).
При получении гипотензивного
препарата дибазол используют конденсацию четырехатомного фрагмента -
о-фенилендиамина с одноуглеродным фрагментом -

фенилуксусной кислотой (реакция 2 общей схемы). Вместо
фенилуксусной кислоты могут быть использованы фенилацетамид или цианистый
бензил. При конденсации нафтилуксусной и этилендиамина ( четырехатомный
фрагмент) получают препарат нафтизин ( тема "ацилирование")
Пример 2а общей схемы может быть
проиллюстрирован на синтезе
препарата акрихин ( противомалярийная активность (в настоящее время
не используется), противоглистный и против лямблиоза). Проводят
конденсацию 2,4-дихлорбензойной кислоты с п-анизидином. Образующийся
хлордифениламинокарбоновую кислоту превращают в замещенный 9-хлоракридин с
помощью кипячения в хлорокиси фосфора. Взаимодействие галогенакридина с
фенолятом натрия дает О-фениловый эфир акридина. Его реакция с
2-аминопентил-5-диэтиламином дает основание акрихина. (Это производство
положило начало одному из мощнейших химфарм предприятий РФ комбинату
"Акрихин"). Следует отметить, что в реакцию нуклеофильного замещения мог
бы вступить и сам 9-хлоракридин, но при этом образуется некоторое количество примесей
дизамещения, освободиться от которых довольно трудно. Поэтому предпочитают
реакцию с менее активным О-фениловым эфиром. Кроме того производные
9-хлоракридина являются лакриматорами и их очистка связана с определенными
трудностями, что немаловажно для производства:

В синтезе промежуточного продукта
получения норсульфазола и нитазола, а именно 2-аминотиазола, используют
трехатомный, одноуглеродный фрагмент (3) с двухуглеродным фрагментом (11)
хлорацетальдегидом:

Использование синтезов 4 (общие схемы) может быть показано
на следующем примере. Конденсируют четырехатомный фрагмент о-фенилендиамин
с мочевиной (фрагм. 4).При сплавлении реагентов образуется
бензимидазолон.

В процессе реакции выделяется две
молекулы аммиака, которые отщепляются из мочевины (нуклеофильная атака
аминогруппы о - фенилендиамина. на атом углерода карбонильной
группы).
При получении противогрибкового
препарата амиказол замыкание
бензтиазольного цикла осуществляют следующим образом

В приведенном синтезе R =
OC2H5, в препарате R =
O(CH2)2N(C2H5)2
.
Использование гуанидина (схемы 18 и
6) в реакциях конденсации позволяет получить гетероцикл с аминогруппой в
кольце. Также аминогетероциклы образуются в результате внутримолекулярной
конденсации при взаимодействии амино- и нитрильной групп (см. синтез
теофиллина).
Рассмотрим использование реакции 7
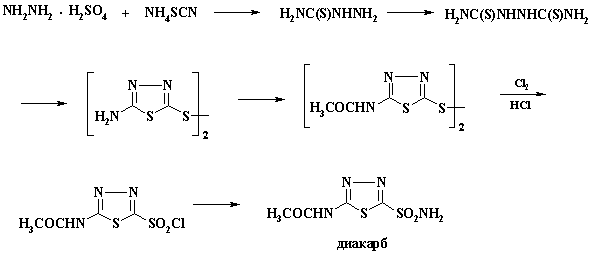
общей схемы на примере получения препарата диакарб (применяется как
диуретическое и противоглаукоматозное средство, а также при эпилепсии). На
первой стадии синтеза из гидразин сульфата образуется тиосемикарбазин (I),
который реагирует в воде при 100оС с второй молекулой
роданистого аммония, давая
гидразодикарботиоамид (II). В конц. серной кислоте происходит циклизация
соединения II в 2- амино-5-меркаптотиадиазин, который при нагревании
окисляется до соответствующего дисульфида. Для получения сульфохлорида проводят окислительное хлорирование дисульфидной группы хлором в соляной
кислоте. Образующийся сульфохлорид превращают в сульфамидв
водном аммиаке. Полный синтез препарата приведен на схеме:
Реакция 8 (общей схемы)
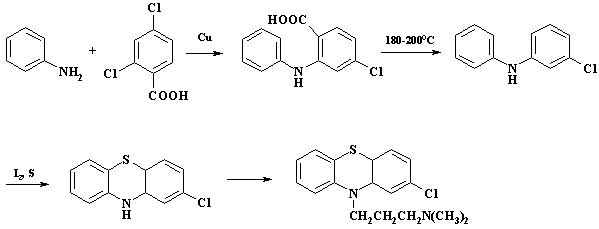
применяется в синтезе
фентиазиновых нейролептиков (седативное действие, понижают температуру
тела, усиливают действие снотворных, наркотических, противосудорожных и
болеутоляющих средств, снижают артериальное давление, существенно
успокаивают ЦНС), в частности препарата "аминазин". Схема получения
аминазина приведена на следующем рисунке
Реакции 9...10 используют для
синтеза производных хиноксалина. (новый препарат энциклан, разработанный
на кафедре органической химии УПИ). Проводят конденсацию о-фенилендиамина
с глиоксалем или его производными.
Реакция 11 рассмотрена в синтезе 2-амитнотиазола (с.5).
Реакции 12, 13. Введение фрагмента
N-N мы с Вами рассмотрели на примере сульфапиридазина и апрессина в теме
"ацилирование". При получении анальгина
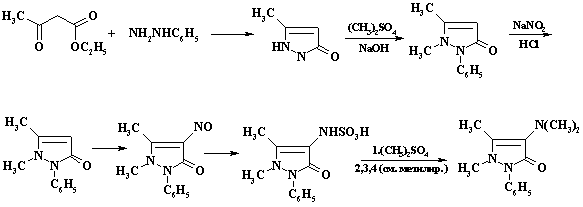
и амидопирина (реакции 13 и 16)
первая стадия включает реакцию конденсации
ацетоуксусного эфира с
фенилгидразином: Образующийся антипирин (1-фенил-3-метилпиразол-5-он)
метилируют в щелочной среде
диметилсульфатом, а затем нитрозируют ( см. лекции по темам нитрозирование
и реакции нуклеофильного замещения у насыщенного атома углерода).
Нитрозогруппу восстанавливают сульфит - бисульфитной смесью. При этом
вводится одновременно защитная сульфогруппа. Последующее метилирование
позволяет ввести только одну метильную группу ! Удаление сульфогруппы и
последующая реакция с формалином и бисульфитом натрия дает анальгин - один
из основных анальгетиков, входящий в состав многочисленных лекарственных
форм.
Более подробно рассмотрим принципы
синтеза на основе фрагмента
=N-O-. Этот остаток входит в состав гетероцикла изоксазола,
приведенный на химсхеме 14 пример разбивки молекулы
3-фенил-4-карбэтокси-5-метилизоксазола ( промежуточный продукт в
синтезе пенициллинового антибиотика "оксациллин") показывает наличие двух синтонов.
Химическими эквивалентами синтонов являются ацетоуксусный эфир и оксим
бензальдегида. Для проведения реакции конденсации необходимо активировать
оба компонента. Это показано на схеме.

Использование циануксусной кислоты
(трехуглеродные фрагменты 15 III) рассмотрено при синтезе теофиллина,
малонового эфира и его производных в синтезе барбитуратов, также широко
применяется и этиловый эфир циануксусной кислоты.
При получении антибиотика
четвертого поколения хинолонового ряда "пефлофлацин" используют реакцию конденсации тип 15(II). Из
малонового эфира и ортоэфира синтезируют этоксиметиленмалонат (соединение
I) (также реакция конденсации!), который при взаимодействии с
4,5-дифторанилином при температуре 2500 С дает
3-карбэтокси-6,7-дифторхинол-4-он, являющийся промежуточным

продуктом в синтезе фторхинолоновых
антибиотиков. Следующими стадиями являются - реакция нуклеофильного
замещения одного из атомов фтора на метилпиперазин, этилирование атома
азота хинолонового цикла и омыление сложноэфирной группировки. Полный
синтез пефлофлацина приведен на схеме. Синтез других
производных этого класса отличается
типом заместителя в положениях 1 и 7. Получение препарата хинозол (тот же тип реакции конденсации)
осуществляют из о-аминофенола и глицерина. В серной кислоте глицерин
превращается в альдегид - акролеин, который реагирует с аминофенолом ( в
данном случае реагирует треха-

томный фрагмент), при этом
происходит реакция конденсация и окисления образуется 8-гидроксихинолин
(схема приведена рядом с синтезом пефлофлацина):
Использование четырехатомного
фрагмента - этилендиамина было рассмотрено в синтезе препаратов клофелин и
нафтизин.
Из приведенных схем, где при
построении гетероциклического ядра используются реакции конденсации,
выпадают синтезы соединений, содержащих пиррольный цикл. В их основу
положена реакция Фишера.

Так при получении
антиаллергического препарата диазолина из фенилгидразина и
1-метилпиперидона-4 получают гидразон, который по реакции Фишера
превращают в карбозолидин:

Производные фурана обычно получают
исходя из доступного сырья - фурфурола. В лекции по нитрованию
рассматривался синтез фурациллина.
Производные пиридина в основном
получают также из готового коксохимического или нефтехимического сырья.
Технологические особенности реакций
конденсации ничем не отличаются от всех других реакций, процесс ведут
всегда периодическим способом.
Заключение: в реакциях
конденсации аккумулированы
практически все реакции, которые мы с Вами рассматривали в курсе лекций.
Для составления плана синтеза необходимо привлечь все свои знания.