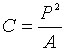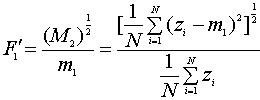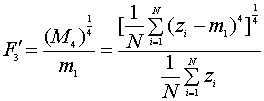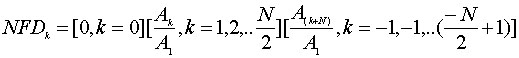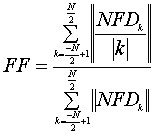АВТОМАТИЗИРОВАННАЯ ПОДСИСТЕМА РАСПОЗНАВАНИЯ И ОКОНТУРИВАНИЯ КЛЕТОК
У статті розглянуто етапи створення автоматизованої підсистеми розпізнання та оконтурювання клітин. Розглянуті засоби покращення якості зображення та приведено засіб порогової фільтрації. Описані засоби виявлення контуру клітини - кластерізація та метод активних контурів. Проведено порівнювальний аналіз роботи засобів на основі розробленого програмного забезпечення приведено інтерфейс програми. За результатами поставлених експериментів зроблені виводи.
Определение жизнедеятельности клеток является актуальной задачей во многих областях медицины, например, при исследовании функционального состояния головного мозга, при трансплантации кожи. Многочисленными исследованиями доказано, что любой патологический процесс, какой бы степенью функциональных нарушений он не проявлялся, начинается на уровне ультраструктур, то есть субклеточном уровне. Знание клеточной патологии помогает специалисту любого медицинского профиля понимать морфологическую сущность того или иного патологического процесса происходящего в тканях и органах, расширяя представления о причинах и механизмах возникновения болезни, особенностях ее течения, позволяет определить и наметить рациональные и эффективные пути их лечения и профилактики. Терапия тяжело обоженных предполагает неоднократное определение жизнеспособности клеток для каждого больного. Обычно оно выполняется на основе цитометрических методов, связанно с большой трудоемкостью и невысокой точностью полученных результатов. Необходимость и целесообразность автоматизации этого процесса показаны в работах [1] и [2]. В этих же работах описаны уже спроектированные подсистема получения цифрового изображения тканей и подсистема определения функционального состояния клеток на основе существующих критериев.
В процессе создания автоматизированной подсистемы распознавания и оконтуривания клеток необходимо решить следующие основные задачи:
- Первичная обработка изображения с целью улучшения его качества.
- Распознавание клеток по цифровому изображению тканей
- Оконтуривание клеток и их ядер.
- Анализ изображения клеток, вычисление основных параметров клеток и их ядер, необходимых для определения жизнеспособности.
Целью первичной обработки является улучшение качества полученного изображения. Снимки, получаемые посредством установки, описанной в [3], как правило, недостаточно четкие и контрастные, а также несут в себе много ненужной информации - шумов (пыль, осевшая на стекла мазков, посторонние включения). Улучшить четкость и контрастность изображения можно аппаратными методами, например заменой видеокамеры, специализированной на съемке изображений под микроскопом. Однако это будет очень дорогостоящий проект и при этом не решается проблема исключения шумов. Поэтому целесообразнее воспользоваться программными методами улучшения качества изображения, реализовав специальный модуль.
Наиболее простой способ фильтрации, который может быть использован для выделения контура клетки - это пороговая фильтрация. Метод базируется на разложении по яркостным характеристикам исходного изображения и выявления пиков, удовлетворяющих определенным условиям, т.е. результатом данного метода будет монохромное изображение, построенное из условия (1):
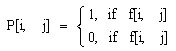 |
(1) |
В результате проведенных экспериментов по использованию пороговой фильтрации применительно к клеткам был получен ряд результатов, позволяющий сделать следующие выводы. Метод пороговой фильтрации основан на анализе яркостных характеристик, но по реальным снимкам мы не можем заранее предугадать какую из составляющих цвета необходимо рассматривать как характерную для данной клетки. Т.е., выделить объект на снимке возможно только при рассмотрении его в RGB формате. После пороговой фильтрации получаются четкие границы объектов - бинарное изображение, но вероятность нахождения границы без значительной погрешности достаточно мала. Последнее объясняется нечеткими и размытыми границами клетки, вследствие зависимости получаемого изображения от различного рода факторов: освещение при проведении съемок, вибрация, качества мазковых стекол, времени суток и пр.
Снимок клетки представляет собой цветной фон (включая артефакты) с менее ярко выраженной цветностью и клетку, цветность которой больше (даже визуально клетка отделима от фона). Только на цветном снимке можно выявить очень важные характеристики жизнедеятельности клетки [2], поэтому клетку необходимо анализировать в первоначальном, исходно-полученном цвете.
При анализе клетка на снимке представляет собой заранее неизвесную цветовую неоднородность и необходимо выявить области с цветовой неоднородностью. Для этих целей был применен гистограммный пороговый фильтр. Метод основан на построении гистограммы интенсивностей по значениям интенсивности каждой составляющей цвета, выявления пиков, удовлетворяющих условиям заданного порога. Результатом данного метода является битовая матрица, построенная из условия:
 |
(2) |
где
G[k, c] - значение пика с интенсивностью k для цвета с,
f[i, j, c] - значение интенсивности i, j пикселя изображения для цвета с,
maxG[0..255, c] - максимальное значение на гистограмме для цвета с,
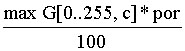 - величина порога по гистограмме для цвета с,
- величина порога по гистограмме для цвета с,
por - пороговое значение, задаваемое в диапазоне [1..99].
Пороговое значение выбирается после визуальной оценки изображения на предмет контрастности (разброса значений интенсивностей цветов) совместно с предполагаемой площадью занимаемой клеткой относительной общего размера снимка.
Данный гистограммный пороговый фильтр имеет большую устойчивость к размытости границ клетки на снимке. Так же на работу фильтра не влияют условия снятия изображения и передачи его на твердые носители. Метод не чувствителен к неоднородностям различного характера: цвет, форма, вкрапления.
Кроме контура клетки на отфильтрованном изображении находится большое количество помех, которые необходимо устранить. Для этого используется свойство изображения клетки - замкнутость ее контура. С целью выделения замкнутых областей производится кластеризация (выделение групп по определенному признаку - принадлежность элемента объекту или фону) изображения по принципу 4-х связности. Т.е. для отдельно взятого пикселя 4-х связным является соседний пиксель, координата которого в двумерной плоскости отличается на единицу. По сравнению с кластерами, содержащими артефакты, кластер клетки значительно больше и по данному признаку на изображении выделяется сама клетка. Т.о. обработанное изображение представляет собой кластер объекта и кластер фона.
Дальнейшая обработка изображения клетки сводится к выделению ее контура. Пиксель объекта принадлежит контуру если он граничит с пикселем фона. Выделение границы объекта сводится к анализу пикселей объекта, которое производится по принципу 8-ми связности с пикселями фона. Полученная граница клетки используется в дальнейшем для расчета параметров клетки.
Еще одним из перспективных и современных методов выделения контура объекта на изображении является метод активных контуров. Алгоритм метода заключается в следующем: производится деформация контура, с целью заключения внутри его области, которая содержит пиксели объекта [4].
С помощью метода активных контуров можно найти границу объекта на изображениях, в том случае, если начальная граница изображения задается пользователем или другим способом, возможно автоматизированным. Точки в контуре стремятся к границе объекта при минимизации энергии контура. Для каждой отметки в окрестностях vi, значение энергии находится как:
Ei = 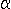 *
Eint(vi) + *
Eint(vi) + 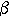 *Eext(vi),
*Eext(vi), |
(3) |
где Eint(vi) является функцией энергии, зависящей от формы контура, и Eext(vi) является функцией энергии, зависящей от свойств изображения и типа градиента в окрестности точки vi. 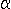 и
и
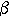 являются константами, обеспечивающими относительную коррекцию величин энергии.
являются константами, обеспечивающими относительную коррекцию величин энергии.
Ei, Eint(vi), Eext(vi) являются матрицами. Значение в центре каждой матрицы соответствует энергии контура в отметке vi. Другие значения в матрицах соответствуют энергии в каждой отметке в окрестностях vi. Каждая отметка vi стремится в vi', соответствующей положению минимального значения в Ei. Этот процесс иллюстрируется на рисунке 1. Если функции энергии выбраны правильно, то контур V должен приблизиться и остановиться на границе объекта.
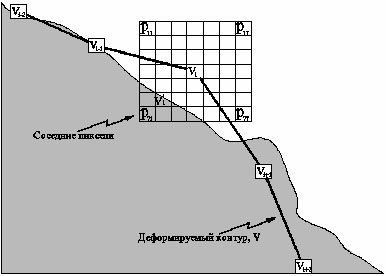
Рис. 1. Пример движения отметки vi в активном контуре. Отметка, vi', является расположением минимальной энергии из-за большого градиента.
Метод активных контуров реализован с использованием начального контура, полученного в результате работы гистограммного порогового фильтра и кластеризации изображения.
Вышеперечисленные методы легли в основу программного продукта на языке программирования C++ Builder. Программа производит анализ изображений клеток крови после проведения НСТ-теста. В результате данного теста клетки крови (нейтрофилы) поглощают гранулы нейтросинего тетразолия. Для определения показателей НСТ-теста рассчитывается процентное соотношение площадей клетки и гранул внутри клетки. Подронее методика проведения НСТ-теста и его применение в медицине описано в [1]. Для расчета указанных площадей необходимо выделить контуры клеток и гранул нейтросинего тетразолия. Выделение контуров производится 2-мя вышеописанными способами.
Анализ работы данного программного обеспечения показал, что метод активных контуров применительно к снимкам клеток полученного качества дает большую погрешность в определении границ. Это можно объяснить малым градиентом в области границы клетки (из-за размытости границ и сливания границ с фоном), а также наличием помех в окрестностях контура. Поставленные эксперименты показали, что при проведении поиска границы клетки методом активных контуров в лучшем случае погрешность достигает 7,4%. Поэтому данный метод более эффективно применять к изображениям клеток, которые имеют четкие границы.
Дальнейшим развитием направления обработки изображения клетки стал поиск ядра клетки. Методика поиска ядра использовалась та же. Исключением стали границы выбора порога для выделения области неоднородностей занимаемых ядром, а так же область, подвергшаяся обработке. Гарантированность нахождения ядра и максимальную точность обеспечивает предопределенная плотность ядра относительно других органоидов клетки и его целостность.
В результате всего вышеописанного материала был разработан программный продукт, позволяющий найти контур клетки двумя способами (кластеризация отфильтрованного изображения и метод активных контуров), выделить ядро клетки внутри найденного контура и рассчитать параметры клетки по каждому контуру в отдельности. Интерфейс программного продукта приводится ниже на рисунке 2.
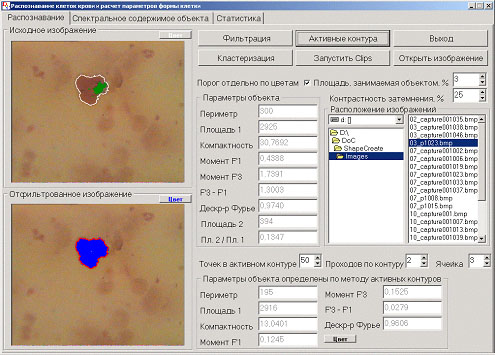
Рис. 2. Интерфейс программы распознавания и оконтуривания клеток.
Кроме выделения контура клетки вышеописанными методами для выяснения формы объекта (клетки) программа рассчитывает следующие параметры :
- по контуру выявленного методом кластеризации: периметр клетки, площадь клетки, площадь гранулы внутри клетки, отношение площадей клетки и гранулы, компактность, момент F'1, момент F'3, F'3-F1, дескриптор Фурье;
- по контуру выявленного методом активных контуров: периметр клетки, площадь клетки, компактность, момент F'1, момент F'3, F'3-F1, дескриптор Фурье.
Компактность. Простое, неразмерное определение компактности фигуры, С, выглядит так:
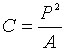 |
(4) |
где P - это длина периметра области и А - площадь области.
Моменты. Одномерные статистические моменты извлекаются из последовательного представления границ области или объекта. Границы характеризуются упорядоченной последовательностью, которая представляет Евклидовы расстояния между центроидом области и всеми контурными пикселями оцифрованного объекта. Моменты безмерные величины. Это позволяет использовать прямое сравнение или комбинированное. Чем больше значение, тем неровнее (шероховатее) контур фигуры. Моменты первого и третьего порядка вычисляются по формулам:
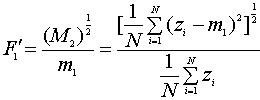 |
(5) |
| |
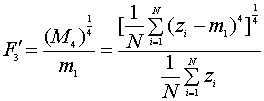 |
(6) |
где
zi - Евклидовы расстояния, i=1..N,
m1 и M2 - моменты первого и второго порядков.
Дескрипторы Фурье. Чтобы использовать дескрипторы Фурье для анализа формы были устранены такие его первоначальные зависимости как: зависимость от месторасположения, размера, направлении начальной точки контура.
В разработанном программном обеспечении компоненты Фурье вычисляются с использованием алгоритма быстрого преобразования Фурье. В этом случае, нормализованные дескрипторы Фурье (NFD(k,)k=-N/2+1,..,N/2) получаются как
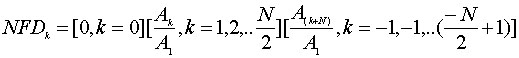 |
(7) |
Нормализованные величины дескрипторов Фурье в любой одной категории очень похожи и для разных типов фигур достаточно различны для того, чтобы помочь в классификации. Вводим еще одно измерение:
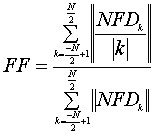 |
(8) |
Выводы. Разработанное программное обеспечение позволяет выполнять оконтуривание клеток и составных частей (гранул нейтросинего тетразолия) по введенному в компьютер изображению клетки. Это позволяет рассчитывать параметры клетки, необходимые для определения жизненной активности клеток. Исследования методов активных контуров и метод кластеризации изображения после обработки гистограммным пороговым фильтром показали, что большей точностью при обработке реальных снимков клеток крови обладает метод кластеризации. Разработанное программное обеспечение использовано при создании подсистемы распознавания и оконтуривания клеток.
Литература
- Спорыхин В. Я, Адамова Е. В. Автоматизация процесса исследования функционального состояния клеток // Наукові праці ДонДТУ, Донецьк, 2001, випуск 25, с. 110-116
- Спорыхин В.Я., Адамова Е.В., Герасимов И. Г. Выбор критерия определения жизнеспособности клеток для автоматизированной системы диагностики //Наукові праці ДонДТУ, Донецьк, 2000, випуск 20, с. 224-230
- Спорыхин В. Я, Адамова Е. В. Автоматизированная система определения жизнеспособности клеток. // Наукові праці ДонНТУ, Донецьк, 2002, випуск 38, с. 110-114
- M. Stella Atkins, Professor, Intracranial Boundary Detection and Radio Frequency Correction in Magnetic Resonance Images
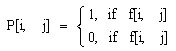
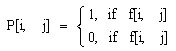

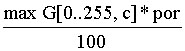 - величина порога по гистограмме для цвета с,
- величина порога по гистограмме для цвета с,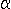 *
Eint(vi) +
*
Eint(vi) + 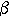 *Eext(vi),
*Eext(vi),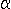 и
и
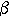 являются константами, обеспечивающими относительную коррекцию величин энергии.
являются константами, обеспечивающими относительную коррекцию величин энергии.