|
|
ДИССЕРТАЦИЯна тему магистерской работы:"Обоснование структуры канала измерения концентрации оксида углерода инфракрасного газоанализатора средствами имитационного моделирования" Вовны Александра ВладимировичаРуководитель к.т.н. доцент кафедры "Электронные системы" Хламов Михаил Георгиевич |
ПРИЛОЖЕНИЕ А
ЭЛЕМЕНТЫ СПЕКТРАЛЬНОЙ ТЕОРИИ ПОГЛОЩЕНИЯ ИК-ИЗЛУЧЕНИЯ ГАЗАМИ
Методы качественного и количественного анализа состава веществ, основанные на способности веществ избирательно поглощать оптическое излучение, получили широкое применение при решении всевозможных аналитических задач в промышленности, научных исследованиях и при контроле за состоянием окружающей среды. Указанные методы являются разделом абсорбционной спектроскопии. Спектры поглощения характеризуют строение поглощающего вещества, тогда как решение аналитических задач требует знания не всего спектра, а лишь отдельных, наиболее характерных для определяемых компонентов среды интервалов частот.
Энергию изолированной молекулы можно представить в виде:
| (А-1) |
где учтены энергия поступательного движения, которая зависит от скорости движения и может принимать любые значения, а также энергия электронов валентного уровня, энергия колебательного и вращательного движения молекулы (все последние принимают только значения квантовых уровней).
Рассматривая и учитывая взаимодействие различных видов движения молекул, баланс энергии принимает вид:
| (А-2) |
здесь последние три члена учитавают взаимодействие различных видов движения молекулы.
Величины электронной, колебательной и вращательной энергий молекулы имеют различный порядок. Энергия электронных переходов имеет порядок нескольких электроновольт, колебательная энергия измеряется десятыми и сотыми долями электроновольт, вращательная энергия - тысячными и десятитысячными долями электроновольт. Соответственно величине энергии электронные спектры занимают ультрафиолетовую и видимую части спектра, колебательные - ближнию инфракрасную, вращательные - далекую инфракрасную и микроволновую. Поскольку в процессе движения молекулы и ее взаимодействия с другими молекулами происходит изменение одновременно всех трех составляющих энергии одновременно, то в чистом виде колебательные спектры не проявляются. Таким образом, в зависимости от диапазона длин волн мы имеем дело либо с электронно-колебательно-вращательными, либо с колебательно-вращательными, либо с чисто вращательными спектрами. Колебательно-вращательная полоса содержит некоторое множество спектральных линий поглощения.
Cпектр одиночной линии. Квантовая механика дает следующее выражение для контура спектральной линии:
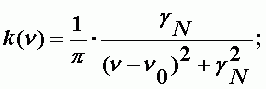 | (А-3) |
gN - естественная ширина линии; определяется на уровне 0.5;
Уширение спектральной линии за счет эффекта Доплера. Имеет место максвеллово распределение молекул по скоростям. Для контура спектральной линии получается выражение:
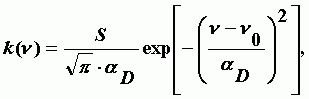 | (А-4) |
где S - интенсивность линии;
aD- доплеровская полуширина спектральной линии;
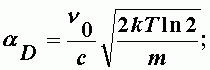 | (А-5) |
где Т - абсолютная температура;
m - масса молекулы;
с - скорость света;
k - постоянная Больцмана.
Для линии вращательной полосы H2O около 200 см-1:
aD = 3,5·10-4 см-1.
Уширение спектральной линии за счет столкновений молекул. Этот параметр напрямую обусловлен давлением: с ростом давления растет интенсивность столкновений. Теория Лоренца дает следующее описание спектральной линии (в литературе часто называемым дисперсионным контуром):
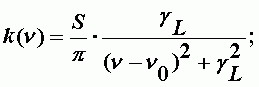 | (А-6) |
Полуширина линии:
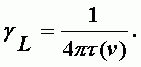 | (А-7) |
здесь t(n) - время жизни в возбужденном состоянии поглощающей или излучающей молекулы, зависящее от ее скорости. Обычно это устанавливается через среднюю скорость молекул и времени жизни. Из кинетической теории газов получается выражение, которое в основном соответствует квантовомеханической неадиабатической теории уширения спектральных линий давлением Андерсона (1949 г.):
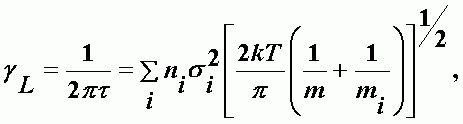 | (А-8) |
где ni - концентрация молекул i - го типа; si - эффективное расстояние между возбужденной молекулой и молекулой i - го типа; m и mi - массы указанных молекул.
Для двухкомпонентной смеси полуширина линии записывается в более простой форме:
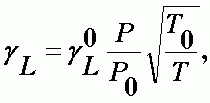 | (А-9) |
где gL0 - полуширина линии при стандартных условиях (Р = 1 атм, Т0 = 2730К). Наиболее вероятное для атмосферных газов значение gL0 = 0.08 см-1.
Совместное действие эффектов Доплера и столкновений молекул. В атмосфере оба эффекта работают одновременно, но в нижних слоях (до 7 км) преобладает эффект столкновений, далее действие обоих эффектов оказывается одинаковым (7 … 37 км), еще выше преобладает эффект Доплера (> 40 км).
Совместное рассмотрение двух эффектов уширения спектральных линий приводит к следующему выражению для коэффициента поглощения:
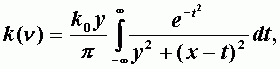 | (А-10) |
| где |  |
Интенсивность спектральной линии. Записывается через коэффициент поглощения k(n):
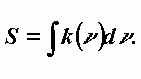 | (А-11) |
Квантовая механика для интенсивности отдельного перехода молекулы из состояния с индексом j в состояние, характеризуемое индексом i, дает следующее выражение:
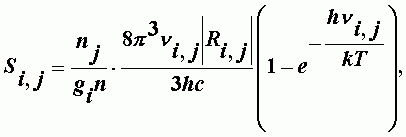 | (А-12) |
где nj - концентрация молекул в нижнем состоянии; n - концентрация всех молекул; gi - статистический вес; ni,j - частота перехода; Ri,j2 - квадрат матричного элемента дипольного момента; Т, h, k, c - абсолютная температура, постоянные Планка, Больцмана и скорость света.
Нахождение матричных коэффициентов - сложная задача. Эти коэффициенты связаны с известными коэффициентами Эйнштейна Аi,j, характеризующими вероятности вынужденного излучения и поглощения между уровнями молекулы с индексами i и j:
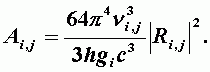 | (А-13) |
Для электрического дипольного излучения величины Аi,j, имеют порядок 108, 10 и 1 сек-1 для электронных, колебательных и вращательных переходов соответственно.
Спектральная полоса поглощения. Каждому электронному состоянию соответствует сетка колебательных энергетических уровней, характеризуемых определенным значением колебательного квантового числа n. В свою очередь каждому колебательному уровню соответствует серия вращательных уровней, характеризуемых определенным значением вращательного квантового числа j.
Из рис. А.1 следует, почему электронные и колебательные переходы в молекуле не могут наблюдаться в чистом виде. В ансамбле молекул имеем дело с их статистическим распределением по величине электронной, колебательной и вращательной энергии. При каждом электронном переходе одновременно меняются колебательная и вращательная энергии. Вся совокупность электронных переходов образует электронно-колебательно-вращательный спектр, интенсивность линий которого определяется распределением молекул по энергетическим уровням и вероятностям соответствующих переходов.
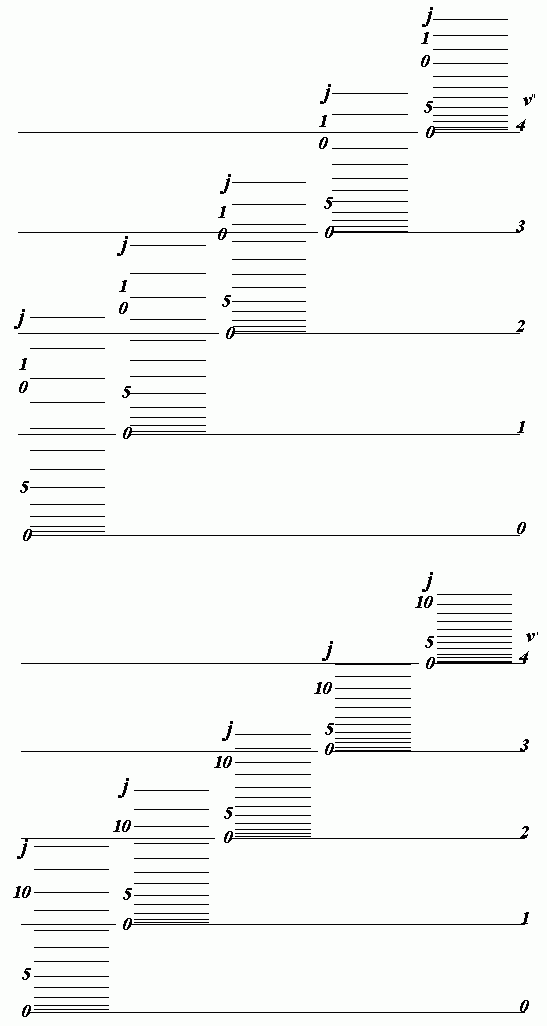 |
| Рис. A.1 - Схема колебательных и вращательных уровней двух электронных состояний молекулы (один и два штриха, что соответствует верхнему и нижнему электронным состояниям молекулы). |
Электронно-колебательно-вращательный спектр представляет собой набор полос. Каждой совокупности переходов молекулы между двумя электронными состояниями соответствует электронная полоса, состоящая из набора колебательно-вращательных полос. Высокие колебательные уровни могут перекрываться нижними уровнями соседнего более высокого электронного состояния. Это усложняет характер спектра.
Вращательная энергия. Вращающаяся молекула рассматривается как твердое тело - жесткий волчок. Особенности вращения молекулы определяются главными моментами инерции относительно трех осей.
Линейные молекулы. Энергия вращения:
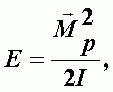 | (А-14) |
где Mp2 - квадрат момента количества движения, I - момент инерции относительно оси вращения, перпендикулярной оси молекулы и проходящей через ее центр тяжести,
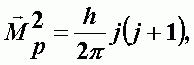 | (А-15) |
h - постоянная Планка, j - вращательное квантовое число, j = 0, 1, 2, 3, …
Квантовая энергия молекулы:
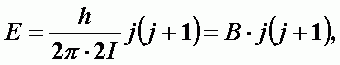 | (А-16) |
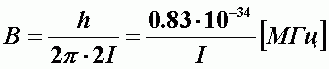 | - вращательная постоянная молекулы. |
Расстояние между последовательными уровнями энергии
| | (А-17) |
пропорционально величине j.
Число молекул с данным j при тепловом равновесии определяется как:
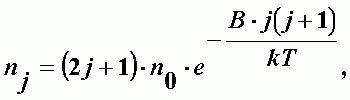 | (А-18) |
n0 - число молекул в состоянии j = 0.
Молекулы типа сферического волчка. Простейший тип нелинейных молекул. Уровни вращательной энергии определяются той же формулой, что и линейные молекулы. Но у них больше число степеней свободы. Распределение молекул по вращательным состояниям:
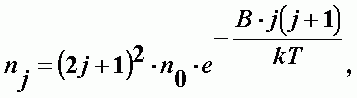 | (А-19) |
Молекулы типа асимметричного волчка. Для молекул типа асимметричного волчка:
| | (А-20) |
A, B, C - вращательные постоянные молекулы соответственно по осям.
Асимметрия волчка:
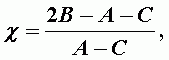 | (А-21) |
для вытянутого волчка c = - 1 ; при B=(A+C)/2 (наиболее асимметричный волчек) c = 0 ; для воды c = - 0,430.
Спектры молекул очень сложны. Разрешены переходы Dj = 0, ±1. При этом переходам с Dj = 0, +1, -1 соответствуют Q, R, и P ветви.
Колебательная энергия молекул. Молекула содержащая N атомов имеет 3N степеней свободы. Из них 3 приходится на поступательное движение центра тяжести молекулы, 3 или 2 - на вращательное движение. Линейные молекулы имеют 2 степени свободы вращательного движения, нелинейные молекулы - 3 степени свободы. Нелинейная молекула имеет 3N-6 степеней свободы колебательного движения и в общем случае столько же различных частот колебаний. У линейной молекулы 3N-5 степеней свободы и частот колебаний. У симметричных молекул некоторые частоты совпадают вследствие вырождения.
Простейшей моделью колебательного движения молекулы является гармонический осциллятор. Для этой модели квантовая механика дает выражение колебательной энергии:
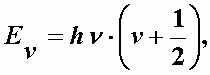 | (А-22) |
где 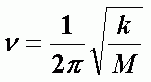 - частота колебаний, n - колебательное квантовое число, n = 0, 1, 2, 3, … , k - константа квазиупругой силы, М - масса осциллятора.
- частота колебаний, n - колебательное квантовое число, n = 0, 1, 2, 3, … , k - константа квазиупругой силы, М - масса осциллятора.
Разность энергий соседних уровней равна:
| | (А-23) |
Уровни энергии находятся на одинаковом расстоянии.
Разрешены переходы Dn = ± 1 между соседними уровнями с одной и той же частотой. Для двухатомной молекулы колебательная энергия молекулы:
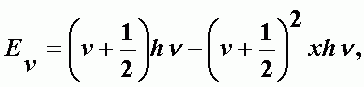 | (А-24) |
x - постоянная ангармоничности. Так для молекулы состоящей из разных атомов для колебательных частот nk имеем:
| | (А-25) |
где n11 и n1 - колебательные квантовые числа верхнего и нижнего состояний молекулы. Например, для серии , начинающейся с нулевого уровня (n1 = 0), получим: nk(0, n11) = n(1-x)n11 - nxn112, откуда следует совокупность частот колебательных переходов и, следовательно колебательно-вращательных полос:
| | (А-26) |
Расстояние между соседними линиями с ростом n11 и частоты убывает. Линии сходятся к границе соответствующей диссоциации молекулы.
Взаимодействие колебаний и вращения молекулы учитывается с помощью вращательной постоянной, являющейся функцией колебательного квантового числа n:
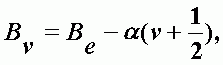 | (А-27) |
Be - вращательная постоянная неколеблющейся молекулы; a - постоянная, отношение которой к Be не превышает нескольких сотых. Be линейно убывает с ростом квантового числа. Энергия перехода между двумя уровнями:
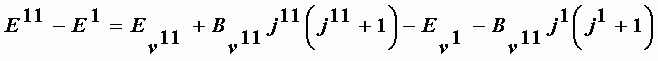 | (А-28) |
Разность E11-E1=n00 определяет частоту чисто колебательного перехода (частоту нулевой линии) j11 = j1 = 0. Переход, соответствующий нулевой линии запрещен. Положение этой линии определяется расчетным путем. Переходы, определяемые разностью энергий уровней, порождают следующие ветви полос колебательно-вращательного спектра:
при Dj11 = j1 = + 1 переходы образуют R ветвь,
при Dj11 = j1 = + 0 переходы образуют Q ветвь,
при Dj11 = j1 = - 1 переходы образуют P ветвь.
Для Q ветви получаем частоты переходов
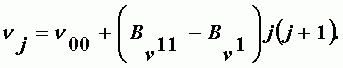 | (А-29) |
Так как разность Bn11-Bn1 очень мала, линии Q ветви расположены очень близко. ИК-полосы делят на параллельные и перпендикулярные по совпадению или перпендикулярностью направления дипольного момента с направлением оси симметрии молекулы. Перпендикулярная структура создает в центре полосы максимум поглощения. Параллельная - минимум (отсутствие Q ветви).
Линейные молекулы. Имеются как параллельные, так и последовательные молекулы. Спектры имеют ранее описанную структуру.
Сферический волчок. Положение вращательных линий в колебательно-вращательной полосе имеет тот же характер, что и для линейных молекул. Полосы поглощения состоят из трех ветвей. Взаимодействие колебательного и вращательного движений обуславливает расщепление трижды вырожденных колебаний.
Асимметричный волчок. Молекулы имеют сложные колебательные и колебательно-вращательные спектры. Сложный выбор разрешенных квантовых чисел с учетом трех постоянных, асимметричности, ангармоничности колебаний, центробежного растяжения, резонансного возмущения уровней энергий, влияния сил Кориолиса. Могут возникать параллельные и последовательные полосы.
|
|