
Истомин А. Л., Семенов Н. С., Спицын Н. В.
Реакции хинолиний-(1')-4-хлор-5-формилтиазол-2-олятов с азот- и серасодержащими нуклеофилами. Синтез конденсированных производных 2-окситиазола.
Изучены реакции хинолиний-(1')-4-хлор-5-формилтиазол-2-олятов с акридином, N-метилимидазолом, 2,3-нафтилендиамином, перхлоратом 1,2-диаминопиридиния, 2-аминотиазолом, тиомочевиной. Получены новые гетероциклические системы: 1,2-дигидро-12-Н-тиазоло[5,4-f]нафто[2,3-b]-1,4-диазепин-2-он, перхлорат 2-оксо-1,2-дигидро-11Н-пиридо[1,2-b]тиазоло[4,5-е]-1,2,4-триазепиния, бис-тиазоло[3,2-а;5',4'-е]пиримидиний-2-олят, 2-окситиазоло[4,5-d]-2-аминотиазин.
A.L. Istomin, N. S. Semenov, N.V. Spitsyn. The reactions of qins-(1')-4-cloro-5-formilthiazoline-2-one with nitrogen and sulfur nucleophiles.
The reactions of qins-(1')-4-cloro-5-formilthiazoline-2-one with N-metilimidazole, 2,3-naftilendiamine, 1,2-diaminopyridinium, 2-aminothiazole, thiourea are studied. The approaches to the synthesis of new geterocycles systems: 1,2-dihidro-12-H-thiazolo[4,5-f]nafto[2,3-b]-1,4-diazepiniue-2-on, of 2-oxo-1,2-dihidro-11H-pyrido[1,2-b]thiazolo[4,5-e]-1,2,4-triazepinium derivatives, bis-thiazolo[3,2-a;5',4'-e]pyrimidinium-2-ol, 2-oxothiazolo[4,5-d]-2-aminothiazine.

В пользу отсутствия межядерной связи в солях (2а, б) свидетельствует отсутствие полосы поглощения в области 1555 см-1, присутствующей в исходном соединении (1) (плоскостные деформационные колебания NH-группы циклических амидов - полоса амид II [6]), низкочастотное смещение С=О колебаний формильной группы по сравнению с исходным соединением (1), связанное с уменьшением степени двоесвязанности С=О связи за счет делокализации отрицательного заряда в азольном фрагменте с участием альдегидной группы, а также появление полос в области 2400-2700 см-1 (и в более низкочастотной области), относимых к "аммониевым" полосам [7], указывает на наличие протонированного азина, т.е. азиниевого катиона.

Таким образом, если предложенная на основании рассмотрения ИК-спектров структура солей (2а, б) справедлива, им должны быть присущи три типа реакций. Первый тип - реакции обмена катиона с образованием новых солей типа (2), если связь С-Cl в 4-хлор-5-формилтиазол-2-олят анионе пространственно недоступна для атаки нуклеофилом; второй - реакции с образованием нового бетаина, если связь С-Cl пространственно доступна для атаки нуклеофилом (реакция с N-метилимидазолом). Третий тип - реакции с бинуклеофилами, затрагивающие связь С-Cl и С=О альдегидной группы с достраиванием семичленного цикла (реакции с 2,3-нафтилендиамином, 1,2-диаминопиридиний перхлоратом) или с достраиванием шестичленного цикла (взаимодействие с 2-аминотиазолом, тиомочевиной).
Как следует из экспериментальных данных, соединения (2а, б) могут быть использованы в синтезе новых бигетероциклических азолий-азолятных бетаинов (4), для получения новых конденсированных гетероциклов, содержащих ядро тиазол-2-она (5-8), что подтверждает правильность интерпретации данных ИК-спектроскопии.

Интересной особенностью соли (2б) является способность к более глубокому протеканию реакции с акридином, где после образования продукта "обмена катиона" - акридиний-(10')-4-хлор-5-формитиазол-2-олята, был выделен продукт гетарилирования акридина-9-хинолин-4-илметил-9,10-дигидроакридин (3).
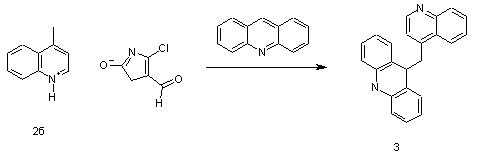
В известных реакциях [8,9] акридинилгетарилметаны образуются в сравнительно жестких условиях (температура выше 120 oС, в присутствии окислителей - серы или кислорода), а соединение (3) предполагалось как интермедиат.
Синтез и реакции бетаинов типа (3а, б) авторы считают целесообразным рассмотреть в отдельном сообщении, поэтому их получение и константы их характеризующие не приводят.
ИК-спектры записаны на спектрометре UR-20 (суспензия в вазелиновом масле).
Спектры ПМР сняты на приборе "Gemini-200" с рабочей частотой 200 МГц.
Температуры плавления полученных соединений определены с использованием микронагревательного столика типа "Боэтиус".
4-Хлор-5-формилтиазолин-2-он (1). Синтезирован по разработанной ранее методике [4].
Хинолиний-(1')-4-хлор-5-формилтиазол-2-олят (2а). В 5 мл абсолютного димелформамида растворяют 1,63 г (10 ммоль) 4-хлор-5-формитиазолин-2-она (1) и добавляют 30 ммоль свежеперегннаного хинолина и, после перемешивают от руки, выдерживают реакционную массу прикомнатной температуре 5 мин. Осадок отделяют, промывают небольшим количеством смеси диметилформамид-эфир (1:2), а затем двумя порциями абсолютного эфира. Выход 1.35 г или 46%. Т.пл. 128-130 oС. Безцветные кристаллы. Найдено, %: С 53.19, Н 3.30, Cl 12.18, N 9.70, S 11.02. С13Н9CIN2О2S. Вычислено, %: С 53.34, Н 3.10, Cl 12.11, N 9.57, S 10.95.
4-Метилхинолиний-(1')-4-хлор-5-формилтиазол-2-олят (2б). Получен анологично соединению (2а). Выход 63%. Т.пл. 136-138 oС. Бехцветные кристаллы. Найдено, %: С 54.62, Н 3.72, Cl 11.44, S 10.40. С14Н14CIN2О2S. Вычислено, %: С 54.81, Н 3.61, Cl 11.56, N 9.13, S 10.45.
Величины химсдвигов протонов б, м. д. для соединения (2а): 9.48 (с., 1Н, СНО), 8.92 (д., 1Н, НС2), 8.47 (д., 1Н, НС4), 8.03-7.43 (м., 5Н, НС3, НС5-НС8),7.87 (с., 1Н, НN+)/стандарт ДМСО-D6/; для соединения (2б): 9.63 (с., 1Н, СНО), (д., 1Н, НС2), 8.46-7.84 (м., 5 Н, НС3, НС5-НС8), 4.30 (с., 1Н, НN+)/стандарт ГМДС/.
9-Хинолин-4-илметил-9,10-дигидроакридин (3). К 0.31 г (1 ммоль) 4-метил-хинолиний-(1')-4-хлор-5-формилтиазол-2-олята (2б) в 5 мл спирта при перемешивании магнитной мешалкой добавляют 0.54 г (3 ммоль) акридина. Вслед за появлением интенсивного кроваво-красного окрашивания реакционной массы выпадает оранжево-желтый осадок, который при дальнейшем перемешивании смеси постепенно растворяется. Через 16 часов отфильтровывают белые со слегка зеленоватым оттенком кристаллы. Выход 0.14 г (42%). Т.пл. 223-224 oС (из этанола). Найдено, %: С 85.51, Н 5.81, N 8.54. С23Н18N2. Вычислено, %: С 85.68, Н 5.63, N 8.69.
Спектр ПМР (CF3COOH) б, м. д.: 8.02 (м., 14Н, аромат.), 6.62 (т., 1Н, НС9 акридин), 5.82 (д., 2Н, СН2- группа)/стандарт ТМС/.
5-Формил-4-(3-метилимдазолио-1)-тиазол-2-олят (4). К 2.90 г (10 ммоль) соединения (2а) в 15 мл этанола добавляют 1.67 мл (20 ммоль) N-метилимидазола и выдерживают при комнатной температуре в течение суток. выпавшие кристалы отфильтровывают, промывают, поочередно, 5 мл холодного этанола и 10 мл эфира. Выход 1.42 г (68%). Т.пл. 250-252 oС. Найдено, %: С 46.01, Н 3.50, N 20.12,S 15.21. С8Н7N3О2S. Вычислено, %: С 45.93, Н 3.37, N 20.08, S 15.32. Спектр ПМР (СF3COOH), б, м. д.: 9.65 (с., 1Н, СНО), 9.33 (с., 1Н, НС2), 7.98 (д., 1Н, НС4), 7.40 (д., 1Н, НС5).
1,2-Дигидро-12-Н-тиазоло[5,4-f]нафто[2,3-b]-1,4-диазепин-2-он (5).
К 0.29 г (1 ммоль) соединения (2а) в 10 мл этанола добавляют 0.16 г (1 ммоль) 2,3-нафтилендиамина. Смесь нагревают при слабом кипении спирта в течении 10 минут. Выпавший красновато-коричневый осадок отфильтровывают, промывают спиртом, кипящей водой и снова спиртом. Выход 0.21 г (80%). Найдено, %: С 63.02, Н 3.50, N 15.81, S 12.29. С14Н9N3ОS. Вычислено %: С 62.91, Н 3.39, N 15.72, S 12.00. Спектр ПМР (ДМСО-D6), б, м. д.: 10.03 (с., уширенный, 1Н, NH диазепина), 9.64 - 9.60 (д., 1Н, NH-C=C-H, J=8 Гц), 7.52-7.58 (м., 2Н, арамот.), 7.28-7.18 (м., 2Н, аромат.), 7.08 (с., 1Н, аромат.), 6.92 (с., 1Н, аромат.), 6.66-6.62 (д., 1Н, НС=С-NH, J=8 Гц).
Перхлорат 2-оксо-1,2-дигидро-11Н-пиридо[1,2-b]тиазоло[4,5-е]-1,2,4-триазепиния-(6).
К 1.45 г (5 ммоль) хинолиний-(1')-4- хлор-5-формилтиазол-2-олят (2а) в 10 мл этанола добавляют 2.10 г (10 ммоль) 1,2-диаминопиридиний перхлората и нагревают, поддерживая легкое кипение, в течение 2 часов. После охлаждения в течение 2 часов осадок отделяют, промывают небольшим количеством холодного спирта, а затем эфира. Выход 0.67 г (42%). Крупные оранжево-желтые кристаллы в виде табличек с Т.пл. 166-168 oС (с разл. из пропанола). Найдено, %% С 34.11, Н 2.40, Cl 10.94, N 17.49, S 9.83. С9Н7ClN4О5S. Вычислено, %: С 33.92, Н 2.21, Cl 11.12, N 17.58, S 10.06. Спектр ПМР (ДМСО-D6), б, м. д.: 9.90 (с., 1Н, NH амида), 8.78-7.88 (м., 5Н, аромат.), 7.65 (с., уширенный, 1Н триазепина).
Бистиазоло[3,2-а;5',4'-е]-пиримидиний-2-олят (7). К 1.45 г соединения (2а) в 10 мл этанола добавляют 1.00 г (10 ммоль) 2-аминотиазола и кипятят с обратным холодильником в течение 15 мин. После охлаждения при комнатной температуре в течение 2 часов отфильтровывают белые со слегка розовым оттенком кристаллы. Выход 0.63 г (60%). Т.пл. 209-210 oС (из абс. ДМФА). Найдено, %: С 40.28, Н 1.55, N 20.20, S 30.43. С7Н3N3ОS2. Вычислено, %: С 40.18, Н 1.45, N 20.08, S 30.65. Спектр ПМР (ДМСО-D6), б, м. д.: 8.59 (с., 1Н, НС=N), 8.30 (д., 1Н, НС5 тиазола), 8.00 (д., 1Н НС4 тиазола)/стандарт ТМС/.
2-Окситиазоло[4,5-d]-2-аминотиазин (8). К 2.90 г (10 ммоль) соединения (2а) в 30 мл этанола добавляют 0.76 г (10 ммоль) тиомочевины и, при перемешивании магнитной мешалкой, реакционную массу выдерживают при комнатной температуре в течении 6 часов. Выделившийся обьемный осадок зеленовато-желтого цвета отфильтровывают, промывают небольшим количеством этанола, эфира. Выход 1.33 г (72%). Т.пл. 305-305 oС (из абс. ДМФА). Найдено, %: С 34.60, Н 1.70, N 22.80, S 34.50. С5Н3N3ОS2. Вычислено, %: С 34.42, Н 1.63, N 22.69, S 34.62. Спектр ПМР (ДМСО-D6), б, м. д.: 9.16 (с., 2Н, Н2N), 8.04 (с., 1Н, НС=N)/стандарт ТМС/.