АФТОРЕФЕРАТ ПИЧАХЧИ О.Ю.
АВТОМОБИЛЬНЫХ ШИН В ПРОЦЕССАХ СОРБЦИИ
|
|

Продукт пиролиза автошин
|
|---|
Сорбция широко применяется для глубокой очистки сточных вод в химической, нефтехимической промышленности, на транспорте, цветной и черной металлургии и других отраслях промышленности. Во многих случаях без этого метода невозможно выдержать санитарные требования по сохранению чистоты водоемов или техническое условие на качество воды при повторном использовании сточных вод в замкнутых циклах водного хозяйства предприятий. Удаление биологически жестких, в том числе токсичных органических веществ в прямоточных системах водного хозяйства, обеспечение кондиционирования воды перед ионообменной и электродиализной очисткой, перед повторным использованием стоков в производстве, вот перечень задач успешно решаемых на основе использования сорбционной очитки. Немаловажным достоинством сорбционной технологии является простота аппаратурного оформления и возможность полной или частичной автоматизации всего процесса в целом, а также отдельных его частей. К преимуществам сорбционного метода очистки относятся: возможность удаления загрязнений чрезвычайно широкой природы практически до любой остаточной концентрации независимо от их химической устойчивости и управления процессом. В качестве сорбентов используются различные искусственные и природные пористые материалы, имеющие развитую или специфическую поверхность: золы, коксовая мелочь, торф, силикагели, алюмогели, активные глины, пенополистирол и другие. Наиболее эффектными сорбентами являются активные угли различных марок.
Активные угли применяются в промышленности как адсорбенты для разделения и очистки веществ в газовой и жидких фазах, в качестве катализаторов и носителей катализаторов, хемосорбентов и осушителей. Эффективное использование угля для решения той или иной производственной задачи возможно при соответствии его качества (пористая структура, природа поверхности, состав минеральной части, механическая прочность) условиям проведения технологического процесса.
По природе активированные угли принадлежат к группе графитовых тел. Для них используются углесодержащие материалы растительного происхождения. Ископаемые угли, каменноугольные полукоксы и др. Существуют два основных способа получения активных углей: Парогазовый метод активирования (процесс частичного "выжигания" углеводородных соединений из угля-сырца и окисление самого углерода за счет кислорода воздуха, пара и углекислого газа) и активирование углей органическими добавками (термическое разложение материала угля-сырца в присутствии неорганических добавок). В зависимости от способа и условий получения активированные угли могут резко отличаться природой поверхности, которая в свою очередь может меняться при хранении в присутствии кислорода воздуха и воды. Активированный уголь обладает каталитической активностью в ряде химических реакций: окисления, галогенирования, дегидрохлорирования, дегидратации, полимеризации и др.
Большое значение во всех случаях применения углей имеет пористая структура. Для углей характерно полимодальное распределение объема пор по размерам, наличие нескольких узких максимумов на кривой распределения объема пор по эффективным ресусам.
При адсорбции веществ с малыми размерами молекул определяющую роль играет мелкопористая структура, по характеру которой все активные угли делятся на две группы: с узким и широким распределением микропор. Угли первой группы характеризуются одной разновидностью микропор. Угли второй группы - двумя и более.
Однако применение активных углей не всегда экономически целесообразно, что связано с их относительно высокой стоимостью и проблемами регенерации. Поэтому возникает вопрос о расширении сырьевой базы получения сорбентов, в частности, активных углей.
Одним из направлений решения этой проблемы является использование в качестве сырья для производства активных углей нефтепродуктов, асфальтов, сажи, а также отходов производств синтетических материалов и резины. Поэтому целью работы явилось эксперементальное изучение свойств и характеристик твердого продукта пиролиза автомобильных шин длявозможного применнения его в качестве сорбента при очистке сточных вод. Задача работы заключается в определеннии свойств продукта пиролиза и сравнении их с известными марками активных углей.
2. Получение и характеристики твердого остатка пиролиза автошин
Непрерывный рост парка автомобилей во всех развитых странах приводит к постоянному увеличению количества изношенных автомобильных шин. Проблема переработки изношенных автомобильных шин и вышедших из эксплуатации резинотехнических изделий имеет большое экологическое и экономическое значение для всех развитых стран мира. А невосполнимость природного нефтяного сырья диктует необходимость использования вторичных ресурсов с максимальной эффективностью. Пиролиз кусков шин и резиновой крошки осуществляется в среде с недостатком кислорода, в вакууме, в атмосфере водорода в присутствии катализаторов и без них, в реакторах периодического и непрерывного действия, в псевдокипящем слое при различных температурах.
Сущность пиролиза автомобильных шин заключается в следующем: сырье (изношенные автомобильные шины) проходит механическую очистку и измельчение, затем сырье загружается в реактор пиролиза, в аппарате достигается избыточное давление 0,02 – 0,03 МПа за счет подачи углекислоты или азота и температура выше 100 0С, в результате образуются жидкие, твердые и газообразные продукты. Твердый остаток и предполагается использовать в качестве сорбента. Перед применением твердый остаток очищают от металлического корда.
Твердый остаток автомобильных шин представляет собой относительно хрупкий, жирный на ощупь черный продукт. Его характеристики в сравнении с антрацитом представлены в таблице 1.
| Параметр | Твердый остаток пиролиза автошин | Антрацит |
|---|---|---|
| Массовая доля влаги,% | 13.0 | 0,7 – 3 |
| Зольность, % | 13,2 | --- |
| Массовая доля серы, % | 2,31 | --- |
| Сера на сухое состояние, % | 2,36 | --- |
| Выход летучих веществ, % | 4,0 | --- |
| Углерод на сухое беззольное состояние, % | 95,5 | 94 - 97 |
| Высшая теплота сгорания (кДж/кг) | 34131 | 33520 – 35615 |
Сорбция - сложный процесс, основанный на физическом и химическом взаимодействии сорбата и сорбента. Физическая сорбция носит обратимый характер с сохранением индивидуальности сорбента и сорбата. Хемосорбция – химический процесс на границе раздела фаз, обычно необратимый и значительно более экзотермический, чем физическая сорбция. В отличие от биологического процесса колебания температуры и влияния токсичности для сорбции не имеют такого большого значения. Применяются три вида сорбции: Адсорбция – поглощение вещества, поверхностью чаще всего твердого поглотителя. Абсорбция – поглощение, сопровождающееся диффузией поглощенного вещества в глубь сорбента с образованием растворов. Поглотителем обычно выступает жидкость. Хемосорбция – адсорбция, сопровождается химическим воздействием поглощенного вещества с сорбентом. Материал, на поверхности или в объеме пор которого происходит концентрирование поглощаемого вещества, называют сорбентом, а само вещество сорбатом. Сорбционное взаимодействие основано на физическом и химическом взаимодействии сорбата и сорбента. Физическая сорбция обусловлена силами молекулярного взаимодействия, в основном дисперсионными. Последние возникает при сближении молекул материала сорбента и сорбируемого вещества и проявляются в упорядочении движения частиц вследствие взаимного притяжения. Дисперсионные взаимодействия неспецифичны, присущи всем веществам и и различаются в конкретных случаях лишь количественно. Потенциальная Энергия взаимодействия двух атомов равна
где r – расстояние между центрами атамов;
b – эмпирическая константа;
Сn – константа поляризации.
Приведенное выражение показывает, что сорбционное взаимодействие проявляется только на очень малых расстояниях. Теоретически, если взаимное притяжение атомов максимально на расстоянии ro, то при r = 1,5 ro их взаимодействие ослабляется в 4 – 5 раз. И наоборот при r < 0,5 ro превалируют силы отталкивания. Иногда дисперсионное взаимодействие усиливается водородными связями и электростатическими силами. Эти дополнительные взаимодействия специфичны для определенного вида сорбционных веществ или свойств поверхности сорбента. Сорбция процесс самопроизвольный, протекающий с выделением некоторого количества теплоты. Сорбция из жидких растворов значительно сложнее, чем из парогазовой смеси, так как включает взаимодействие сорбента с сорбируемым веществом и растворителем (водой); при этом также следует учитывать взаимодействие растворителя с сорбатом. Поэтому, сорбция из водных растворов изучена значительно менее сорбции из парогазовой смеси. Вид изотерм сорбции часто зависит от концентрации сорбируемого вещества в растворе. На практике исследований и расчетов часто используют простое эмпирическое уравнение Фрейндлиха
где К и n – константы.
Использование уравнения Фрейндлиха в области средних концентраций дает хорошее совпадение с экспериментальными данными; изотерма линеаризуется в координатах lgC/lgA. Уравнение изотермы Лэнгмюра выведено на основе молекулярно – кинетической теории и представлений о мономолекулярном характере процесса сорбции; в применении к растворам оно имеет вид
где Am– емкость монослоя;
b – константа;
С – концентрация вещества.
В области малых концентраций уравнение Ленгмюра переходит в уравнение Генри
т.е. сорбционная емкость прямопропорциональна концентрации.
Теория полимолекулярной сорбции, в основе которой лежит представление о многослойной сорбции на поверхности макро- и мезопористого сорбента, была разработана Брунауэром, Эмметом и Тейлором.
Однако на практике получили распространение микропористые сорбенты, в чрезвычайно малом пространстве микропор которых послойной сорбции вещества на поверхности не переходят. При сорбции в микропорах происходит заполнение части или всего объема их сорбатом, который под действием взаимно усиливающихся и перекрывающихся адсорбционных полей, создаваемых противоположными стенками микропор, находится в специфическом уплотненном состоянии. При сорбции вещества из раствора оно занимает на поверхности или в объеме пор сорбента место, которое до этого занимали молекулы растворителя (воды), а не свободное пространство. Присутствие воды в порах приводит к некоторому выравниванию сорбционного потенциала. В объеме сорбируемой фазы концентрация вещества значительно выше, чем в растворе. При этом снижается поверхностное натяжение на границе раздела раствор – твердый сорбент. Основы термодинамики адсорбции из растворов были сформулированы Гиббсом. Им было введено понятие избыточной адсорбции Г, т.е. избыточного содержания поглощенного поглощаемого вещества в адсорбционной фазе по сравнению с его содержанием в растворе. Величина избыточной адсорбции легко определима по формуле
где Со и Ск – концентрации вещества в растворе до и после опыта;
V – объем раствора;
m - навеска сорбента.
Термодинамический подход к решению проблемы сорбции является наиболее общим и позволяет оценивать сорбируемость молекул по значению максимальной работы переноса вещества из раствора на поверхность сорбента. Поскольку при сорбции вещества из воды происходит уменьшение свободной энергии ΔGадс зависимость lgKадс = ΔGадс/RT, из которой следует, что чем больше ΔGадс, тем лучше сорбируется вещество Полученные значения ΔGадс для функциональных групп позволяют с достаточной степенью точности вычислить ΔGадс для широкого класса различных органических соединений, тем самым прогнозируя сорбционную способность этих веществ. Идею о возможности применения теории объемного заполнения микропор для описания сорбции из жидкой фазы выдвинули Эльтеков и Стадник. Эта идея использует представления об отсутствии влияния физического состояния сорбата в объемной фазе на сорбционный потенциал в микропорах углей и отсутствии ассоциативных, ионных и водородных связей между молекулами сорбируемого вещества и воды, а также внутри сорбата. Эта теория применима для расчета сорбции из очень разбавленных растворов ограниченно растворимых веществ: уравнение изотермы сорбции на микропористых активных углях в данном случае примет вид:
где Wo – предельный объем микропор сорбента;
Vm – мольный объем сорбата;
В – структурно – энергетическая константа;
Сs – растворимость соединения в воде при данной температуре;
Ср – равновесная концентрация в воде.
Как известно, при адсорбции конкурируют два вида межмолекулярных взаимодействий: гидратация молекул растворенного вещества, т. е. взаимодействие их с молекулами воды в растворе, и взаимодействие молекул адсорбирующегося вещества с атомами поверхности твердого тела. Разность энергий этих двух процессов и представляет собой энергию, с которой извлеченное из раствора вещество удерживается на поверхности погруженного в раствор адсорбента. Наиболее сильное адсорбционное взаимодействие наблюдается, если в структуре молекул имеются двойные связи, образующиеся с участием п- электронов. Поэтому ароматические соединения сорбируются значительно лучше алифатических.
Адсорбция ухудшается при увеличении в молекулах числа гидроксильных групп, обладающих большой энергией гидратации за счет водородных связей. Адсорбцию ухудшает также наличие электрического заряда, ориентирующего вокруг себя диполи воды. Поэтому диссоциированные на ионы молекулы сорбируются значительно хуже, чем недиссоциированные молекулы тех же веществ.
В технологии адсорбционной очистки вод сложного состава большое значение имеет оценка относительной прочности адсорбции отдельных веществ из водных растворов. Силу адсорбционного взаимодействия целесообразно оценивать уменьшением свободной энергии ( ΔFадс ) при адсорбции вещества в определенных стандартных условиях.
Аддитивные свойства величины ΔFадс позволяют вычислять ее значение по ранее определенным инкрементам dΔFадс отдельных структурных элементов и функциональных групп для адсорбции из воды на углях, гидроксидах и т. д. Для основных типов промышленных активных углей (КАД, ОУ, БАУ) определены ΔFадс для элементов структуры и функциональных групп многих ароматических соединений. Используя значения ΔFадс и dΔFадс , расчетным путем можно оценивать эффективность адсорбции.
Полной теории адсорбции молекул из растворов, в особенности из воды, до настоящего времени не существует, а поэтому на практике приходится в большинстве случаев применять рассмотренные выше относительно простые эмпирические и полуэмпирические соотношения.
Влияние температуры на сорбцию
Влияние температуры на сорбцию из водных растворов далекр не однозначно. Дело в том, что при сорбции на микропористых сорбентах веществ, размеры молекул которых близки к эффективным размерам пор, проникновение этих молекул в поры зависит от их кинетической энергии. При достаточной энергии (температуре) молекулы сорбата проникают в окна пор и сорбируются; в противном случае происходит лишь незначительное поглощение на поверхности мезо- и макропор. Иными словами, сорбционная емкость повышается с ростом температуры; это явление называется "активированной адсорбцией". В то же время физическая сорбция, как любой экзотермический процесс, в целом, ухудшается с ростом температуры. Поэтому суммарное влияние фиксируемое проявление этих двух явлений (активной и физической адсорбции) может иметь экстремум (максимум) при определенной температуре
При сорбции из водных растворов этот пик размыт (например, от 20-70oС)сорбция фенола увеличивается, а уксусной кислоты уменьшается.
Несмотря на невысокую величину удельной поверхности (32м2/г), найденную по методу БЭТ, данный твердый остаток, являющийся отходом производства, был испытан на сорбционные свойства различными методами.
Одной из основных характеристик активных углей является их сорбционная емкость (осветляющая способность) по метиленовому голубому. Согласно ГОСТ 4453-74 эта величина определяется после изучения взаимодействия навески активного угля с 15 %-ным раствором метиленового голубого. Осветляющая способность исследуемого продукта была определена после контакта его навески с определенным объемом раствора метиленового синего. Твердый остаток низкотемпературного пиролиза предварительно высушивали до постоянной массы при температуре (120±10)oС и отбирали фракцию (0.5±1.0)мм. Концентрацию красителя находили фотоколориметрическим методом исходя построенного калибровочного графика. Результаты расчетов показали, что сорбционная емкость составила 130 мг/г, что соизмеримо с аналогичной величиной по ГОСТ 4453-74. Таким образом, твердый остаток пиролиза автомобильных шин обладает определенной сорбционной емкостью, что свидетельствует о возможности использования его как сорбента. Сорбционная емкость по йоду составляет 30%, что равно сорбционной активности угля марки ДАК.
Следующим этапом исследования явилось изучение сорбционной емкости исследуемого продукта по отношению к различным органическим веществам, в частности, метиленовому голубому, метиленовому красному и фенолу. Для решения вопроса о возможности использования твердого остатка пиролиза как сорбента была проведена серия опытов по определению сорбционной емкости продукта при различных равновесных концентрациях сорбата с последующей построением сорбционных кривых. В каждом случае проводили не менее трех параллельных определений, что позволило получить следующие результаты.

Сорбция
|
Сорбцию метиленового голубого проводили в диапазоне исходных концентраций от 100 мг/дм3 до 1000 мг/дм3, температура – 25oС. Навеска сорбента была постоянной и составляла 0.40 г, объем раствора – 200 см3. Остаточную концентрацию красителя находили по калибровочной кривой. В исследуемом диапазоне концентраций максимальная величина сорбционной емкости твердого остатка пиролиза автомобильных шин составила 320 мг/г, что не ниже аналогичной величины для известных марок активных углей. Аналогичные опыты были проведены для метиленового красного (остаточную концентрацию красителя определяли фотометрическим методом), в результате которых была найдена сорбционная емкость, равная 450 мг/г. Вид изотерм адсорбции для исследованных красителей приведен на рис. 1. и рис.2. |
|---|
Согласно Брунауэру, Эммету и Теллеру вид изотерм свидетельствует не только о наличии в сорбенте микро- и макропор, но также и о сильном межмолекулярном взаимодействии в веществе сорбата.


Сорбцию фенола проводили из растворов в диапазоне исходных концентраций 1.0 – 10.0 ммоль/ дм3, навеска сорбента – 1.0 г, объем раствора -200 см3. Остаточную концентрацию фенола находили бромид-броматным методом. Найденная величина сорбционной емкости составила 244 мг/г, что согласуется с литературными данными, приведенными для адсорбции фенола из водных растворов на угле КАД. В этом случае изотерма адсорбции (рис.3) имела вид, аналогичный приведенному на рис.1. и 2.
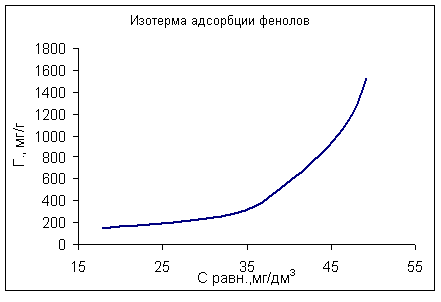
Таким образом, результаты выполненных исследований свидетельствуют о возможности использования твердого остатка низкотемпературного пиролиза автомобильных шин в качестве сорбента для удаления некоторых органических загрязнений для очистки сточных вод.
Таким образом, проведенные эксперименты на твердом остатке пиролиза автомобильных шин, свидетельствуют о том, что применение его в качестве сорбента для очистки сточных вод целиком приемлемо. Сорбционная активность твердого продукта пиролиза соизмерима с активностью известных марок активных углей, по физическим показателям его можно сравнить с антрацитом. Твердый остаток пиролиза необходимо проанализировать на сорбцию тяжелых металлов, провести эксперементы на производственной сточной воде, т.е. провести апробацию для использовать его в качестве сорбента на предприятиях определенной отрасли промышленности.
1. А.Д.Смирнов. Сорбционная очистка воды, Л.- 1982.
2. А.М. Когановский. Адсорбционная технология очистки сточных вод.- К.-1983.
3. Л.Ф. Долина. Сорбционные методы очистки производственных сточных вод. Д.-
2000.
4. О.Ю. Пичахчи, Е.А.Трошина. Изучение возможности применения новых веществ
для сорбционной очистки сточных вод.Конференция ДонНТУ, 14-15,04,04
5.А.В. Булавин, В.Н. Пашкевич. Переработка автомобильных шин методом низкотемпературного пиролиза.
6.Х. Кинле, Э. Бадер. Активные угли и их промышленное применение. Л. - 1984.
7. ГОСТ 4453 – 74. Уголь активный осветляющий древесный порошкообразный.
8. ГОСТ 6217 – 74. Уголь активный древесный дробленый.