Главная страница
Библиотека
Ссылки
Отчет о поиске
Истории, ледянящие кровь
Портал магистров ДонНТУ
ДонНТУ

АВТОРЕФЕРАТ
по теме: «Разработка теоретических основ расчетов очистки технологических газов растворами этаноламинов»
Автор: Комиссарова Ольга Владимировна
СОДЕРЖАНИЕ
Введение
1. Методы очистки технологических газов от сероводорода и диоксида углерода
2. Выбор поглотительного раствора
3. Физико-химические основы процесса абсорбции
4. Анализ существующей методики расчета этаноламинового способа очистки газа
5. Разработка теоретически обоснованной методики расчета этаноламиновой сероочистки технологических газов
Выводы
Перечень ссылок
Рисунок 1 - Механизм реакции моноэтаноламина и сероводорода.
Анимация выполнена в среде Macromedia Flash.
Длительность анимации: 290 кадров (24.2 с). Размер 64 кб
ВВЕДЕНИЕ
Природный, коксовый и другие технологические газы содержат сернистые и другие вредные примеси,
исключающие их использование в качестве топлива или химического сырья без предварительной очистки.
Используемый в быту и в технологических процессах газ должен содержать минимальное количество кислых компонентов.
Углекислый газ и сернистые соединения вызывают коррозию труб и оборудования. Сернистые соединения и их продукты
сгорания загрязняют окружающую среду и оказывают вредное действие на организм человека. С другой стороны, такие
соединения, как сероводород, меркаптаны, диоксид углерода и другие примеси, выделенные из газов являются ценным
сырьем для других подотраслей народного хозяйства (например, сероводород применяют как сырье для получения серы,
используемой в производстве удобрений, в химической, целлюлозно-бумажной, медицинской промышленности; диоксид
углерода - сырье для фотосинтеза, интенсификатор роста растений, холодильный агент и т. д.).
Ограниченность природных ресурсов требует вовлечения в процессы газопереработки месторождений с низким
пластовым давлением, менее качественного газового сырья с высоким содержанием сероводорода и меркаптанов,
сырья с неблагоприятным соотношением сероводорода и диоксида углерода и т. д. В результате этого возникает
необходимость модернизации действующих на газоперерабатывающих заводах установок с использованием накопленного
опыта эксплуатации аналогичных установок как в нашей стране, так и за рубежом [1].
В последние годы отрыты крупнейшие месторождения природного газа, содержащего значительные количества
кислых компонентов. Построены и введены в строй новые газоперерабатывающие заводы, на которых для извлечения
из газа кислых компонентов используется процесс аминовой очистки. Учитывая перспективу увеличения объема
переработки сернистого газа и широкое распространение аминовой очистки в газовой промышленности, серьезное
внимание следует уделить разработке и выбору надежных методов расчета процесса аминовой очистки. Для анализа
работы действующих установок, для обработки и обобщения результатов обследования необходимы не только надежные,
но и достаточно простые и удобные методы расчета.
На большинстве коксохимических заводов Украины для очистки коксового газа от сероводорода применяется
вакуум-карбонатный метод, по которому абсорбция сероводорода производится раствором соды или смеси соды и поташа.
Это объясняется низкой стоимостью реагентов и сравнительно малыми капитальными и эксплуатационными затратами на
очистку газа. Основным недостатком этого метода является низкая степень очистки газа от сероводорода, составляя
80-85% в зависимости от режима работы и состояния оборудования.
При содержании сероводорода в прямом газе 16-18 г/м3 потери его с обратным газом при очистке вакуум-карбонытным
методам достигают 2,5-3,5 г/м3 и более, тогда как в соответствии с действующими требованиями экологии они не должны
превышать 0,5 г/м3. Такой уровень потерь сероводорода при этом методе может быть достигнут только при осуществлении
двухступенчатой очистки газа, реализация которой требует почти двукратного увеличения капитальных и эксплуатационных
затрат.
Существенным недостатком вакуум-карбонатного метода сероочистки являются: необходимость проведения процесса
регенерации поглотительного раствора под вакуумом 620-640 мм. рт. ст., что связано с увеличением размеров регенератора
и другого оборудования, расходов металла и электроэнергии, а также большое количество трудноутилизируемых жидких отходов.
Одним из наиболее эффективных абсорбционных методов очистки газов от кислых соединений являются этаноламиновые
методы, позволяющие снизить содержание сероводорода в газе до 0,1 г/м3 и менее при одноступенчатой очистке. Эти
методы получили широкое распространение в технологической переработке природных и нефтяных газов.
На некоторых коксохимических заводах ведется проектирование и начато строительство цехов моноэтаноламиновой
сероочистки.
Умение быстро и правильно рассчитывать процессы и аппараты имеет большое значение при все возрастающем объеме
проектирования новых и оценке работы действующих газоперерабатывающих объектов [2].
Задачей моей магистерской работы является разработка классической методики расчетов процессов абсорбции и
десорбции, основанной на уравнении массопередачи для аппаратов с непрерывным контактом фаз или на определении
числа ступеней изменений концентрации для аппаратов со ступенчатым контактом фаз.
Эта работа является актуальной как для технологии переработки природных газов, так и для коксохимической
промышленности в связи с разработкой процессов моноэтаноламиновой сероочистки коксового газа на некоторых заводах Украины.
1. МЕТОДЫ ОЧИСТКИ ТЕХНОЛОГИЧЕСКИХ ГАЗОВ ОТ СЕРОВОДОРОДА И ДИОКСИДА УГЛЕРОДА
Для повышения эффективности процессов переработки природный или попутный нефтяной газ обязательно подвергается
очистке на начальных стадиях, т. е. в промысловых условиях или в начале технологической цепочки на газоперерабатывающих
заводах. В настоящее время для очистки газа от кислых компонентов используют следующие способы.
Абсорбционные процессы очистки газа от кислых компонентов подразделяются на три группы в зависимости от природы
взаимодействия кислых компонентов газа с молекулами абсорбента.
Процессы химической абсорбции основаны на химическом взаимодействии сероводорода и диоксида углерода с активной
частью абсорбента (с молекулами абсорбента в водном растворе). В промышленных масштабах из химических абсорбентов
нашли широкое применение водные растворы алканоламинов: первичных - моноэтаноламин (МЭА), вторичных - диэтаноламин
(ДЭА), диизопропаноламин (ДИПА) и третичных - метилдиэтаноламин (МДЭА) и триэтаноламин (ТЭА); а также растворы щелочи,
растворы солей щелочных металлов (поташная очистка – 25-30%-ный водный раствор К2СО3 или
Na2CO3) и очистка раствором гидроксида железа Fe(OH)3. Процессы химической абсорбции
характеризуются высокой избирательностью по отношению к
кислым компонентам и позволяют достигать высокой степени очистки газа от Н2S и СО2. Меркаптаны при
использовании
водных растворов аминов извлекаются в небольших количествах за счет растворения их в жидкой фазе и образования
неустойчивых соединений с молекулами аминов. При использовании водных растворов щелочи достигается тонкая очистка от
меркаптанов, но взаимодействие щелочи с сероводородом и диоксидом углерода сопровождается накоплением в абсорбенте
нерегенерируемых соединений, что приводит к относительно быстрой отработке абсорбента и вызывает проблемы утилизации
отходов производства.
В процессах физической абсорбции извлечение кислых компонентов основано на различной растворимости компонентов
газа в абсорбенте. В качестве абсорбентов в этих процессах используют смесь диметиловых эфиров полиэтиленгликоля
(процесс «Селексол»), метанол (процесс «Ректизол»), пропиленкарбонат (процесс «Флюор»), N-метилпирролидон
(процесс «Пуризол»), трибутилфосфат (процесс «Эстасольван»), смесь метилизопропиловых эфиров полиэтиленгликолей
(процесс «Сепасолв-МПЕ») и др. В отличие от хемосорбционных способов, методом физической абсорбции можно одновременно
наряду с сероводородом и диоксидом углерода извлекать серооксид углерода, сероуглерод, меркаптаны, а иногда и сочетать
процесс очистки с осушкой газа. Поэтому в некоторых случаях (особенно при высоких парциальных давлениях кислых
компонентов и когда не требуется тонкая очистка газа) целесообразно использовать физические абсорбенты, которые
по сравнению с химическими отличаются существенно более низкими затратами на регенерацию. Ограниченное применение
этих абсорбентов обусловлено повышенной растворимостью углеводородов в них, что снижает качество получаемого
кислого газа, направляемого обычно на установки получения серы.
В процессах физико-химической абсорбции используют комбинированные абсорбенты - смесь физического абсорбента
с химическим. Для этих абсорбентов характерны промежуточные значения растворимости кислых компонентов газа. Эти
абсорбенты позволяют достигать тонкой очистки газа не только от сероводорода и диоксида углерода, но и от
сероорганических соединений. Наибольшее промышленное применение нашел абсорбент сульфинол, представляющий собой
смесь диизопропаноламина (30-45%), сульфолана (диоксида тетрагидротиофена 40-60%) и воды (5-15%). В последние
годы широко стал внедряться в промышленные процессы абсорбент укарсол, разработанный фирмой «Юнион карбайд» (США)
и представляющий собой смесь метиддиэтаноламина, алкиловых эфиров полиэтиленгликоля и воды, а также отечественный
аналог этого абсорбента - экосорб. Этот абсорбент позволяет проводить селективную очистку газа от сероводорода
в присутствии СО2 при одновременной очистке газа от сераорганических соединений.
Адсорбционные методы очистки газа основаны на селективном извлечении примесей твердыми поглотителями -
адсорбентами. При этом извлекаемый компонент может вступать в химическое взаимодействие с адсорбентом
(химическая адсорбция) или удерживаться физическими силами взаимодействия (физическая адсорбция). Химическая
адсорбция не нашла широкого промышленного применения в газопереработке из-за сложностей, возникающих на стадии
регенерации отработанного адсорбента. Физическая адсорбция отличается легкостью регенерации адсорбента и широко
используется в промышленных процессах для тонкой очистки газов от сероводорода, диоксида углерода,
сераорганических соединений и влаги. В качестве адсорбентов наибольшее распространение нашли активированные
угли и синтетические цеолиты. Преимуществом адсорбционных методов очистки перед абсорбционными является высокая
поглотительная способность адсорбентов даже при низких парциальных давлениях извлекаемых компонентов и возможность
сочетать тонкую очистку газа от сероводорода, диоксида углерода и сераорганических соединений с глубокой осушкой
(например, до точки росы газа по влаге не выше минус 70°С при очистке и осушке газа на цеолитах). Недостатком
процессов адсорбционной очистки газа являются относительно высокие эксплуатационные затраты и полупериодичность
процесса, в связи с чем эти процессы чаще используют для тонкой очистки газа от остаточных количеств кислых
компонентов после предварительной очистки методом абсорбции, например процессу очистки газа на цеолитах предшествует
очистка растворами аминов.
Каталитические методы очистки газа основаны на взаимодействии удаляемых веществ с одним из компонентов,
присутствующим в очищаемом газе, или со специально добавляемым в смесь веществом на твердых катализаторах.
Каталитические методы очистки газа от кислых компонентов применяют в тех случаях, когда в газе присутствуют соединения,
недостаточно полно удаляемые с помощью жидких поглотителей или адсорбентов (например, сероуглерод, серооксид углерода,
сульфиды, дисульфиды, тиофен). В промышленности нашли применение методы каталитического гидрирования, основанные на
взаимодействии сернистых соединений с водородом (гидрирование) или с водяным паром (гидролиз). В результате этих
процессов все присутствующие соединения превращаются в с сероводород и соединения, не содержащие серу. В качестве
катализаторов в этих процессах используют оксиды кобальта, никеля и молибдена, нанесенные на оксид алюминия.
Окислительные методы предполагают проведение реакций каталитического окисления сероводорода в элементарную серу
на активном оксиде алюминия или, для процессов очистки от меркаптанов, каталитическое окисление их до дисульфидов
(процессы «Мерокс», ДМС-1 и т.п.). Во всех каталитических процессах требуется последующее выделение продуктов
каталитического превращения, осуществляемое традиционными методами. Например, газ после каталитического гидрирования
направляют на очистку от сероводорода раствором моноэтаноламина или другими абсорбентами [1].
Проанализировав существующие методы очистки газа от кислых компонентов, выделив их достоинства и недостатки,
можно сделать вывод о том, что благодаря высокой избирательности по отношению к кислым компонентам, для обеспечения
высокой степени очистки газа от сероводорода и диоксида углерода наиболее эффективным в технологическом и экономическом
отношении является метод химической абсорбции.
2. ВЫБОР ПОГЛОТИТЕЛЬНОГО РАСТВОРА
Выбор растворителя является важной задачей, поскольку от его специфических свойств зависит технологическая
схема и технико-экономические показатели процесса.
Неприемлемость использования водных растворов щелочи для очистки газа от кислых компонентов в том, что
взаимодействие щелочи с сероводородом и диоксидом углерода сопровождается накоплением в абсорбенте нерегенерируемых
соединений, что приводит к относительно быстрой отработке абсорбента и вызывает проблемы утилизации отходов производства.
Очистка раствором гидроксида железа Fe(OH)3 по отношению к рассматриваемому процессу является экономически
нерациональной.
Аминовые процессы обеспечивают тонкую очистку газов от сероводорода и диоксида углерода при незначительном
поглощении углеводородов.
Каждый из аминовых растворителей обладает определенными физико-химическими свойствами, влияющими на процесс очистки.
Выбор растворителя зависит от требуемой степени очистки газа, начального содержания примесей, а также необходимых
технико-экономических показателей процесса (расход растворителя, тепла и энергии на процесс очистки).
При выборе аминов необходимо также учесть и коррозионные свойства среды. Коррозия на установках аминовой очистки
протекает прежде всего в результате взаимодействия сероводорода с металлической поверхностью аппаратов с
образованием сульфида железа и за счет взаимодействия диоксида углерода с металлами с образованием бикарбоната
и карбоната железа. Амины не вызывают коррозию оборудования, но в процессе эксплуатации установки коррозия может
ускоряться за счет появления в системе продуктов разложения аминов, способных взаимодействовать с металлами.
Интенсивность коррозии снижается в ряду: первичные амины - вторичные - третичные, так как температура регенерации,
необходимая для эффективного удаления из абсорбента кислых компонентов, в этом ряду понижается.
Рассмотрим наиболее распространенные способы аминовой очистки, выделяя их достоинства и недостатки.
МЭА-способ
Для МЭА-способа хемосорбентом является водный раствор моно-этаноламина с концентрацией 15-30% масс.
Более высокие концентрации МЭА применяют только при использовании высокоэффективных ингибиторов коррозии.
Растворы МЭА обеспечивают тонкую очистку газа от H2S и СО2 в широком диапазоне концентраций. Моноэтаноламин по
сравнению с другими аминами труднее регенерируется, но меньше поглощает углеводороды.
Существенным недостатком МЭА являются его относительно высокая реакционная способность по отношению к
органическим соединениям серы, содержащимся в газе, с образованием побочных продуктов и высокая коррозионная
активность его растворов. Первичные амины не следует использовать, если в очищаемом газе присутствует CS2 и СОS,
так как реакция протекает с образованием труднорегенерируемых и нерегенерируемых соединений, накапливающихся в
абсорбенте и снижающих его абсорбционную емкость. МЭА сравнительно легко окисляется сначала с образованием
α -аминоальдегида, затем глицина, гликолиевой кислоты, щавелевой кислоты и, наконец, муравьиной кислоты. Эти кислоты
приводят к коррозии с образованием нерастворимых солей железа, способные забивать аппаратуру.
Температурные условия регенерации растворов МЭА ограничены, с одной стороны, достаточно высоким давлением
насыщенных паров (большой унос), ускорением побочных реакций и, с другой - трудной регенерируемостью из-за низкой
константы диссоциации сульфида МЭА и других соединений при относительно низких температурах. Этим, и свою очередь,
обусловлена относительно высокая остаточная концентрация H2S и СО2 в регенерированном растворе МЭА.
ДЭА-способ
Диэтаноламин применяют в качестве хемосорбента в виде водного раствора концентрацией 25-30%.
Недостатком ДЭА-способа по сравнению с МЭА-способом являются более низкая поглотительная способность раствора и
более высокий удельный расход абсорбента.
Наиболее важные преимущества ДЭА-способа по сравнению с МЭА- способом:
- обеспечивается тонкая очистка газов в присутствии COS, CS2 и тяжелых углеводородов (продукты реакции
ДЭА с COS и CS2 на 70-85% гидролизуются до H2S и СО2);
- выше химическая стабильность;
- насыщенный абсорбент легче регенерируется вследствие меньшей прочности химических связей образующихся соединений;
- диэтаноламин имеет более низкое давление насыщенных паров, что обеспечивает меньшие потери с кислым газом в
десорбере;
- абсорбцию можно проводить на 10–15°С выше, чем в МЭА-процессе, что позволяет снизить вероятность
вспенивания раствора при очистке газа с повышенным содержанием тяжелых углеводородов.
МДЭА-ДЭА-способ
Используют с целью улучшения технико-экономических показателей процесса очистки газа от кислых компонентов за
счет снижения коррозионной активности реакционной среды. Как правило, этот способ используют для обеспечения
требуемой степени извлечения (и ее регулирования) СО2 в присутствии H2S. В этом процессе используется водный
раствор смеси метилдиэтаноламина (МДЭА) и диэтаноламина (ДЭА) суммарной концентрации аминов 40-50% при массовом
соотношении ДЭА: МДЭА от 1:4 до 4:1.
Способ ДИПА
В качестве хемосорбента используется диизопропаноламин (ДИПА) в виде водного раствора с концентрацией до 40%.
ДИПА обеспечивает тонкую очистку газа от H2S - до 1,5 мг/м3 и СО2 – до 200 мг/м3
(до 0,01%) при низкой растворимости
в нем углеводородов. При этом извлекаются до 50% COS и RSH. ДИПА с СО2, COS и RSH образует легко регенерируемые
соединения. Потери ДИПА при регенерации примерно вдвое меньше, чем МЭА. При использовании в качестве абсорбента
растворов ДИПА практически отсутствует коррозия аппаратуры. Тепловой эффект реакции ДИПА СО2 и H2S ниже,
чем для МЭА,
и поэтому расход пара при регенерации ниже. Существенным недостатком ДИПА является его высокая стомость.
Способ Эконамин
В качестве хемосорбента используется дигликольамин (ДГА) с концентрацией в водном растворе 60-65% масс.
ДГА - это фирменное название 2-этокси (2'-амино)этанола (HO-CH2-CH2-O-CH2-CH2-
NH2). ДГА обеспечивает тонкую очистку
газа от H2S - ниже 5,7 мг/м3 и СО2 ниже 200 мг/м3 (до 0,01% об.). При
взаимодействии ДГА с СО2, COS, СS2 и RSH
образуются легко регенерируемые соединения. По сравнению с МЭА и ДЭА обладает существенно более высокой способностью
извлекать меркаптаны. Степень насыщения раствора кислыми компонентами газа на 20% больше, чем для МЭА.
Недостатком ДГА являются его высокая стоимость и сравнительно большие потери при эксплуатации.
ТЭА-способ
Абсорбент - водный раствор триэтаноламина концентрации 45-53% масс. Триэтаноламин (ТЭА), в отличие от
первичных и вторичных аминов, не способен вступать в непосредственное взаимодействие с диоксидом углерода с
образованием карбамата, так как в молекуле ТЭА отсутствует подвижный атом водорода у атома азота. Извлечение СО2
происходит за счет физической абсорбции (под давлением 5-7 МПа) и реакций образования карбоната и гидрокарбоната
амина, имеющих низкие константы скорости. Процесс регенерации осуществляется ступенчатым испарением за счет понижения
давления и повышения температуры в сепараторе, а затем в десорбционной колонне. Недостаток способа в том, что в
дальнейшем газ требуется подвергать доочистке с применением алкацидного способа.
Способы ДЭТА и ЭДА
Для хемосорбции СО2 и H2S применяются полиамины. Эти способы преимущественно используют для
очистки газов
нефтепереработки, для очистки коксового газа. Растворы диэтилентриамина (ДЭТА) и этилендиамина (ЭДА) обладают
значительно большей скоростью хемосорбции СО2 и обеспечивают более глубокую очистку газов от СО2
(до 0,01% об.),
по сравнению с моноэтаноламином. Кроме того, их поглотительная способность существенно выше.
Столь же велика хемосорбционная активность раствора ЭДА. Поглотительная способность ЭДА по отношению к
сероводороду почти в 2 раза выше, чем МЭА. Однако, в присутствии СО2 эффективность улавливания H2S
раствором ЭДА несколько снижается.
Наиболее существенным недостатком полиаминов как хемосорбентов является их высокая коррозионная активность,
что требует применения специального оборудования из нержавеющей стали или высокоэффективных ингибиторов коррозии.
Способ Амизол
Основан на применении в качестве хемосорбента раствора МЭА или ДЭА в метаноле. Такой абсорбент поглощает H2S,
CO2,
меркаптаны, углеводороды и воду. Абсорбция ведется при 35°С, а регенерация при 80°С. Это обусловливает низкий
расход тепла на регенерацию по сравнению с водными растворами аминов. При этом процессе достигнута высокая степень
очистки от H2S, COS, CO2. Побочные реакции аминов с СО2 и COS в метанольном растворе идут
в 10 раз медленнее, чем в
водном растворе МЭА, и в 100 раз медленнее, чем в водном растворе ДЭА. Коррозия оборудования при этом практически
отсутствует.
Недостатком способа является большой унос паров метанола с потоком очищенного газа. Однако очистка газа
водой после абсорбера дает возможность практически полностью улавливать метанол и после выделения и возвращать в
цикл, но для этого требуется дополнительное оборудование [1].
3. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА АБСОРБЦИИ
Абсорбционные методы очистки газов основаны на различной растворимости газов в жидкостях. Абсорбционные
процессы можно классифицировать по различным признакам. В зависимости от физико-химической основы их можно разделить
на процессы физической абсорбции и химической абсорбции (или хемосорбции, т. е. абсорбции, сопровождающейся
химической реакцией газа с хемосорбентом). Это разделение в целом является условным.
При хемосорбции молекулы газа, растворенного в жидкости, вступают в реакцию с активным компонентом абсорбента.
Большинство реакций, протекающих при очистке, являются экзотермическими и обратимыми, поэтому при повышении температуры
раствора образующееся химическое соединение разлагается с выделением исходных компонентов.
Растворимость газа при хемосорбции зависит от физической растворимости газа, константы равновесия химической
реакции, стехиометрических соотношений при реакции и других факторов. Характерная особенность растворимости газов
в хемосорбентах заключается в неравномерном росте растворимости при увеличении давления: чем выше давление, тем
медленнее (по мере расхода хемосорбента) повышается растворимость.
В случае абсорбции многокомпонентных смесей равновесные зависимости значительно сложнее, чем при абсорбции
одного компонента. При этом парциальное давление каждого компонента в газовой смеси зависит не только от его
концентрации в растворе, но также и от концентрации в растворе основных компонентов, т.е. является функцией большого
числа переменных. Поэтому, как правило, в подобных случаях равновесные зависимости
основываются на опытных данных [3].
Будем рассматривать процессе абсорбции, в котором поглощение газа жидкостью сопровождается химическим
взаимодействием фаз. Поскольку, реакции протекают в жидкой фазе, часть газообразного компонента переходит в
связанное состояние. При этом концентрация свободного (т.е. не связанного с поглощаемым газом) компонента в
жидкости уменьшается, что приводит к ускорению процесса абсорбции по сравнению с абсорбцией без химического
взаимодействия фаз, так как увеличивается движущая сила процесса. В общем случае скорость хемосорбции зависит
как от скорости реакции, так и от скорости массопередачи между фазами.
В качестве абсорбента в рассматриваемом процессе используют водный раствор моноэтаноламина. Сероводород и
двуокись углерода поглощаются раствором моноэтаноламина из газа благодаря физической растворимости и химическим
реакциям при противоточном контакте. В основу процесса заложена способность МЭА образовывать нестойкие химические
комплексы. Рассмотрим химизм процесса.
Рассматриваемые ниже реакции обратимы и сдвигаются вправо при увеличении давления и уменьшения температуры.
МЭА реагирует с H2S с образованием сульфида и гидросульфида амина, причем реакция классифицируется, как мгновенная;
диоксид углерода может реагировать с МЭА с образованием карбоната моноэтаноламмония R2NHCOOR2NH2,
а также карбоната
(R2NH2)2CO2 и бикарбоната R2NH2HCO2. Обе
реакции классифицируются как быстрые, но образованию карбоната и бикарбоната
предшествует медленная реакция растворения СО2 в воде с образованием угольной кислоты Н2СО3.
Согласно правилу Ле-Шателье повышение температуры и понижение давления сдвигают выше приведенные реакции
влево - этим обусловлен выбор и реакции регенерации насыщенного амина.
Понижение температуры абсорбции приводит к повышению степени извлечения целевых компонентов, но снижает
селективность процесса вследствие повышения растворимости углеводородов в аминовых растворах.
Повышение температуры увеличивает селективность процесса по отношению к кислым компонентам, но может
привести к увеличению остаточного содержания кислых компонентов в очищенном газе.
Взаимодействие H2S с любыми аминами протекает с образованием гидросульфида и сульфида мгновенно, и в
интервале от 30 до 50°С температура существенно не влияет на степень извлечения сероводорода. Повышение
температуры до 60 - 70°С будет прежде всего сказываться на образовании малоустойчивой угольной кислоты, что и
приводит к значительному снижению степени извлечения СО2. Степень извлечения H2S при этом тоже понижается, хотя и
в меньшей степени, чем СО2.
Повышение давления при неизменных температуре и концентрации амина повышает степень очистки газа от кислых
компонентов, так как повышается движущая сила процесса. Поэтому, если необходимо очищать газ низкого давления,
то целесообразно предварительно компримировать его. Обычно очистку газа растворами аминов осуществляют при
давлении от 2 до 7 МПа [1].
4. АНАЛИЗ СУЩЕСТВУЮЩЕЙ МЕТОДИКИ РАСЧЕТА ЭТАНОЛАМИНОВОГО СПОСОБА ОЧИСТКИ ГАЗА
Проектирование новых и реконструкция действующих установок для очистки газов от вредных примесей требует
разработки теоретически обоснованных методов расчетов технологических процессов, лежащих в основе проекта.
Между тем, теоретические основы расчетов этаноламиновых методов очистки газов разработаны недостаточно, поэтому
их проектирование производится с помощью упрощенных зависимостей и диаграмм, основанных на практических данных о
работе промышленных установок.
Одна из немногих попыток разработки теоретически обоснованной методики расчета процесса очистки природного
газа от сероводорода и диоксида углерода водным раствором моноэтаноламина представлена в справочном пособии [4].
Однако анализ изложенных в этой работе трактовок выражений констант равновесия химических реакций, протекающих в
растворе, подходов к определению равновесных степеней превращения компонентов газа и раствора, к составлению
материального и теплового балансов процесса абсорбции свидетельствует о теоретической несостоятельности предложенной
методики расчетов. Можно назвать следующие ошибки.
В основу расчетов положены стехиометрические уравнения химических реакций поглощения кислых компонентов
раствором моноэтаноламина:
2RNH2+CO2+H2O ↔ (RNH3)2CO3
(4.1)
(RNH3)2CO3+CO2+H2O ↔ 2RNH3HCO3
(4.2)
2RNH2+H2S ↔ (RNH3)2S
(4.3)
(RNH3)2S+H2S ↔ 2RNH3HS
(4.4)
где R – группа ОНСН2СН2-.
Для определения степени превращения сероводорода и диоксида углерода по этим реакциям используются выражения констант
равновесия, которые с учетом давления в аппарате и протекания реакций в растворе представлены в следующем виде:

(4.5)

(4.6)

(4.7)

(4.8)
где  – давление в аппарате;
– давление в аппарате;
Σ ni – общее число молей реагирующей смеси;
Δ n – разность чисел молей продуктов и исходных реагентов в реакциях (1)-(4).
Следует, однако, подчеркнуть, что эти выражения справедливы для реакций, протекающих в газовой фазе, и неприемлемы
для расчета реакций, протекающих в растворе.
Для определения степени превращения по каждой реакции состав исходной смеси принимается равным стехиометрическому,
тогда как следует брать фактический состав исходной реакционной смеси. Кроме того, степень превращения по каждой реакции
определяется независимо одна от другой, когда задача должна решаться путем совместного рассмотрения четырех уравнений.
Более того, такое решение справедливо только для замкнутой системы, а также при прямоточном движении фаз в открытой
системе. При противоточном движении газа и жидкости в абсорберах исходная смесь в каждом сечении имеет различный состав,
и поэтому такое решение лишено всякого смысла.
В результате неправильного расчета, основанного на вышеуказанных формулах, определено, что в насыщенном растворе доля
химически связанного диоксида углерода составляет 0,5%, а доля сероводорода - 3%. Остальная масса этих кислых компонентов
находится в растворе в свободном состоянии. Возникает вопрос: зачем тогда применять этаноламин, если он не связывает
поглощенные кислые газы?
Методика составления теплового баланса абсорбера неоправданно усложнена и содержит ряд серьезных ошибок. Например,
энтальпия газообразных смесей определяется по эмпирическим формулам для каждого компонента по отношению к 0°К:

(4.9)
где А, В, С, D – коэффициенты, Т – температура, К.
А для растворов – по отношению к 0°С в соответствии с общепринятой практикой термодинамических расчетов:

(4.10)
где Cp – удельная теплоемкость раствора, кДж/(кг•°С), t – температура, °С.
Такой подход к составлению теплового баланса является недопустимым с теоретической точки зрения, так как при переходе
значительного количества компонентов из одной фазы в другую он приведет к серьезным ошибкам в расчетах.
С нашей точки зрения для составления материального баланса процесса, оценки движущей силы массопереноса и определения
размеров абсорбера, равновесие в системе газ - сероводород – диоксид углерода – раствор этаноламина должно быть
представлено в виде зависимостей между концентрацией этих компонентов в растворе и равновесным давлением их в газовой
фазе.
Для удобства расчетов состав раствора должен определяться общей концентрацией сероводорода или диоксида углерода в нем.
Пренебрегая концентрацией свободного сероводорода или диоксида углерода в растворе из-за низкой физической растворимости
их в воде, общая концентрация сероводорода в растворе CH2S может быть представлена как сумма
концентраций сероводорода H2S, связанного в виде (RNH3)2S и
RNH3HS, а общая концентрация диоксида углерода CCO2 как сумма концентраций
CO2, связанного в виде (RNH3)2CO3 и
RNH3HCO3.
При этом уравнения равновесия в рассматриваемой системе могут быть представлены в виде:
 ,
, 
(4.11)
Конкретный вид этих зависимостей может быть определен путем совместного решения уравнений равновесия химических
реакций, протекающих в растворе, и уравнений рабочих линий процесса абсорбции по разработанной нами методике.
5. РАЗРАБОТКА МЕТОДИКИ РАСЧЕТА ЭТАНОЛАМИНОВОЙ СЕРООЧИСТКИ ТЕХНОЛОГИЧЕСКИХ ГАЗОВ
Суть методики заключается в том, что при заданных значениях концентрации диоксида углерода CCO2
и сероводорода CH2S в поглотительном растворе определяются значения парциальных давлений этих
компонентов в очищаемом газе при равновесии путем совместного решения уравнений равновесия реакций, протекающих в
растворе:
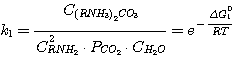
(5.1)
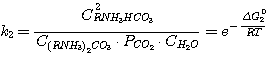
5.2)
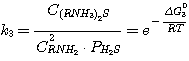
(5.3)

(5.4)
где C(RNH3)2CO3, CRNH3HCO3,
C(RNH3)2S, CRNH3HS, CRNH2 - мольные
концентрации соответствующих соединений в растворе при равновесии, кмоль/м3;
Δ G01, Δ G02, Δ G03,
Δ G04 - изменение стандартного изобарного потенциала при протекании указанных выше реакций.
Пренебрегая концентрацией свободного диоксида углерода в растворе, общую концентрацию его в растворе можно представить
как сумму концентраций карбоната и гидрокарбоната этаноламина:
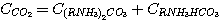
(5.5)
Аналогично общая концентрация сероводорода в растворе может быть представлена в виде:

(5.6)
Для решения системы уравнений (5.1), (5.2), (5.3), (5.4) выразим концентрации
C(RNH3)2CO3, CRNH3HCO3,
C(RNH3)2S и CRNH3HS через общие концентрации диоксида углерода
и сероводорода в растворе:
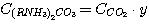
(5.7)
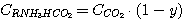
(5.8)
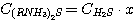
(5.9)
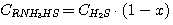
(5.10)
где у – доля диоксида углерода в растворе, связанного в виде C(RNH3)2CO3;
х - доля сероводорода в растворе, связанного в виде C(RNH3)2S.
Концентрация свободного этаноламина в растворе при равновесии может быть представлена в виде:
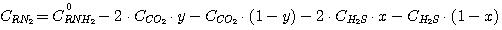
(5.11)
или

(5.12)
где С0RNH2 - начальная концентрация этаноламина в растворе, подаваемого в абсорбер.
Тогда уравнения (5.1), (5.2), (5.3), (5.4) принимают вид:
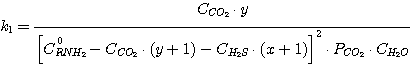
(5.13)
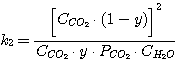
(5.14)
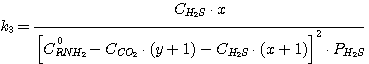
(5.15)
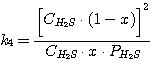
(5.16)
Решая совместно уравнения (5.13), (5.14), (5.15), (5.16) при известных значениях констант равновесия k1,
k2, k3, k4 и заданных значениях C0RNH2,
CCO2, CH2S, определяют значения х, у, PH2S и
PCO2.
Результаты расчетов представляют в виде графиков PCO2 - CCO2 и
PH2S - CH2S или в виде эмпирических зависимостей
PCO2 = f1(CCO2),
PH2S = f2(CH2S).
Соотношения между принимаемыми значениями CCO2 и CH2S не могут быть
произвольными, так как они определяются уравнениями рабочих линий процессов абсорбции диоксида углерода и сероводорода.
В соответствии с приведенной на рис. 2 схеме эти уравнения могут быть представлены в виде:
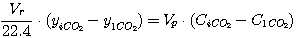
(5.17)
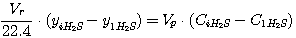
(5.18)
где Vr - расход газа, нм3/час;
yiCO2, yiH2S - концентрация диоксида углерода и
сероводорода в газе, кмоль/кмоль нм3 газа;
Vp - расход раствора, м3/час;
CiCO2, CiH2S - концентрация диоксида углерода и
сероводорода в растворе, кмоль/м3.
Задаваясь различными значениями yiCO2 и yiH2S в интервале концентраций
от y1 до yn, определяют значения концентраций CiCO2 и CiH2S
в различных сечениях абсорбера. Для получения значений CiCO2 и CiH2S
определяют равновесные давления диоксида углерода и сероводорода в очищаемом газе по рассмотренной методике.

Рисунок 2 – Схема распределения рабочих концентраций СО2 и H2S в газе и растворе
по высоте абсорбера
ВЫВОДЫ
Технологические газы содержат сернистые и другие вредные примеси, исключающие их использование в качестве топлива или
химического сырья без предварительной очистки, поскольку используемый в быту и в технологических процессах газ должен
содержать минимальное количество кислых компонентов.
Для очистки природного газа от сероводорода, диоксида углерода и других примесей преимущественное применение получили
абсорбционные методы, в которых в качестве абсорбентов служат водные растворы этаноламинов. В настоящее время повышенный
интерес к этим методам проявляют также специалисты по технологии сероочистки коксового газа. На некоторых коксохимических
заводах ведется проектирование и начато строительство цехов моноэтаноламиновой сероочистки.
Проектирование новых и реконструкция действующих установок для очистки газов от вредных примесей требует разработки
теоретически обоснованных методов расчетов технологических процессов, лежащих в основе проекта. На сегодняшний день
теоретические основы расчетов этаноламиновых методов очистки газов разработаны недостаточно, поэтому их проектирование
производится с помощью упрощенных зависимостей и диаграмм, основанных на практических данных о работе промышленных
установок.
Одна из немногих попыток разработки теоретически обоснованной методики расчета процесса очистки природного газа от
сероводорода и диоксида углерода водным раствором моноэтаноламина, представленная в справочном пособии Кузнецова А.А.,
является некорректной, поскольку содержит ошибки теоретического и методологического характера.
С нашей точки зрения для составления материального баланса процесса, оценки движущей силы массопереноса и определения
размеров абсорбера, равновесие в системе газ - сероводород – диоксид углерода – раствор этаноламина должно быть
представлено в виде зависимостей между концентрацией этих компонентов в растворе и равновесным давлением их в газовой фазе.
Для удобства расчетов состав раствора должен определяться общей концентрацией сероводорода или диоксида углерода в
нем. Пренебрегая концентрацией свободного сероводорода или диоксида углерода в растворе из-за низкой физической
растворимости их в воде, общая концентрация сероводорода в растворе CH2S может быть представлена как
сумма концентраций сероводорода H2S, связанного в виде (RNH3)2S и
RNH3HS, а общая концентрация диоксида углерода CCO2 как сумма концентраций
CO2, связанного в виде (RNH3)2CO3 и RNH3HCO3.
При этом уравнения равновесия в рассматриваемой системе могут быть представлены в виде:
P*H2S = f1(CH2S) и
P*CO2 = f2(CCO2).
Конкретный вид этих зависимостей может быть определен путем совместного решения уравнений равновесия химических
реакций, протекающих в растворе, и уравнений рабочих линий процесса абсорбции по разработанной нами методике.
Суть методики заключается в том, что при заданных значениях концентрации диоксида углерода CCO2
и сероводорода CH2S в поглотительном растворе определяются значения парциальных давлений этих
компонентов в очищаемом газе при равновесии путем совместного решения уравнений равновесия реакций, протекающих
в растворе.
В дальнейшем планируется произвести пример расчета очистки природного газа от сероводорода и диоксида углерода
раствором моноэтаноламина, а также пример расчета регенерации раствора моноэтаноламина.
Состав насыщенного раствора определяется составом исходного раствора, количеством поглощенных сероводорода и
диоксида углерода и значениями констант равновесия химических реакций, протекающих в растворе. Последние не могут быть
определены из-за отсутствия в справочной литературе значений изобарных потенциалов этаноламинов и их соединений с
сероводородом и диоксидом углерода в растворах. Поэтому для решения этой задачи потребуется использование приближенных
методов расчета изобарных потенциалов названных соединений или экспериментальные определения их. В качестве первого
приближения могут быть использованы после необходимой и обоснованной корректировки данные, приведенные в
справочном пособии Кузнецова А.А. и Судакова Е.Н.
ПЕРЕЧЕНЬ ССЫЛОК
1. Бусыгина Н.В., Бусыгин И.Г. Технология переработки природного газа и газового конденсата. – Оренбург: ИПК
«Газпромпечать» ООО «Оренбурггазпромсервис», 2002. – 432 с.
2. Бекиров Т.М., Туревский Е.Н., Бахшиян Д.Ц. Совершенствование методов расчета процессов подготовки и переработки
природного газа. М.: ВНИИЭГАЗПРОМ, 1978. – 56 с.
3. Касаткин А.Т. Основные процессы и аппараты химической технологии. М.: Химия, 1973. - 750 с.
4. Кузнецов А.А., Судаков Е.Н. Расчеты основных процессов и аппаратов переработки углеводородных газов: Справочное
пособие. - М.: Химия, 1983. – 223 с.
5. Литвиненко М.С. Очистка коксового газа от сероводорода. Харьков: Металлургиздат, 1959. – 307с.
Главная страница
Библиотека
Ссылки
Отчет о поиске
Истории, ледянящие кровь
Портал магистров ДонНТУ
ДонНТУ
© ДонНТУ Комиссарова О.В. 2008
2RNH2+CO2+H2O ↔ (RNH3)2CO3 |
(4.1) |
(RNH3)2CO3+CO2+H2O ↔ 2RNH3HCO3 |
(4.2) |
2RNH2+H2S ↔ (RNH3)2S |
(4.3) |
(RNH3)2S+H2S ↔ 2RNH3HS |
(4.4) |
где R – группа ОНСН2СН2-.
Для определения степени превращения сероводорода и диоксида углерода по этим реакциям используются выражения констант
равновесия, которые с учетом давления в аппарате и протекания реакций в растворе представлены в следующем виде:
|
|
(4.5) |
|
|
(4.6) |
|
|
(4.7) |
|
|
(4.8) |
где  – давление в аппарате;
– давление в аппарате;
Σ ni – общее число молей реагирующей смеси;
Δ n – разность чисел молей продуктов и исходных реагентов в реакциях (1)-(4).
Следует, однако, подчеркнуть, что эти выражения справедливы для реакций, протекающих в газовой фазе, и неприемлемы
для расчета реакций, протекающих в растворе.
Для определения степени превращения по каждой реакции состав исходной смеси принимается равным стехиометрическому,
тогда как следует брать фактический состав исходной реакционной смеси. Кроме того, степень превращения по каждой реакции
определяется независимо одна от другой, когда задача должна решаться путем совместного рассмотрения четырех уравнений.
Более того, такое решение справедливо только для замкнутой системы, а также при прямоточном движении фаз в открытой
системе. При противоточном движении газа и жидкости в абсорберах исходная смесь в каждом сечении имеет различный состав,
и поэтому такое решение лишено всякого смысла.
В результате неправильного расчета, основанного на вышеуказанных формулах, определено, что в насыщенном растворе доля
химически связанного диоксида углерода составляет 0,5%, а доля сероводорода - 3%. Остальная масса этих кислых компонентов
находится в растворе в свободном состоянии. Возникает вопрос: зачем тогда применять этаноламин, если он не связывает
поглощенные кислые газы?
Методика составления теплового баланса абсорбера неоправданно усложнена и содержит ряд серьезных ошибок. Например,
энтальпия газообразных смесей определяется по эмпирическим формулам для каждого компонента по отношению к 0°К:

(4.9)
где А, В, С, D – коэффициенты, Т – температура, К.
А для растворов – по отношению к 0°С в соответствии с общепринятой практикой термодинамических расчетов:

(4.10)
где Cp – удельная теплоемкость раствора, кДж/(кг•°С), t – температура, °С.
Такой подход к составлению теплового баланса является недопустимым с теоретической точки зрения, так как при переходе
значительного количества компонентов из одной фазы в другую он приведет к серьезным ошибкам в расчетах.
С нашей точки зрения для составления материального баланса процесса, оценки движущей силы массопереноса и определения
размеров абсорбера, равновесие в системе газ - сероводород – диоксид углерода – раствор этаноламина должно быть
представлено в виде зависимостей между концентрацией этих компонентов в растворе и равновесным давлением их в газовой
фазе.
Для удобства расчетов состав раствора должен определяться общей концентрацией сероводорода или диоксида углерода в нем.
Пренебрегая концентрацией свободного сероводорода или диоксида углерода в растворе из-за низкой физической растворимости
их в воде, общая концентрация сероводорода в растворе CH2S может быть представлена как сумма
концентраций сероводорода H2S, связанного в виде (RNH3)2S и
RNH3HS, а общая концентрация диоксида углерода CCO2 как сумма концентраций
CO2, связанного в виде (RNH3)2CO3 и
RNH3HCO3.
При этом уравнения равновесия в рассматриваемой системе могут быть представлены в виде:
 ,
, 
(4.11)
Конкретный вид этих зависимостей может быть определен путем совместного решения уравнений равновесия химических
реакций, протекающих в растворе, и уравнений рабочих линий процесса абсорбции по разработанной нами методике.
|
|
(4.9) |
где А, В, С, D – коэффициенты, Т – температура, К.
|
|
(4.10) |
где Cp – удельная теплоемкость раствора, кДж/(кг•°С), t – температура, °С.
|
(4.11) |
5. РАЗРАБОТКА МЕТОДИКИ РАСЧЕТА ЭТАНОЛАМИНОВОЙ СЕРООЧИСТКИ ТЕХНОЛОГИЧЕСКИХ ГАЗОВ
Суть методики заключается в том, что при заданных значениях концентрации диоксида углерода CCO2
и сероводорода CH2S в поглотительном растворе определяются значения парциальных давлений этих
компонентов в очищаемом газе при равновесии путем совместного решения уравнений равновесия реакций, протекающих в
растворе:
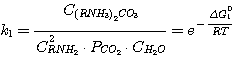
(5.1)
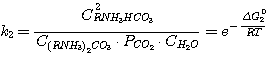
5.2)
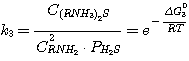
(5.3)

(5.4)
где C(RNH3)2CO3, CRNH3HCO3,
C(RNH3)2S, CRNH3HS, CRNH2 - мольные
концентрации соответствующих соединений в растворе при равновесии, кмоль/м3;
Δ G01, Δ G02, Δ G03,
Δ G04 - изменение стандартного изобарного потенциала при протекании указанных выше реакций.
Пренебрегая концентрацией свободного диоксида углерода в растворе, общую концентрацию его в растворе можно представить
как сумму концентраций карбоната и гидрокарбоната этаноламина:
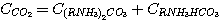
(5.5)
Аналогично общая концентрация сероводорода в растворе может быть представлена в виде:

(5.6)
Для решения системы уравнений (5.1), (5.2), (5.3), (5.4) выразим концентрации
C(RNH3)2CO3, CRNH3HCO3,
C(RNH3)2S и CRNH3HS через общие концентрации диоксида углерода
и сероводорода в растворе:
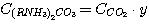
(5.7)
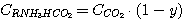
(5.8)
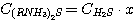
(5.9)
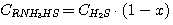
(5.10)
где у – доля диоксида углерода в растворе, связанного в виде C(RNH3)2CO3;
х - доля сероводорода в растворе, связанного в виде C(RNH3)2S.
Концентрация свободного этаноламина в растворе при равновесии может быть представлена в виде:
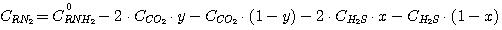
(5.11)
или

(5.12)
где С0RNH2 - начальная концентрация этаноламина в растворе, подаваемого в абсорбер.
Тогда уравнения (5.1), (5.2), (5.3), (5.4) принимают вид:
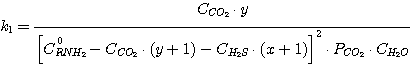
(5.13)
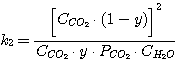
(5.14)
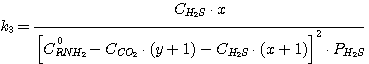
(5.15)
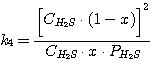
(5.16)
Решая совместно уравнения (5.13), (5.14), (5.15), (5.16) при известных значениях констант равновесия k1,
k2, k3, k4 и заданных значениях C0RNH2,
CCO2, CH2S, определяют значения х, у, PH2S и
PCO2.
Результаты расчетов представляют в виде графиков PCO2 - CCO2 и
PH2S - CH2S или в виде эмпирических зависимостей
PCO2 = f1(CCO2),
PH2S = f2(CH2S).
Соотношения между принимаемыми значениями CCO2 и CH2S не могут быть
произвольными, так как они определяются уравнениями рабочих линий процессов абсорбции диоксида углерода и сероводорода.
В соответствии с приведенной на рис. 2 схеме эти уравнения могут быть представлены в виде:
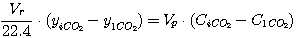
(5.17)
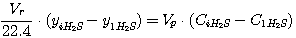
(5.18)
где Vr - расход газа, нм3/час;
yiCO2, yiH2S - концентрация диоксида углерода и
сероводорода в газе, кмоль/кмоль нм3 газа;
Vp - расход раствора, м3/час;
CiCO2, CiH2S - концентрация диоксида углерода и
сероводорода в растворе, кмоль/м3.
Задаваясь различными значениями yiCO2 и yiH2S в интервале концентраций
от y1 до yn, определяют значения концентраций CiCO2 и CiH2S
в различных сечениях абсорбера. Для получения значений CiCO2 и CiH2S
определяют равновесные давления диоксида углерода и сероводорода в очищаемом газе по рассмотренной методике.
|
|
(5.1) |
|
|
5.2) |
|
|
(5.3) |
|
|
(5.4) |
где C(RNH3)2CO3, CRNH3HCO3, C(RNH3)2S, CRNH3HS, CRNH2 - мольные концентрации соответствующих соединений в растворе при равновесии, кмоль/м3;
Δ G01, Δ G02, Δ G03, Δ G04 - изменение стандартного изобарного потенциала при протекании указанных выше реакций.
|
|
(5.5) |
|
|
(5.6) |
|
|
(5.7) |
|
|
(5.8) |
|
|
(5.9) |
|
|
(5.10) |
где у – доля диоксида углерода в растворе, связанного в виде C(RNH3)2CO3;
х - доля сероводорода в растворе, связанного в виде C(RNH3)2S.
|
|
(5.11) |
или
|
|
(5.12) |
где С0RNH2 - начальная концентрация этаноламина в растворе, подаваемого в абсорбер.
|
|
(5.13) |
|
|
(5.14) |
|
|
(5.15) |
|
|
(5.16) |
|
|
(5.17) |
|
|
(5.18) |
где Vr - расход газа, нм3/час;
yiCO2, yiH2S - концентрация диоксида углерода и сероводорода в газе, кмоль/кмоль нм3 газа;
Vp - расход раствора, м3/час;
CiCO2, CiH2S - концентрация диоксида углерода и сероводорода в растворе, кмоль/м3.
