


| Спеціальність: | Екологія хімічних виробництв |
| Тема випускної роботи: | Активація сполук лужноземельних металів у реакціях взаємодії з діоксидом сірки |
| Науковий керівник: | Доктор хімічних наук, професор Шаповалов Валерій Васильович |
Ціли та завдання, які вирішуються у даному досліждженні — це виічення процесу активації сполук лужноземельних металів у реакціях взаємодії з діоксидом сірки, виявлення найбільш ефективного активатору .
Незважаючи на те, що концентрація сірчистого ангідриду у відхідних газах проміслових підприємств відносно невелика, завдяки своєї високої токсичності як для тварин, так і для рослин він є однією з найбільш небезпечних речовин, що забруднюють атмосферу. Тому очищення так званих бідних сірчистих газів, що випускаються у атмосферу, від сірчистого ангідриду є одним з першочергових завдань санітарної охорони чистоти повітря.
Наукова новизна дослідження полягає у використовуванні активаторів для інтенсифікації процесу поглинення діоксиду сірки лужноземельними металами.
В наслідку даного дослідження планується вивчити процес активації лужноземельних металів у реакціях взаємодії з діоксидом сірки, його термодинамічні і кінетичні характеристики. На основі практичних досліджень буде зроблено вивод, який з вивчених активаторів є найбільш раціональним для використання як активатор поглинення на підприємствах, що користуються паливом, яке містить сірку.
Усі процеси очищення від сірчистого ангідриду доцільно розділити на два основних класу, які відрізняються за фізичним стану основного реагенту, що застосовується для добування сірчистого ангідріда з газів[1]. Перший клас включає в себе процеси з абсорбції сірчистого ангідриду, що здійснюється при порівняно низьких температурах ( «рідинні» методи). До другого класу відносять методи, засновані на взаємодії між газом і твердою фазою. Кожен з цих класів принципово може бути подрозподілу на три основні групи, що відрізняються за методами використання витягаються сірчистого ангідриду. Перша група включає процеси, основною метою яких є лише очищення газів без урахування можливостей утілізації витягаються сірчистого ангідриду. Продукти основного взаємодії сірчистого ангідриду з поглотителем є відходом. До другої групи належать циклічні пропроцеси і методи з отриманням товарного сірчистого ангідриду або елементарної сірки. У ході цих процесів виробляють регенерацію поглинача. У третю групу процесів очищення газів входять процеси, при яких вилучення сірчистого ангідріда здійснюється спільно з його використанням для одержання нових хімічних речовин.[2]
У зв'язку з тим, що рідинні методи вимагають попереднього охолодження відхідних газів, великих енергетичних витрат і великої витрати води, для теплових електростанцій, що працюють на сірчистих видах палива, більш доцільними є методи очистки, засновані на взаємодії між газом і твердою фазою. Як поглиначі найчастіше використовуються оксиди марганцю, заліза, кальцію, їх суміші, вугілля, цеоліти, и др.
Для отримання кількісних оцінок, можливості здійснення сорбції діоксиду сірки різними сполуками, були здійснені термодинамічні розрахунки реакцій. Зробити висновок про можливість протікання реакції між хімічними сполуками можна використовуючи дані про зміну енергії Гіббса в ході цієї реакції.[3] Термодинамічний потенціал визначається різницею між ентальпійним (ΔH) і ентропійним (T·ΔS) факторами, які діють на систему в ході хімічної взаємодії:
Характер зміни енергії Гіббса дозволяє судити про принципову можливість здійснення процесу. При ΔG<0 процес може протікати, при ΔG>0 процес протікати не може (іншими словами, якщо енергія Гіббса у початковому стані системи більше, ніж в кінцевому, то процес принципово може протікати, якщо навпаки — то не може). Якщо ж ΔG=0, то система перебуває в стані хімічної рівноваги. Аналіз рівняння дозволяє встановити, який з факторів, що представляють енергію Гіббса, відповідальний за напрямок протікання хімічної реакції:
Реакція можлива, якщо вона супроводжується зменшенням ізобарного потенціалу; при кімнатній температурі, коли значення T невелике, значення T·ΔS також невелике, і зміна ентальпії більше T·ΔS. Чим вища температура, тим більше T·ΔS, і навіть ендотермічна реакції стають здійснюваними.[4]
Для розрахунку енергії Гіббса початковими даними є значення змін ентальпії і ентропії хімічної реакції при певній температурі.[5] У розрахунках приймалася температура 298К, при якій розраховувалися значення ентальпії і ентропії реакцій.[6] Розрахунок зроблений для оксидів та карбонатів ряду Mg — Ca — Sr — Ba, виявляють сорбційні активність, фосфатів і нітратів цих металів, які можуть бути використані як модифікуючи добавки поглиначів. Дані, отримані при розрахунку енергії Гіббса, зведені в таблицю.
| № | Реакція | ΔH, кДж/моль | ΔS, Дж/моль·К | ΔG, кДж/моль |
|---|---|---|---|---|
| 1 | MgO+SO2→MgSO3 | -116,54 | -188,91 | -60,24 |
| 2 | CaO+SO2→CaSO3 | -227,40 | -186,4 | -171,85 |
| 3 | SrO+SO2→SrSO3 | -299,80 | -189,53 | -243,32 |
| 4 | BaO+SO2→BaSO3 | -351,80 | -199,6 | -292,32 |
| 5 | MgO+SO2+O2→MgSO4 | -386,40 | -286,15 | -301,13 |
| 6 | CaO+SO2+O2→CaSO4 | -492,00 | -283,615 | -407,48 |
| 7 | SrO+SO2+O2→SrSO4 | -555,10 | -283,315 | -470,67 |
| 8 | BaO+SO2+O2→BaSO4 | -611,50 | -289,115 | -525,34 |
| 9 | Mg(NO3)2+SO2→MgSO4+2NO2 | -130,90 | 159,7 | -178,49 |
| 10 | Ca(NO3)2+SO2→CaSO4+2NO2 | -122,50 | 145,6 | -165,89 |
| 11 | Sr(NO3)2+SO2→SrSO4+2NO2 | -102,50 | 159,2 | -149,94 |
| 12 | Ba(NO3)2+SO2→BaSO44+2NO2 | -113,70 | 149,9 | -158,37 |
| 13 | Mg3(PO44)2+3SO2→3MgSO3+0,5P4O10 | 94,06 | -560,5 | 261,09 |
| 14 | Ca3(PO4)2+3SO2→3CaSO3+0,5P4O10 | 12,00 | -561,67 | 179,38 |
| 15 | Sr3(PO4)2 +3SO2→3SrSO3+0,5P4O10 | -33,62 | – | – |
| 16 | Ba3(PO4)2+3SO2→3BaSO3+0,5P4O10 | – | – | – |
| 17 | MgCO3+SO2→MgSO3+CO2 | -15,85 | -14,01 | -11,68 |
| 18 | CaCO3+SO2→CaSO3+CO2 | -50,01 | -26,00 | -42,26 |
| 19 | SrCO3+SO2→SrSO3+CO2 | -65,21 | -18,90 | -59,58 |
| 20 | BaCO3+SO2→BaSO33+CO2 | -99,91 | -27,80 | -91,63 |
| 21 | MgCO3+SO2+O2→MgSO4+CO2 | -285,71 | -111,12 | -252,60 |
| 22 | CaCO3+SO2+O2→CaSO4+CO2 | -314,61 | -123,21 | -277,89 |
| 23 | SrCO3+SO2+O2→SrSO4+CO2 | -320,51 | -112,42 | -287,01 |
| 24 | BaCO3+SO2+O2→BaSO4+CO2 | -359,61 | -117,32 | -324,65 |
З отриманих термодинамічних оцінок видно, що енергія Гіббса реакцій з двоокисом сірки в ряді сполук Mg — Ba менше 0, менше 0, за винятком фосфатів, що визначає їх інертність по відношенню до SO2. При розгляді ряду Mg — Ca — Sr — Ba енергія Гіббса закономірно зменшується, як наслідок у багатокомпонентних системах пріоритет у реакції мати з'єднання металів з великою молекулярною вагою. З цього випливає, що термодинамічно можливе застосування всіх оксидів та карбонатів лужноземельних металів для фіксації діоксиду сірки з газових сумішей. Отримані дані ΔG<0 для нітратів лужних металів (при ΔH<0 і ΔS>0), свідчать про можливість їх застосування для активації сполук лужноземельних металів для поглинання діоксиду сірки.
Використання карбонату кальцію як адсорбента представляється раціональним з наступних причин:
Процес поглинання сірчистого ангідриду при відсутності кисню відбувається згідно реакції:
Розрахункова адіабатична температура складає 381.69К.
При нагріванні утворився сульфіта кальцію відбувається його діспропорціювання:
Розрахункова адіабатична температура реакції складає 663.87К. У присутності кисню в суміші може протікати наступна реакція:
З урахуванням можливого плавлення CaSO4 адіабатична температура реакції складає 1512К. За розрахунками реакція термодинамічно можлива, відбувається при високих температурах, супроводжується виділенням тепла
Так само при температурах понад 873К можливо часткове розкладання CaCO3:
Отже для здійснення поглинання сірчистого ангідриду карбонатом кальцію не вимагається попереднє охолодження димових газів. В умовах виробництва вміст кисню і сірчистого ангідриду буде в надлишку по відношенню до стехіометричної. Тому був проведений розрахунок адіабатична температури реакції при різних співвідношеннях мольних надлишків сірчистого ангідриду і кисню (Рис.1).
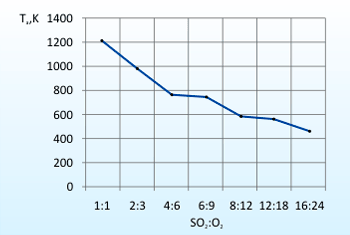
Згідно з графіком адіабатичної температура реакції буде зменшуватися при збільшенні мольного співвідношення сірчистого ангідриду і кисню.
Таким чином, поглинання сірчистого ангідриду карбонатом кальцію можна проводити в широкому інтервалі температур. Всі реакції процесу супроводжуються виділенням тепла, яке в подальшому можна використовувати.[7]
Процеси взаємодії діоксиду сірки з сполуками лужноземельних металів здійснювали на установці, представленої на рисунку 2.
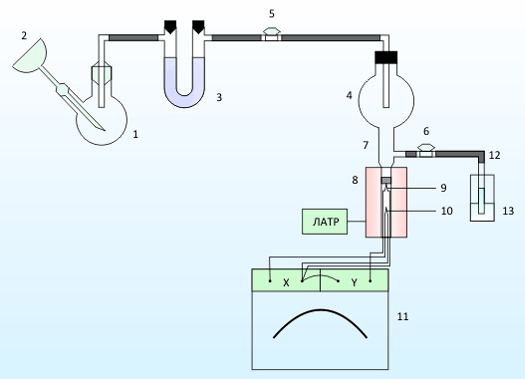
Діоксид сірки одержують у реакторі 1 при взаємодії розрахованого кількості суспензії сульфіта натрію з концентрованої сірчаної кислоти, яку додають через крапельну воронку 2.[8] Далі отриманий газ проходить осушення за допомогою сілікагеля в поглинувальній трубці 3, і надходить в проміжну збірка 4 через кран 5. Проміжна збірка 4 з'єднана з реакційною посудина 7 з допомогою прозорого шліфу. У реакційній посудині повинен бути поміщений досліджуваний адсорбент.
У нижній частині посудини 7 знаходиться виїмка для термопари зразка 9. Сама реакційна посудина поміщена в трубчасту піч 8, температура її нагрівання регулюється за допомогою лабораторного автотрансформатора. У нагрівальному каналі печі знаходиться еталонна термопара 10. Термопари підключені диференціально до самописця 11 для кращої фіксації можливого термічного ефекту реакції. Надлишки газу відводяться за допомогою крана 6 і скляної трубки 12 у склянку з поглотітельним розчином 13.[9]
Для вивчення спектральних характеристик речовини було використана методика реєстрації ІЧ-спектрів поглинання, що реалізувалася на стандартному приладі «Specord 75IR
Основними складовими частинами пристрою приладу є:
Принципова схема спектрофотометру наведена на рисунку 3.
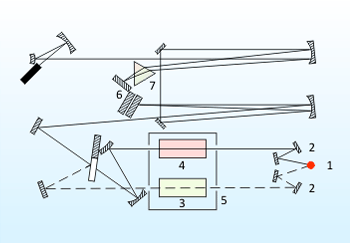
Випромінювання, яке проходить з джерела (1), з допомогою системи дзеркал (2) йдуть на досліджувану і еталонну проби в кюветне відділення (5) спектрофотометру. Далі обидва випромінювання з'єднуються і прямують системою дзеркал на вхід монохроматора. Основною частиною монохроматора є дифракционного решітка (6) та призма (7), які виділяють із загального випромінювання компонент з відповідною довжиною хвилі. Потім промені потрапляють на термоелемент, що в комплекті з підсилювальною системою виробляє сигнал, що керує рухом пера самописця. В залежності від кута повороту дифракционних решіток та призми на приймач потрапляє монохроматичне випромінювання з різною довжиною хвилі. Повертаючи решітку і призму, наприклад, за допомогою електродвигуна, можна забезпечити безперервну розгортку випромінювання за довжинами хвилі. З допомогою приймача можна виміряти інтенсивність випромінювання, що пройшло через зразок, як функцію довжини хвилі, яка і є ІЧ-спектром.[10]
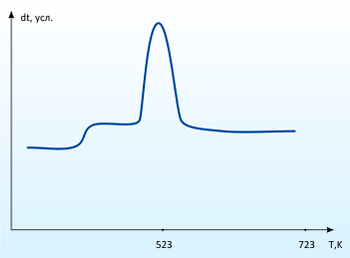
Дослідження поглинання діоксиду сірки карбонатом кальцію в лабораторних умовах показали, що при температурах до 500°С активного поглинання не відбувається. Але при додаванні нітратів лужних металів в якості каталізаторів ефективність протікання реакції істотно зростає. На рисунку 4 представлено криву ДТА процесу поглинання діоксиду сірки карбонатом кальцію в присутності активаторів (10% мас.). По даній кривій можна судити про інтенсивності протікання процесу. Маса реагує суміші після процесу поглинання збільшилася на 16%. ІЧ - спектр продукту реакції представлений на малюнку 5. Порівняння спектру з таблицями характерістіческіх частот дозволяє зробити висновок про те, що в даному зразку є аніони SO32-, SO4 2-,CO32-.
Разом з даними про зміну маси продукту реакції можна зробити висновок про те, що процес поглинання діоксиду сірки проходить з утворенням як сульфіта, так і сульфату кальцію при досить низьких температурах.
З отриманих термодинамічних оцінок видно, що енергія Гіббса реакцій з двоокисом сірки в ряді сполук Mg — Ba менше 0, за винятком фосфатів, що визначає їх інертність по відношенню до SO2. При розгляді ряду Mg — Ca — Sr — Ba енергія Гіббса закономірно зменшується, як наслідок у багатокомпонентних системах пріоритет у реакції маэ з'єднання металів з великою молекулярною вагою. З цього випливає, що термодинамічно можливе застосування всіх оксидів та карбонатів лужноземельних металів для фіксаціі діоксиду сірки з газових сумішей. Отримані дані ΔG<0 для нітратів лужних металів (при ΔH<0 и ΔS>0), свідчать про можливість їх застосування для активації сполук лужноземельних металів для поглинання діоксиду сірки
Використання в якості адсорбенту карбонату кальцію представляється раціональним з наступних причин:
Процес поглинання діоксиду сірки проходить з утворенням як сульфіта, так і сульфату кальцію при досить низьких температурах. З цього випливає, що суміші карбонату кальцію з нітратами лужних металів становить інтерес як поглиначі на підприємствах, що використовують серосодержащее паливо.