 |
Английский
|
Английский
 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Об авторе Об авторе
 Библиотека Библиотека
 Ссылки Ссылки
 Отчет о поиске Отчет о поиске
 Бисероплетение Бисероплетение |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Реферат по теме выпускной работыАктуальность работы состоит в следующем: 1) Отсутствуют сведения о масштабах загрязнения фторидами и нитратами биологических объектов; 2) Заметная биологическая активность и высокая токсичность фторидов и нитратов делают необходимым изучение процессов их трансформации и миграции. Цель работы – определение содержания фторидов и нитратов в природных водах селитебных территорий Донецкой области. Научная новизна – впервые осуществить оценку масштабов загрязнения природных вод нитратами и фторидами с использованием карт-схем. В задачи настоящих исследований входило: 1) сбор и анализ информации относительно путей поступления, токсичности нитратов и фторидов, а также методов определения их содержания в природных водах селитебных территорий Донецкой области; 2) отбор и анализ проб воды; 3) обработка результатов исследования проб воды; 4) составление карт-схем, описывающих масштабы загрязнения нитратами и фторидами. Острой проблемой нашего времени является неконтролированное загрязнение окружающей среды, связанное с деятельностью человека. Особенно опасным является загрязнение водных ресурсов, в частности питьевых в селитебных районах, поскольку их запасы ограничены. Украинцы получают питьевую воду не только из систем централизованного водоснабжения. Приблизительно треть населения страны пользуется водой из подземных источников. Это, как правило, сельские колодцы. Грунтовые и подземные воды часто используются населением для питьевых целей, между тем именно они имеют тенденцию к аккумуляции токсичных загрязнений. В связи с этим целесообразными являются исследования и контроль подземных вод, которые используют для питьевых целей. НитратыАнтропогенные источники нитратов подразделяются на аграрные (минеральные и органические удобрения, животноводческое производство), индустриальные (отходы промышленного производства и сточные воды) и коммунально-бытовые (использование осадков сточных вод в качестве удобрений или с целью мелиорации земель). Наряду с рассмотренными выше аграрными источниками увеличение уровня нитратов в агроландшафтах может быть обусловлено и иными формами сельскохозяйственной деятельности. Так, замена традиционных систем земледелия с участием и чередованием разнообразных культур более интенсивными и специализированными технологиями, которые способствуют усилению минерализации органического вещества почвы и разрушению ее структуры, ограничение площадей, занятых травами, распашка кормовых угодий под постоянную пашню, утяжеление машин и их использование на постоянных технологических колеях, отсутствие защитных зон вокруг полей приводят в конечном счете к усилению внутрипочвенного и поверхностного выноса азота. Введение в севообороты чистых паров способствует интенсивному образованию и накоплению нитратов в почве, которые могут теряться при продолжительном выпадении осадков или кратковременных, но обильных ливнях. Потери нитратов из почвы возрастают при насыщении севооборотов пропашными культурами, агротехника которых требует большого числа междурядных обработок. В качестве косвенного фактора, увеличивающего вероятность выноса нитратов с дренажным стоком из почвы, можно рассматривать известкование почвы, стимулирующее минерализационные процессы. Концентрация нитратов в водоемах возрастает при мелиорации переувлажненных земель и в первые годы их сельскохозяйственного использования. Наиболее высокий уровень нитратов обнаруживается в магистральных водостоках, принимающих дренажные воды. Длительное сельскохозяйственное использование осушенных земель приводит к некоторому повышению содержания нитратов и в грунтовых водах. Токсичное влияние на человекаВыявлены два способа окисления гемоглобина HbFe2+. При прямом окислении роль окислителя играют нитрит-анионы [4]: Во время косвенного окисления гемоглобина сначала нитриты окисляются до нитратов с образованием пероксида водорода, затем последний вступает в реакцию с железом гемоглобина [4]: Угрозой для жизни является накопление в крови 20% и более метгемоглобина (HbFe3+). Наибольшая же опасность повышенного содержания нитратов в организме заключается в способности нитрит-иона участвовать в реакции нитрозирования аминов и амидов, в результате которой образуются нитрозосоединения, обладающие канцерогенным и мутагенным действием. Образование нитрозосоединений происходит при взаимодействии азотистой кислоты с вторичными аминами как в продуктах питания в процессе их кулинарной обработки, так и внутри организма [4]: N-нитрозосоединения имеют общую структуру: 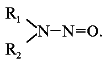 Особенно опасная MtHb для детей – сниженая кислотность желудочного сока приводит к развитию микроорганизмов- редуцентов [1]. Выделяют три основных клинических формы MtHb: бессимптомную – содержание MtHb до 5%; легкую – MtHb до 5 – 10% с цианозом, тахикардией; и тяжелую MtHb – до 20% с цианозом, тахикардией, тошнотой, рвотой, головными болями. При взаимодействии нитритов с аминопроизводными соединениями образуются потенциальные канцерогены – N-нитрозосоединения (НС), которые включают N-нитрозоамины. Последние являются потенциальными канцерогенами. Кроме злокачественных новообразований, НС характеризуются органотропным, мутагенным, эмбриотоксическим и тератогенным действием. Нитраты из организма человека выводятся лишь на 70 – 80%. ДСД нитрозоаминов – 1 мкг/кг, нитратов для взрослого населения – 5 мг/кг. Токсичное влияние на растенияНитраты, поступившие в растения, восстанавливаются по схеме: 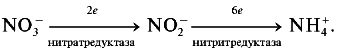 Первый этап восстановления нитрата протекает в соответствии с уравнением [4]: 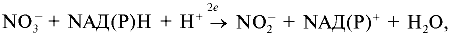 где NAД(Р)H – никотинамидадениндинуклеотидфосфат восстановленный, NAД(Р)+ – никотинамидадениндинуклеотидфосфат окисленный. Нитратредуктаза – фермент класса оксидоредуктаз, синтезируемый в клетках в ответ на поступление NO3-; им особенно богаты молодые листья и кончики корней [4]. Образующиеся нитриты не накапливаются, а быстро восстанавливаются до NH4+ с помощью фермента – нитритредуктазы: 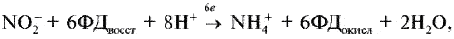 где ФД – ферредоксин – железосодержащий белок, выполняющий функции переносчика электронов. В таблице 1 приведены усредненные и граничные массовые доли нитрат-иона в продуктах питания [5]. Таблица 1 – Массовые доли нитрат-иона в продуктах питания
Из таблицы следует, что нет ни одного продукта питания, в котором допускается не контролировать содержание нитратов. Этот вывод в равной степени относится и к воде, особенно колодезной [5]. Токсичное влияние на гидробионтыПоведение нитратов в грунтеПодпороговая концентрация нитратов в воде, которые определяют за органолептическим показателем, – 400 мг/л [1]. Считают, что одним из опасных видов загрязнения водных источников есть загрязнение соединениями азота. В большинстве грантов основным азотным ионом-мигрантом является NO3-, что предопределенно его чрезвычайно высокой мобильностью. Водная миграция при этом является преобладающей формой. Процессы механической, физико-химической и химической адсорбции этого иону незначительные, их наблюдают в очень кислых почвах, где преобладают минералы типа каолина. Наибольшую вертикальную миграцию наблюдают на почвах легкого механического состава с низкой поглощающей способностью. Важное значение имеет то, что внесение минеральных удобрений увеличивает минерализационную способность почвы, чем усиливает вертикальную миграционную способность NO3- грунтового происхождения. Азот удобрений при этом фиксируется грунтовым комплексом и его миграция проявляется меньшей мерой. В большинстве почв среди многих показателей, от которых зависит миграционная способность NO3- (механический состав, вид культуры, влажность почвы, микробиологическая активность, дозы азотных удобрений) за одинаковых других условий, влияние азотных удобрений оказалось преобладающим [1]. Нитратный азот способен вымываться с инфильтрационными водами на значительную глубину. Исследованиями, проведенными на черноземе озоленном при длительном применении удобрений (35 лет) было установлено вымывание нитратов на глубину около 10 м с максимумом нагромождения на глубине 2-4 м. П.Копитко (в 1999 г.) указывает, что в интенсивных плодовых насаждениях нитраты могут мигрировать на глубину 25 м. Методы определенияНормативные документы: для питьевых вод ГОСТ 4192-82, для минеральных вод ГОСТ 23268. 8-78, для сточных вод ПНД Ф14.1:2:3-95. Метод применим для определения нитритов в поверхностных водах с содержанием от 0,007 до 0,35 мг N/л [2]. Метод основан на способности первичных ароматических аминов в присутствии азотистой кислоты давать интенсивно окрашенные диазосоединения. Оптическую плотность образованного диазосоединения определяют при X= 536 нм. Линейная зависимость между оптической плотностью растворов и концентрацией нитритов сохраняется в пределах от 0,007 до 0,350 мгN/дм3. Минимальная определяемая концентрация 0,007 мгN/дм3. Относительное стандартное отклонение U при концентрациях от 0,080 до 0,300 мгN/дм3 составляет 2% (и = 30), при концентрациях < 0,080 мгN/дм3 — 10%. Продолжительность определения единичной пробы 50 мин. Серия из 6 проб определяется в течение 1ч [2]. Мешающие влияния. Определению мешают сильные окислители и восстановите ли в концентрациях, редко встречающихся в природных водах. Действие трехвалентного железа, двухвалентной ртути, серебра, висмута, трехвалентной сурьмы, свинца, трехвалентного золота, хлорплатинатов и метаванадатов в сильно-загрязненных водах устраняется разбавлением исследуемой пробы дистиллированной водой, не содержащей нитритов. 2 Потенциометрический [6, 9] Сущность метода: нитраты в исследуемом растворе определяют по изменению ЭДС цепи, состоящей из нитратселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или иономера. Метод применяют при определении массовой концентрации нитратов от 50 до 500 мкг/дм3. Нижний предел обнаружения составляет 25 мкг/дм3 [6]. Электрод измерительный нитратселективный с электрическим сопротивлением 0,1-0,9 мОм в диапазоне молярных концентраций нитратов С от 10-4 до 10-1 моль/дм3 крутизна электродной характеристики (55±4) мВ/рС. Электрод заполняют раствором азотнокислого калия с молярной концентрацией 10-1 моль/дм3. Перед измерением электрод выдерживают в течение 24 ч в растворе азотнокислого калия с молярной концентрацией 10-4 моль/дм3 [6]. ФторидыВ организм человека фториды поступают с водой, продуктами питания, лекарственными препаратами, пестицидами, и значительная их часть является результатом деятельности людей [10]. Токсичное влияние на человекаПочваТоксичное влияние на растения и микроорганизмыТоксичное влияние на гидробионтыМетоды определения– вариант А – основан на способности фторид-иона образовывать растворимый в воде тройной комплекс сиреневато-синего цвета, в состав котрого входит лантан, ализаринкомплексон и фтор. Интенсивность окраски раствора фотометрируют при длине волны λ = (600±10) нм [3]. Определению фторида сильно мешают алюминий и железо, связывая его в комплекс и занижая результаты. Допустимая массовая концентрация алюминия не выше 0,2 мг/дм3, железа – не выше 0,7 мг/дм3. – вариант Б – основан на том же принципе, что и вариант А, но для повышения оперативности измерения оптической плотности определение проводят в водно-ацетатной среде, в которой полнота развития окраски тройного комплекса лантана, ализаринкомплексона и фторида достигается через 15 мин. 2 Потенциометрический [3] Метод позволяет определять суммарную концентрацию фторидов (всех его форм: иона фторида, его комплексных соединений). Для определения используют электродную систему, состоящую из фторидного ионселективного електрода и вспомагательного хлор-серебряного електрода. Измерение потенциала фторидного електрода проводят высокоомным рН-метром-милливольт-метром, заменив стеклянный электрод на фторидный, или прибором иономером (нитратомером). Определение возможно при массовой концентрации алюминия не выше 40 мг/дм3, железа – не выше 40 мг/дм3 [3]. Исследования водыОдним из наиболее быстрых и точных методов, с помощью которого определяют содержание нитратов, есть метод прямой потенциометрии с использованием ионоселективных к нитрат-ионам электродов [6, 9]. Прибор, принцип действия которого основан на этом методе, называется нитратомером (иономером) (рисунок 1). 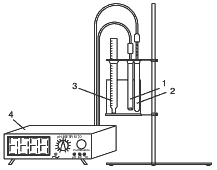 1 – нитратселективный электрод; 2 – вспомагательный электрод; 3 – термометр; 4 – иономер. Рисунок 1 – Схема установки для анализа Данные о содержании нитратов в пробах воды из разных водных источников области приведены в таблице 2. Таблица 2 – Содержание нитратов в пробах воды из разных водных источников
На рисунке 2 показана количество проб воды с превышением содержания нитратов от общего количества анализируемых проб воды. 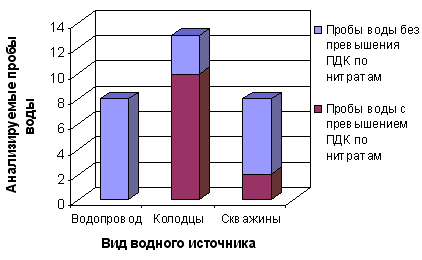 Рисунок 2 – Отношение проб воды с превышением ПДК по нитратам к общему количеству проб воды Полученные данные свидетельствуют о том, что 77% проанализированных образцов воды из питьевых колодцев имеют содержание нитратов выше ПДК (для нитратов составляет 45,0 мг/л). Этот показатель в анализируемой воде в 2,00 – 11,0 раз превышает ПДК (сравнительная характеристика приведена на рисунках 3, 4). 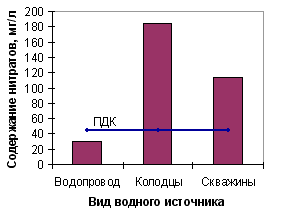 Рисунок 3 – Сравнение среднего содержания нитратов в пробах воды различных водных источников 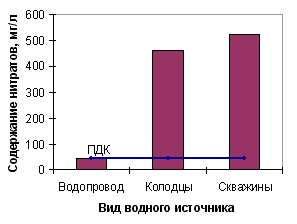 Рисунок 4 – Сравнение максимального содержания нитратов в пробах воды различных водных источников Наибольшее содержание нитратных ионов установлено в воде колодцев с. Желане (Ясинуватский р-н) – в 11 раз превышения ПДК – и в с. Красное (Красноармийский р-н) – в 7 раз превышения ПДК. Также установлено, что в колодезной воде наблюдается колебание содержания нитратов – от 3,1 до 460,0 мг/л, в воде из скважин – от 2,6 до 525,0 мг/л. Таким образом, контроль над содержанием нитратов и фторидов в воде является важной задачей. Уменьшение поступления азота в геологический круговорот возможно при принятии следующих мер: 1 усиление биологического круговорота путем нормируемого применения удобрений; 2 равномерного их распределения по поверхности полей; 3 обрабатывание склонов таким образом, чтобы максимально снизить поверхностный сток. ПРИМЕЧАНИЕ. При написании данного автореферата магистерская работа еще не завершена. Окончательное завершение: декабрь 2009 г. Полный текст работы и материалы по теме могут быть получены у автора или его руководителя после указанной даты. Литература
© ДонНТУ 2009 Прокопенко Наталья Юрьевна
|
 Об авторе Об авторе
 Библиотека Библиотека
 Ссылки Ссылки
 Отчет о поиске Отчет о поиске
 Бисероплетение Бисероплетение | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||