РЕАКЦИОННАЯ СПОСОБНОСТЬ СУЛЬФОХЛОРИДОВ АНИЛИДОВ СУЛЬФОКИСЛОТ - ХИМИЧЕСКИХ АГЕНТОВ ОБЕСФЕНОЛИВАНИЯ СТОКОВ – В ВОДНО-ОРГАНИЧЕСКИХ СМЕСЯХ
Донецкий национальный технический университет
Материалы III Международной научно-практической конференции-выставки “Экологические проблемы индустриальных мегаполисов”.-2006.- Донецк.- C.126-129.
| ДонНТУ |
|
Портал магистров ДонНТУ |
| Автобиография |
| Автореферат |
| Ссылки |
| Отчёт о поиске |
| Мои кактусы |
|
УДК 547.541.513:541.127/128 Исследован нейтральный гидролиз N-аренсульфонил-N-метил-амино-бензолсульфохлоридов в среде 70% (объем.) водного диоксана и температурах 303-323К. Показана возможность применения субстратов как агентов обесфеноливания в связи с их низкой реакционностью при гидролизе в водно-органических средах, что обеспечивает проведение основного процесса – дефеноляции сточных вод. При обесфеноливании сточных вод коксохимических производств с применением химических методов в качестве основных реагентов используются сульфохлориды [1]. В этих условиях реализуются два процесса: основной – фенолиз (1) и побочный – гидролиз (2) субстратов в водно-органическом растворителе:
ArSO2Cl + РhOH → ArSO2OPh +HCl (1) Безусловно, от степени вероятности протекания процесса (2) зависит глубина и эффективность обесфеноливания, сама возможность применения этого метода. Усложняющим фактором является повышение растворимости субстрата при увеличении доли органической составляющей стоков, что обеспечивает возрастание скорости обеих реакций не в одинаковой степени. С целью определения скорости и механизма гидролиза (2) реагентов обесфеноливания исследована реакционность N-аренсульфонил-N-метиламинобензолсульфохлоридов общей формулы 5-[N(ХArSO2)-NMe]–YArSO2Cl, где Х= 4-Ме, Н, 4-Сl, 4-F, 3-NO2 ,4-NO2; Y = 2,4-Ме2, 2,6-Ме2, 2,4,6-Ме3, в среде 70% водного диоксана (в.д.) и интервале температур 303-323К (табл. 1-3 ). Выбор условий эксперимента определялся возможностями проведения аналогии с составом и температурными характеристиками сточных вод коксохимических производств. Во всех сериях варьирование электронных свойств заместителя Х незначительно сказывается на скорости реакции, наблюдается лишь тенденция к ее возрастанию при увеличении электроноакцепторного характера замещающей группы (табл.1-3). Значительно больший выигрыш в скорости реакции гидролиза вызывает изменение положения и, особенно, количества алкильных групп Y в сульфохлоридной части субстрата. Так, если при переходе от Y=2,4-Me2 (серия I) к Y=2,6-Me2 (серия II) отношение kII/kI составляет 1,1 ÷ 1,7, то для субстратов III значение kIII/kII равно 2,7 ÷ 3,5 и достигает 4,0 ÷ 4,5 для kIII/kI. Таблица 1. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,4-Me2С6 Н2SO2Cl в 70% в.д. (серия I)
а. Примечание. Погрешность в определении kэфф не превышает 3 % Таблица 2. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,6-Me2С6 Н2SO2Cl в 70% в.д. (серия II)
Таблица 3. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,4,6-Me3С6 Н2SO2Cl в 70% в.д. (серия III)
Попытка оценить взаимосвязь структура X – реакционная способность субстрата по известному уравнению Гаммета: lgk = lgk0 + ρ Σ σ, где k и k0 – константы скорости для замещенных (Х) и незамещенного (Н) субстратов; ρ - коэффициент чувствительности процесса к электронным эффектам заместителей Х, характеризуемых постоянными σ, приводит либо к незначимым результатам (серия I, [2]), либо к фактическому отсутствию линейной зависимости (серии II, III). Низкое значение величины ρ=0,1 ÷ 0,2 может быть отнесено к удаленности Х, находящегося в аренсульфонильном фрагменте молекулы, от центра нуклеофильной атаки – атома сульфонильной серы. Напротив, селективность субстрата по заместителю Y характеризуется очень высокими значениями (табл. 4). Таблица 4. - Параметры коррелляции по уравнению Гаммета для 5-[N(ХArSO2)-NMe]–YArSO2Cl в 70% в.д. при варьировании Y
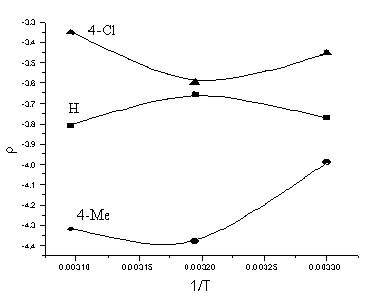
а. Примечание. n – количество экспериментальных точек Из величины ρ >0 следует, что реакция ингибируется донорными заместителями, и означает, что реакционный центр действует как акцептор. Это согласуется с изложенным ранее для гидролиза аренсульфогалогенидов [3] и их производных [4] в соответствии с бимолекулярным механизмом замещения SN2. Большое положительное значение ρ свидетельствует об увеличении заряда на атоме серы в ПС, т.е. последнее более продуктоподобно для гидролиза сульфохлоридов анилидов сульфокислот, чем для бензолсульфохлоридов и имеет несимметричное строение с преобладающей ролью образования связи S…Nu. Изменение ρ от температуры неоднозначно. Во всех случаях в зависимости ρ от 1/Т (рисунок) наблюдается перегиб. Подобный характер кривой говорит о том, что энтальпия активации не является доминирующим вкладом в свободную энергию активации. Полученная интерпретация основывается на электронных представлениях, характеризуемых Δ H≠, т.е. только одной составляющей Δ G≠, связанной с изменением прочности связей в ходе реакции. Структура заместителя Х мало сказывается на величине Δ H≠, Y – повышает активационный барьер на фоне возрастания реакционности (табл. 1-3). Это достигается за счет увеличения вклада энтропии активации Δ S≠ , который для этой реакции является весьма существенным и свидетельствует в пользу упорядоченного переходного состояния с большими пространственными требованиями. Изменение -Δ S≠ для серий I – III (табл. 1-3) компенсирует проявление энтальпийного фактора и является возможной причиной повышения скорости реакции.
В результате вклады энтальпии и энтропии активации ПС в свободную энергию взаимно уравновешивают друг друга, и значение Δ G≠ практически не изменяется при переходе от серии I к III. Таким образом, для гидролиза сульфохлоридов анилидов сульфокислот с экранированными сульфониламидными заместителями в интервале температур 20 ÷ 50 °C характерно наличие энтропийного контроля со сложной конфигурацией активированного комплекса, очевидно, более сильно сольватированного по сравнению с исходными веществами. Скорость процесса незначительна в сравнении с конкурирующей реакцией сульфонилирования фенола [5] и не может перекрыть основной поток – эфирообразование. Это позволяет рекомендовать соединения данного ряда для использования в качестве агентов обесфеноливания сточных вод. Список литературы
1. Скрыпник Ю.Г., Безродный В.П., Лящук С.Н. и др
.//Материалы международного конгресса «Вода: экология и технология». Том 3. – М., 1994. – С. 904-912 © ДонНТУ 2009 Языков Н.А. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||