СУЛЬФОХЛОРИДЫ АНИЛИДОВ СУЛЬФОКИСЛОТ С ЭКРАНИРОВАННЫМИ МЕТИЛАМИДНЫМИ ЗАМЕСТИТЕЛЯМИ: РЕАКЦИОННОСТЬ И МЕХАНИЗМ ГИДРОЛИЗА
Донецкий национальный технический университет
Наукові праці ДонНТУ. Серія: Хімія і хімічна технологія.-Вип.119(9).-2007.-С.69-72.
| ДонНТУ |
|
Портал магистров ДонНТУ |
| Автобиография |
| Автореферат |
| Ссылки |
| Отчёт о поиске |
| Мои кактусы |
|
УДК 547.541.51: 543.878: 541.124 – 145: 542.938 Исследован нейтральный гидролиз сульфохлоридов анилидов сульфокислот общей формулы общей формулы 5-[N(ХArSO2)-NMe]–YArSO2Cl, где Х= 4-Ме, Н, 4-Сl, 4-F, 3-NO2 ,4-NO2; Y = 2,4-Ме2, 2,6-Ме2, 2,4,6-Ме3, в среде 70% водного диоксана (в.д.) и интервале температур 303-323К. Обнаружено существенное ускорение реакции в присутствии 2,6- и 2,4,6-метил производных. Реакция характеризуется энтропийным контролем, рабочая область температур находится выше изокинетической точки. С целью выявления влияния структурных факторов в аренсульфонильном и амидном фрагментах молекулы на замещение у атома серы сульфогруппы исследован нейтральный гидролиз сульфохлоридов анилидов сульфокислот общей формулы 5-[N(ХArSO2)-NMe]–YArSO2Cl, где Х= 4-Ме, Н, 4-Сl, 4-F, 3-NO2 ,4-NO2; Y = 2,4-Ме2, 2,6-Ме2, 2,4,6-Ме3, в среде 70% водного диоксана (в.д.) и интервале температур 303-323К (табл. 1-3 ). Таблица 1. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,4-Me2С6 Н2SO2Cl в 70% в.д. (серия I)
а. Примечание. Погрешность в определении kэфф не превышает 3 % Таблица 2. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,6-Me2С6 Н2SO2Cl в 70% в.д. (серия II)
Таблица 3. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,4,6-Me3С6 Н2SO2Cl в 70% в.д. (серия III)
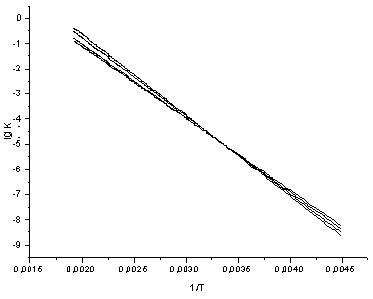
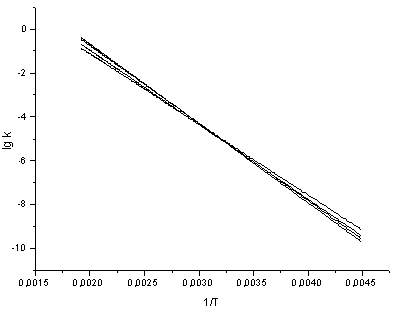
Во всех сериях скорость реакции возрастает при увеличении температуры и нарастании электроноакцепторных свойств заместителя Х, т.е. процессу благоприятствует низкая электронная плотность у сульфонильного центра. Замещающие группы Х расположены достаточно далеко от атома серы сульфогруппы, и их электронные и стерические свойства отражаются лишь в незначительной степени на скорости процесса (табл. 1-3). Попытка оценить взаимосвязь структура субстрата-реакционность по уравнению Гаммета показала низкую чувствительность реакции к электронным эффектам заместителей для серии I (ρ =0,1 ÷ 0,2 [1]) и фактическое отсутствие линейной зависимости для серий II и III. При этом оценочное значение величины ρ для этих серий находится около нуля (≈ 0,03 ÷ 0,07), что может говорить о нахождении вблизи изопараметрической области (рис. 1, а,б).
Изменение положения и количества метильных групп Y в амидной части субстрата вызывает значительные колебания его реакционности. Так, если при переходе от Y=2,4-Me2 (серия I) к Y=2,6-Me2 (серия II) отношение kII/kI составляет 1,1 ÷ 1,7, то для субстратов III значение kIII/kII достигает 2,7 ÷ 3,5. Селективность субстрата по заместителям Y характеризуется очень высокими значениями (табл. 4). Таблица 4. - Параметры коррелляции по уравнению Гаммета для 5-[N(ХArSO2)-NMe]–YArSO2Cl в 70% в.д. при варьировании Y
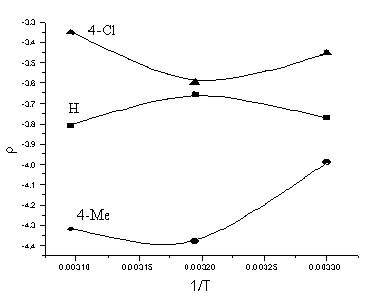
а. Примечание. n – количество экспериментальных точек Из величины ρ >0 следует, что реакция ингибируется акцепторными заместителями, и означает, что действие групп Y противоположно влиянию заместителей Х в аренсульфонильном фрагменте молекулы. Компенсационный эффект не достигается вследствие удаленности Х от реакционного центра. Накопление метильных групп вблизи сульфонильной серы, и связанное с этим ускорение реакции отмечалось ранее [2,3] для аренсульфогалогенидов и объяснено формированием «рыхлого» переходного состояния (ПС) SN2 – типа. Изменение ρ от температуры неоднозначно. Во всех случаях на зависимости ρ от T-1 (рис. 2) наблюдается перегиб. Подобный характер кривой говорит, что энтальпия активации не является доминирующим вкладом в свободную энергию активации. Действительно, структура заместителя Х мало сказывается на скорости реакции, Y – повышает активационный барьер на фоне возрастания реакционности при накоплении алкильных групп в сульфохлоридной части. Это достигается за счет увеличения вклада энтропии активации Δ S≠, который для этой реакции является весьма существенным и свидетельствует о более сложной конфигурации активированного комплекса для субстратов I, возможно – более сольватированного. Изменение - Δ S≠, для серии I-III (табл. 1-3) компенсирует проявление энтальпийного фактора, снижает величину Δ G≠ и является возможной причиной ускорения реакции.
Данные расчета изокинетической температуры (Tизо) для серии I-III (табл. 5) показывают, что рабочая область температур находится выше (I,III ) или в изокинетической зоне (II), что может объяснить форму кривой на рис. 2. Таблица 5. – Теоретическое значение Тизо для серий I-III, полученное по методу Экснера [5] для гидролиза 5-[N(XArSO2)-NMe]-YArSO2Cl в 70% в.д.
Список литературы
1. Мысык Д.Д., Рублева Л.И., Крутько И.Н., Левандовский В.Ю. Влияние структуры
N-аренсульфонильного фрагмента на реакционность сульфохлоридов анилидов сульфокислот в условиях
нейтрального гидролиза/ © ДонНТУ 2009 Языков Н.А. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||