Важливість вивчення рівноваги в металургійних процесах витікає з того, що рівноважне становище обмежує межу реакції
всякого процесу і ми в змозі управляти завершенням бажаної реакції, контролюючи чинники, які впливають на рівновагу.
Прикладом рівноваги, добре відомої в сталеплавильному виробництві, може служити реакція окислення марганцю:
[Mn]+[O]→(MnO) (1)
Якщо хімічна реакція протікає в одну стадію, то безпосередньо з рівняння хімічної реакції може бути отримане
диференціальне рівняння, що описує зміну концентрації реагентів.
У загальному вигляді рівняння хімічної реакції можна навести у такому вигляді:
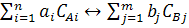 (2)
(2)
де ai і bj - порядок прямої і зворотньої реакції; CAi і CBj - концентрація
початкових речовин і продуктів реакції.
Швидкість хімічної реакції, що протікає в одну стадію, дорівнює:
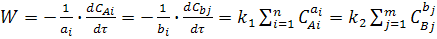 (3)
(3)
де k1 і k2 - константи швидкості прямої і зворотної реакції (2)
Концентрації початкових речовин (CAi) і продуктів реакції (CBj) зв'язані між собою співвідношенням:
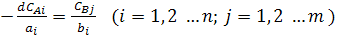 (4)
(4)
У інтегральному вигляді рівняння (3) можна навести як
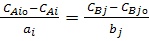 (5)
(5)
де CAiо і CBjо - початкові концентрації початкових речовин і продуктів реакції.
Зазвичай початок протікання реакції проходить за відсутності продуктів реакції, тобто CBjо = 0.
Нехай 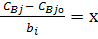 де х – параметр, який характеризує повноту протікання реакції. Він дорівнює нулю в початковий момент часу і збільшується з мірою накопичення продуктів реакції.
де х – параметр, який характеризує повноту протікання реакції. Він дорівнює нулю в початковий момент часу і збільшується з мірою накопичення продуктів реакції.
Із співвідношення (5) через параметр х можна визначити концентрації всіх початкових речовин і продуктів реакції:
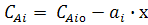
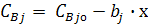 (6)
(6)
Похідна х за часом характеризуватиме швидкість хімічної реакції. Отже рівняння (3) можна записати у вигляді:
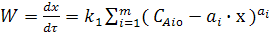 (7)
(7)
У рівнянні стехіометричні коефіцієнти aMn = aO = 1.Якщо позначити через СMn = CO
відповідно концентрацію марганцю і кисню в металі, то рівняння (7) для швидкості окислення марганцю можна записати у такому вигляді:
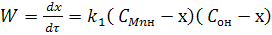 (8)
(8)
де k1 - константа швидкості прямої реакції; СMnн і COн - початкові або вихідні концентрації Mn і O в металі.
Після розділення змінних х і τ і інтеграції за початкових умов при τ = 0 х = 0, отримаємо:
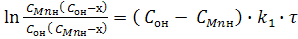 (9)
(9)
Вирішуючи рівняння (9) відносно х, отримаємо:
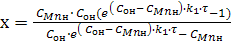 (10)
(10)
Якщо в рівнянні (10) провести заміну х згідно рівняння (6) на СMnн - СMn або на COн - CO,
то після нескладних перетворень отримаємо:
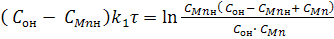 (11)
(11)
Введемо нові змінні:
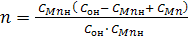
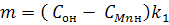
Тоді рівняння (10) запишемо у такому вигляді
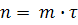 (12)
(12)
З якого виходить, що параметр n лінійно залежить від часу τ. У координатах n, τ тангенс угла нахилу прямої m•τ
до осі абсцис (τ) буде дорівнювати m у рівнянні (12).
З виразу 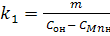 визначаємо константу швидкості прямої реакції окислення марганцю (1).
визначаємо константу швидкості прямої реакції окислення марганцю (1).
Залежність константи швидкості хімічної реакції від температури визначається рівнянням Ареніуса:
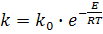 (13)
(13)
де k і ko - константи швидкості хімічної реакції відповідно при температурах Т и Т→∞ ; Е – енергія активації хімічної реакції, що здається.
Т.ч. ko - параметр, незалежний від температури і є постійною величиною для конкретної хімічної реакції.
Для визначення енергії активації (Е) необхідно визначити значення константи швидкості хімічної реакції при двох температурах
Т1 і Т2:
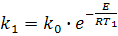 або
або 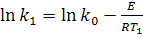 (14)
(14)
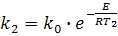 або
або 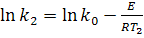 (15)
(15)
З виразу lnk1 - lnk2 отримаємо:
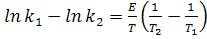 (16)
(16)
З отриманого виразу визначаємо параметр Е:
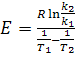 (17)
(17)
Визначивши значення уявної енергії активації (Е) можна визначити параметр ko з виразу:
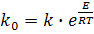 (18)
(18)
Таким чином можна визначити параметр ko при різних температурах. По цьому параметру можна судити про
погрішність прийнятої методики. Параметр ko повинен бути однаковою величиною при будь-якій температурі. По
середньоквадратичному відхиленню цієї величини можна визначити погрішність експерименту.
Література
- Астарита Дж. Массопередача с химической реакцией. Изд-во «Химия», 1971, стр. 224.
- Е.Т. Туркдоган Физическая химия высокотемпературных процессов Пер. с англ. М,: Металлургия, 1985, с.299-305.
- Дымнич А.Х., Троянский А.А. Вопросы тепломассообмена в сталеплавильных процессах - Киев; Донецк: Головное изд-во, 2009, с.25-27.
- Фізико-хімічні процеси позаагрегатного рафінування металу: Навчальний посібник / Зборщик О.М. – Донецьк: ДонНТУ, 2001, с.115-118.
- Конвертерный процесс с долнным дутьем. Арсентьев П.П., Квитко М.П., М.: Металлургия, 1983, 128с, с.35-39.
- Аналитическая химия. Проблемы и подходы: В 2 т: Пер. с англ. / Под ред. Р. Кельнера, Ж.-М. Мерме, М. Отто, Г.М. Видмер. - «Мир»: ООО «Издательство АСТ», 2004, с.412-418.
|

