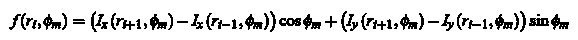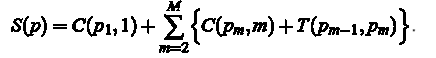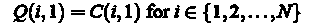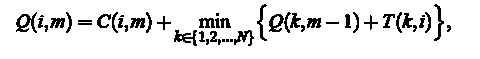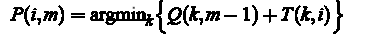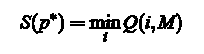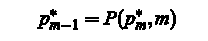РЕФЕРАТ
Вступ
Цілі та завдання
Об’єкт і предмет дослідження
Передбачувана наукова новизна
Огляд існуючих систем
Методи дослідження
Висновки
Джерела
ХХI століття принесло незаперечний прогрес в усі сфери людського життя, починаючи космічними відкриттями у пошуках нових безпечних джерел енергії і закінчуючи новими видами руйнівних невивчених захворювань. Тому головною проблемою медиків сьогодні є якомога більш рання діагностика патологій з метою надання лікарям часу для проведення досліджень та правильного лікування. А найбільш рання діагностика - діагностика на нижчих рівнях організації, а саме на клітинному.
Але, як відомо, найважливіші завдання складно здійсненні. Щодня в світі з'являються нові методики з обробки зображень гістологічних зрізів та вивчення морфологічних ознак різноманітних клітин, удосконалюються мікроскопи та програмне забезпечення для роботи з зображеннями на персональних комп'ютерах. Робота вчених біохіміків також не примушує себе довго чекати, і безперервно триває процес удосконалення імуногістохімічного аналізу - методу виявлення та точної локалізації того чи іншого клітинного або тканинного компоненту (антигену) in situ за допомогою імунологічних та гістохімічних реакцій.
Основною проблемою при створенні автоматизованої системи діагностики захворювань людини на основі імуногістохімічного аналізу є точність виявлення клітини і визначення її параметрів.
Тому розробка такої КС, яка зможе допомагати лікарям у постановці максимально точного діагнозу, скорочуючи при цьому витрати часу, є важливою та актуальною задачею.
Метою даної роботи є розробка автоматизованої підсистеми діагностування різних захворювань людини на зображеннях гістологічних зрізів, отриманих за допомогою цифрового мікроскопа і подальшого проведення імуногістохімічного зафарблення.
Для досягнення поставленої мети необхідно вирішити наступні завдання:
Пошук та оцінка точності існуючих методів обробки зображень гістологічних зрізів;
Розробка алгоритму визначення патологічних ознак клітин на зображеннях гістологічних зрізів;
Вибір найбільш відповідного методу для реалізації поставленої задачі;
Реалізація обраних методів на ЕОМ.
Дослідження спрямовані на обробку і розпізнавання об'єктів на зображенні. Об'єктом дослідження є кольорові зображення гістологічних зрізів, отриманих за допомогою цифрового мікроскопа і проведення імуногістохімічного фарбування. Предметом дослідження є алгоритми сегментації, морфологічних операцій і виділення об'єктів на гістологічних зрізах.
Основним нововведенням роботи є використання різних алгоритмів і методів обробки зображень гістологічних зрізів для найбільш точного аналізу, використовуються методи зарубіжних вчених, що раніше не застосовувались в нашій країні. Порівняння отриманих результатів дозволить зробити висновок про стан досліджуваної ділянки тканини і оцінити точність і швидкість кожного з підходів.
Розроблене ПЗ передбачається використовувати в клінічній лабораторії «Нова діагностика» при ІНВХ ім.Гусака для діагностування захворювань людини, в основному новоутворень різних органів.
ФемтоСкан Онлайн - пакет програмного забезпечення для управління скануючим зондовим мікроскопом та обробки зображень зондовойї мікроскопії. Програма запускається під операційними системами сімейства Windows. Для з'єднання з сервером використовується протокол TCP / IP, що дозволяє підключатися до сервера не тільки по локальній мережі, але й через Інтернет. Всі параметри сканування, задані користувачем, передаються в сервер і далі - в мікроскоп та іншим користувачам, підключеним в режимі client. Після запуску процесу сканування відкриваються вікна, в яких в реальному режимі часу показуються результати - одержувані зображення, їхні розміри, режим сканування, параметри зворотного зв'язку, поточне положення зонду, швидкість сканування. Одночасно користувач може обробляти отримані дані, використовуючи широкий набір різних функцій, включених до складу програми. Програма-клієнт має безліч різних функцій, призначених для обробки та аналізу зображень зондової мікроскопії: Інверсія, фільтр Вінера, транспонування, аналіз шорсткості, Порогова фільтрація, виділення зерен, виділення кордонів, морфологічні фільтри та ін.
Результат підрахунку клітин показано на рис. 1.
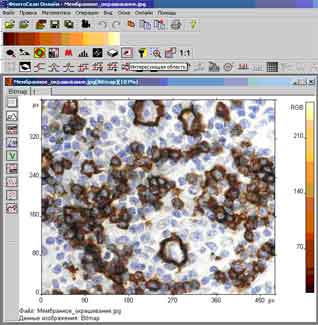 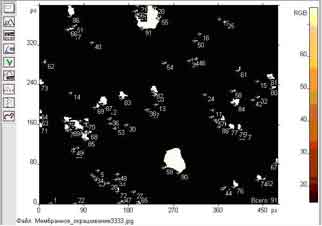
Рис.1. Оконтурювання та підрахунок клітин на гістологічному зрізі.
AnalySIS - програмний продукт компанії analySIS Five забезпечує проведення аналізу зображення. Інтерфейс програми показано на рис.2.
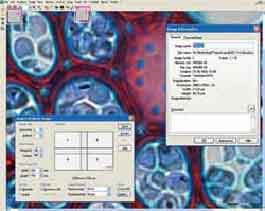 
Рис. 2. Вид вікна програми AnalySIS
У програмі analySIS Five реалізована концепція Документа - єдиного файлу (вікна) у вікні програми, який містить початкові зображення, результати аналізу (таблиця вимірювань, гістограми).
Програма дозволяє автоматизувати захоплення зображень, всі установки камери, зроблені користувачем при налаштуванні, автоматично зберігаються і використовуються на наступних зображеннях, які знімаються. Реалізована підтримка TWAIN спільних приладів введення. Програмне забезпечення дозволяє наносити графічні елементи на зображення і проводити ручні вимірювання в режимі живого відео. Всі можливості редагування зображень (нанесення графіки і тексту, нанесення калібрувальних маркерів) і всі стандартні функції перетворення зображень входять у програму. Виробник заявляє також про наявність у програмі унікальних можливостей фільтрації, таких як, наприклад, фільтр диференціального посилення контрасту (DCE - Differential Contrast Enhancement) для оптимізації контрастності зображення (напівтонового або кольорового). Ще одна з корисних можливостей програми: зшивання зображень, що дозволяє, знявши суміжні поля зору на великому збільшенні, об'єднати їх в одне зображення. А також функція, що дозволяє одержувати різке зображення з серії полів зору, знятих з різною глибиною фокуса (функція Extended Focal Imaging). Вся історія обробки зображення зберігається і може бути переглянута.
1. Імуногістохімічні методики дослідження. Бурхливий розвиток імунології призвів до розробки нового методу гістологічного дослідження - імуногістохімічного.
Імуногістохімія - це метод виявлення та точної локалізації того чи іншого клітинного або тканинного компоненту (антигену) in situ за допомогою імунологічних та гістохімічних реакцій. Авторами цього методу вважається група дослідників під керівництвом Альберта Кунса, які вперше отримали мічені флюоресцеїном антитіла і застосувала їх у діагностичних цілях, також були розроблені методики прямої і непрямої імунофлюоресценції. Однак метод не отримав високого розповсюдження із-за великої складності отримання антитіл, складності їх візуалізації і низької відтворюваністі результатів. Наступні роки були відзначені не тільки вдосконаленням самого методу, але і розширенням сфер його застосування. Були відкриті авідін і біотин, що утворюють стійкий комплекс, розроблені методи кон'югації антитіл з біотином, авідіна - з ферментами, нові методи отримання очищених антитіл. Все це призвело до повсюдного впровадження даної методики спочатку в дослідницьких центрах, а потім і в практичній медицині. Імуногістохімічні методики дослідження на сьогоднішній день є обов'язковою частиною будь-яких досліджень, оскільки тільки вони забезпечують специфічну візуалізацію тих чи інших речовин.
За допомогою даної методики можна визначати локалізацію в тканинах різних клітинних продуктів (гормонів, ферментів, імуноглобулінів), компонентів клітин (рецепторів, скорочувальної і проміжних філаментів) і навіть окремих генів.
Таблиця 1. Системи візуалізації антигенів найбільш відомих фірм
| Метод | Фірма/система | Примітки |
| Первинно-мічені антитіла (ферментами або флюорохромами) |
Багато |
Кількість таких антитіл велика. Використовуються рідко в іммуногістохімії, але часто в проточній цитометрії. |
|
PAP- и APAAP-метод
|
DAKO PAP kit
DAKO APAAP kit
|
Метод оснований на пероксидазно-антипероксидазному компліксі або фосфатазно-антифосфатазному комплексі.
|
|
ABC-метод
|
Novocastra Novostain Super ABC kit
VextorLab VectraStain ABC kit
|
Метод оснований на комплексі авідин-біотин-фермент
|
|
SaBC-метод
|
DACO LSAB, LSAB+, LSAB2
Biogenex Super Sentitive Link-Label IHC
Detection Systems (Biotin Based)
Zymed Histostain-SAP Kit
Zymed Histostain-Plus Detection Kit
Chemicon IHC Select Detection Kits
|
Метод оснований на комплексі стрептавідин-біотин-фермент
|
|
Полімерна технологія з первинними антитілами
|
DAKO EPOS
|
Метод оснований на декстрановій молекулі, що пов'язує до 20 первинних антитіл й до 100 молекул фермента
|
|
Полімерна технологія зі вторинними антитілами
|
DAKO EnVision, EnVision+
Biogenex Super Sensitive Polymer-HRP IHC
Non-Biotin Detection System
ImmunoVision PowerVision
Zymed SuperPicTure Polymer Detection Kit
|
Метод оснований на декстрановій молекулі, що пов'язує до 20 первинних антитіл й до 100 молекул фермента
|
|
Метод амплифікації з тирамід-біотином
|
DAKO CSA
ImmunoVision ImmunoMax
|
Метод оснований на комплексі стрептавідин-біотин-фермент й посиленні комплексом тирамід-біотин
|
|
Метод амплифікації з тирамід-флюоресцином
|
DAKO CSA II
|
Метод оснований на комплексі стрептавідин-біотин-фермент й посиленні комплексом тирамід-флюоресцеїн
|
Обробка зображень гістологічних зрізів використовується для імуногістохімічного аналізу, а саме визначення тканинних компонентів за допомогою неконтрольованої класифікації та кластеризації. Використовуючи просторовий розподіл пікселів, пов'язаних з позитивно і негативно зарядженими клітинами, визначаються забарвлені моделі. У той же час, аналізується і просторовий розподіл ДНК-вмісних пікселів.

Рис.3. Етапи обробки зображень гістологічних зрізів (анімація об'ємом 143 КБ, що складається з 105 кадрів, цикл повторень нескінченний, реалізована в ImageReady).
2. Методи обробки зображень.
2.1. Адаптивний метод встановлення порогів та сегментація.
Сегментоване зображення обчислюється через поріг на градієнтному зображенні, який вираховується з початкового зображення.
Градієнт зображення обчислюється з використанням методу Прюіта.
Початкове зображення фільтрується за допомогою двох масок, по одній на кожний напрямок, де кожна маска посилює розбіжності у відповідному напрямку.
Фільтр Прюіта задається матрицею

Фільтри, що наближають оператор похідної по y-координаті
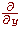 , отримуємо шляхом транспонування матриць. , отримуємо шляхом транспонування матриць.
Це призводить до двох нових зображень, Іх і Iy, кожне з яких є кордоном піксельних варіацій в X і Y напрямках, відповідно. Після цього, ми покладемо, що
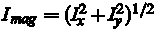
для розташування кожного пікселя. Пікселі з градієнтів значення вище певного порогу 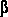 тепер будуть позначені, як області переднього плану. тепер будуть позначені, як області переднього плану.
Вирішальна роль у шаговій сегментації полягає в тому, щоб автоматично знайти поріг  . .
Градієнтні значення встановлюються Релеєвою функцією розподілу,
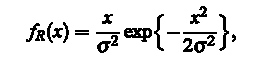
де  є параметром, що варіює, поки найбільш підходящий не буде знайдений, а X - значення пікселя. Сенс цієї процедури полягає в тому, що градієнтні значення пікселів зображення будуть розподілені за законом Релея згідно з припущеннями про те, що такі значення Іх і Iy є ідентичними, незалежними, і, як правило нормально (за законом Гауса) розподілені. Щоб отримати остаточні сегментовані зображення, ми застосовуємо морфологічні відкриття та закриття з круговою структурою елементів радіусом 4 пикселі. Результат проілюстрований на рис. 4. є параметром, що варіює, поки найбільш підходящий не буде знайдений, а X - значення пікселя. Сенс цієї процедури полягає в тому, що градієнтні значення пікселів зображення будуть розподілені за законом Релея згідно з припущеннями про те, що такі значення Іх і Iy є ідентичними, незалежними, і, як правило нормально (за законом Гауса) розподілені. Щоб отримати остаточні сегментовані зображення, ми застосовуємо морфологічні відкриття та закриття з круговою структурою елементів радіусом 4 пикселі. Результат проілюстрований на рис. 4.
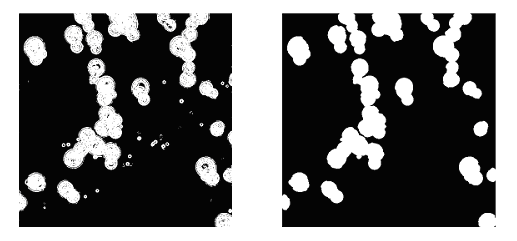
Рис.4. Результат сегментації зображення
2.2. Медіанний фільтр
Медіанний фільтр реалізує нелінійну процедуру придушення адитивного та імпульсного шумів на зображенні. Медіанний фільтр являє собою ковзаюче по полю зображення вікно W, що охоплює непарне число відліків. Центральний відлік замінюється медіаною всіх елементів зображення, що потрапили у вікно. Медіаною дискретної послідовності x1, x2, ..., xL для непарного L називають такий її елемент, для якого існують (L - 1) / 2 елементів, менших або рівних йому за величиною, і (L - 1) / 2 елементів, більших або рівних йому за величиною. Іншими словами, медіаною є середній по порядку член ряду, що отримується при впорядкування вихідної послідовності. Наприклад, med (20, 10, 3, 7, 7) = 7. Двовимірний медіанний фільтр з вікном W визначимо наступним чином:
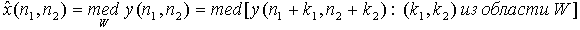
Серед медіанних фільтрів розмірністю 3х3 найбільш поширені наступні:
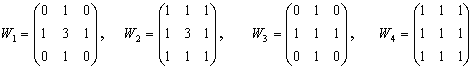
2.3. Пошук передбачуваного центру клітини
Оскільки кожна зв'язна компонента в сегментованому зображенні являє собою передбачувану сукупність клітин, ці сукупності повинні бути роз'єднані на окремі клітини. Це досягається за допомогою функції пошуку по сегменту кола вздовж зовнішніх контурів об'єктів у сегментованому зображенні, використовуючи варіації кругового перетворення Хоу. Цей принцип показано на рис.5.
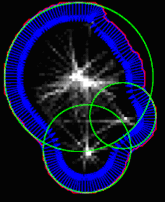
Рис.5. Результат застосування перетворення Хоу.
При обході зовнішнього кордону зв'язних областей у сегментованому зображенні апроксимуюча нормаль до кордону обчислюється в кожній точці. Уздовж кожної нормалі, ми поетапно йдемо всередину і реєструємо відстані до точки відповідного кордону. Таким чином, накопичену матрицю сформовано так, де кожен елемент включає число "потраплень" на нормаль до кордону і відстежує відповідні відстані. Коли кожна точка вздовж кордону сукупності клітин пройдена, ми шукаємо розташування максимуму в цій накопиченій матриці. Результуючі кола на рис. 5 відображаються зеленим кольором. Центри кіл будуть виступати в якості кандидата на центри клітин для отримання остаточного контура.
2.3.1. Кругові перетворення Хоу
Клітини мають округлу форму. Коло може бути представлене як
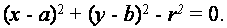
Ця модель складається з трьох параметрів: двох параметрів у центрі кола, а один параметр для радіусу кола. Якщо є кут ухилу по краях, то це є стримуючим чинником, що знижує кількість ступенів свободи і, отже, потрібний розмір простору параметрів. Напрямок вектора від центру кола до краю кожної точки визначає кут ухилу, в результаті чого отримуємо значення радіусу, як тільки невідомого параметра.
Таким чином, параметричні рівняння кола в полярних координатах:
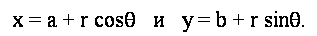
Вирішуючи для параметрів кола, ми отримуємо рівняння:
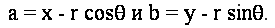
Тепер, з огляду на кут ухилу 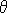 на краю точки (X, Y), ми можемо обчислити cos на краю точки (X, Y), ми можемо обчислити cos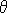 та sin та sin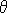 . Але ці значення можуть бути поширені в якості побічного продукту краю виявлення. Ми можемо усунути виліт з пари рівнянь наступним чином: . Але ці значення можуть бути поширені в якості побічного продукту краю виявлення. Ми можемо усунути виліт з пари рівнянь наступним чином:
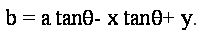
2.4. Отримання контуру клітини з використанням динамічного програмування.
Кожна замкнута послідовність зв'язних пікселів навколо передбачуваного центру клітини і, отже, простір можливих контурів величезна. Для того, щоб врегулювати цю проблему, в даному методі представлена система відліку у вигляді полярних ділянок по відношенню до кожного кандидата на центр клітини. На малюнку 5 показані похідні за напрямком Іх і Iy у вигляді М = 32 променів, що виходять з передбачуваного центру клітини, де кожен промінь відібраний на N = 30 рівномірно розподілених радіальних точках. Справжня межа клітин гранично прилягає до темної «бахроми» навколо клітини. Формально F (R,
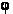 ) позначає точку контура критерію функції, тобто на відстані R і під кутом ) позначає точку контура критерію функції, тобто на відстані R і під кутом 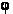 буде точка контура. Кут
буде точка контура. Кут 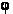 відкладається проти годинникової стрілки. відкладається проти годинникової стрілки.
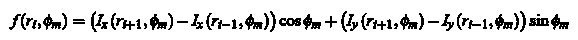
Косинус і синус операції відповідають проекції вздовж даних променів.
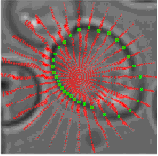
Рис.6. Контур клітини, отриманий за допомогою динамічного програмування.
Вартість S (P) для контуру або шлях P = (P1, P2,...,), знайдений зліва направо, рівний:
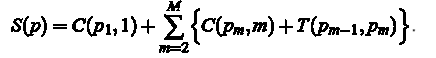
Оптимальний шлях P*, це шлях, що мінімізує суму S(P). В ході алгоритму необхідно провести наступні обчислення:
Ініціалізація (M = 1): 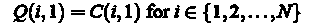 рекурсіі (М = 2, M): Для кожного i = 1,. . . , N розрахувати оптимальну кумулятивну вартість
рекурсіі (М = 2, M): Для кожного i = 1,. . . , N розрахувати оптимальну кумулятивну вартість 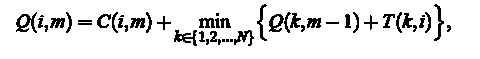
і зберегти покажчик до відповідної змінної мінімізації:
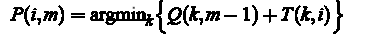 Припинення: Мінімальна вартість
Припинення: Мінімальна вартість
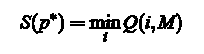
і останній стан відповідного шляху
 відстеження: Повний оптимальний шлях знайти на задньому фоні за допомогою покажчика матриці P: Для M = M,. . . , 2
відстеження: Повний оптимальний шлях знайти на задньому фоні за допомогою покажчика матриці P: Для M = M,. . . , 2
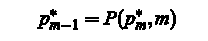
З вищеописаного матеріалу можна зробити висновок про перспективність використання сучасних КС в галузі медицини. Розробка та застосування в діагностичних системах нових алгоритмів роботи дозволить підвищити швидкість і точність обробки інформації в таких системах на кілька порядків.
1. Основи імуногістохімії
http://www.newdiagnostics.dn.ua/index.php?option=com_content&task=view&id=18&Itemid=17&&lang=ru
2. Automated recognition of cell phenotypes in histology images based on membrane- and nuclei- targeting biomarkers
http://www.biomedcentral.com/1471-2342/7/7
3. Image analysis algorithms for cell contour recognition in budding yeast
http://www.opticsinfobase.org/DirectPDFAccess/351802CD-BDB9-137E-C9C3F4794EF34E6D_170494.pdf?da=1&id=170494&seq=0&CFID=37376861&CFTOKEN=71773669
| |







 , отримуємо шляхом транспонування матриць.
, отримуємо шляхом транспонування матриць.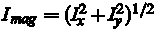
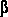 тепер будуть позначені, як області переднього плану.
тепер будуть позначені, як області переднього плану.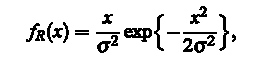
 є параметром, що варіює, поки найбільш підходящий не буде знайдений, а X - значення пікселя. Сенс цієї процедури полягає в тому, що градієнтні значення пікселів зображення будуть розподілені за законом Релея згідно з припущеннями про те, що такі значення Іх і Iy є ідентичними, незалежними, і, як правило нормально (за законом Гауса) розподілені. Щоб отримати остаточні сегментовані зображення, ми застосовуємо морфологічні відкриття та закриття з круговою структурою елементів радіусом 4 пикселі. Результат проілюстрований на рис. 4.
є параметром, що варіює, поки найбільш підходящий не буде знайдений, а X - значення пікселя. Сенс цієї процедури полягає в тому, що градієнтні значення пікселів зображення будуть розподілені за законом Релея згідно з припущеннями про те, що такі значення Іх і Iy є ідентичними, незалежними, і, як правило нормально (за законом Гауса) розподілені. Щоб отримати остаточні сегментовані зображення, ми застосовуємо морфологічні відкриття та закриття з круговою структурою елементів радіусом 4 пикселі. Результат проілюстрований на рис. 4.

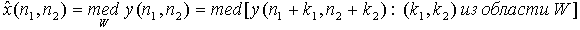
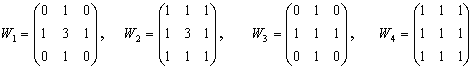

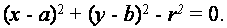
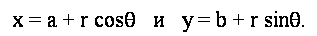
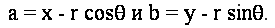
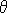 на краю точки (X, Y), ми можемо обчислити cos
на краю точки (X, Y), ми можемо обчислити cos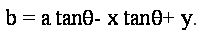
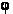 ) позначає точку контура критерію функції, тобто на відстані R і під кутом
) позначає точку контура критерію функції, тобто на відстані R і під кутом