Реферат по теме выпускной работы
Содержание
- Введение
- 1. Источники и свойства алканов
- 2. Химические свойства насыщенных углеводородов
- 2.1 Реакции замещения
- 2.2 Реакции расщепления
- 2.3 Реакции окисления
- 2.4 Новые направления в изучении реакции алканов
- 3. Металлокомплексный катализ
- 4. Характеристика неэмпирических методов квантовой химии
- Выводы
- Список источников
Введение
Ограниченность запасов нефти и постоянное удорожание ее добычи выдвинули проблему поиска альтернативного сырья для химической и нефтехимической промышленности. Таким сырьем в ближайшем будущем может стать природный газ, в первую очередь его основной компонент – метан. Метан также является побочным продуктом в целом ряде процессов переработки органического сырья в том числе каменных углей, которые в перспективе могут стать главным источником получения органических полупродуктов и моторных топлив. Это выдвигает задачу создания эффективных процессов непосредственной переработки метана в ценные продукты – метанол, формальдегид, низшие олефины и т. д.
Наряду с большой практической важностью, проблема переработки метана представляет значительный научный интерес, так как связана с поисками возможности активации весьма устойчивой молекулы, реакционная способность которой существенно ниже, чем целевых продуктов. [1]
Относительно низкая реакционная способность насыщенных углеводородов обусловлена отсутствием в молекулах этих соединений π- или n-электронов и малой полярностью σ-связей С—Η и С—С. Вместе с тем, поскольку парафиновые углеводороды (запасы которых, особенно метана, в природе еще велики) являются одним из видов химического органического сырья, весьма актуальной представляется проблема их переработки в функциональные производные (спирты, кетоны, кислоты), а также получения из алканов олефинов и ароматических углеводородов.
Большое практическое значение имеют также процессы гидрокрекинга и изомеризации парафинов, позволяющие получать ценные виды моторного топлива. Основные промышленные процессы, в которых в качестве сырья используются алканы, протекают при высоких температурах (выше 150-200°С), часто в присутствии гетерогенных катализаторов (например, дегидрогенизация, ароматизация, реакция метана с водой, дающая смесь СО + Н2, крекинг метана до ацетилена и водорода, крекинг высших алканов с образованием олефинов, нитрование, фторирование действием CoF3 и т. д.). Особую область образуют радикально-цепные процессы (фотохимическое хлорирование под действием Сl2, инициируемое светом или радикалами окисление молекулярным кислородом, сульфохлорирование и др.), проводимые при низких температурах. Однако селективность этих реакций невелика, и обычно образуются сложные смеси продуктов. Наконец, давно известна способность некоторых микроорганизмов и клеток высших животных окислять алканы кислородом при обычной температуре. Биологическое окисление обычно селективно. Например, некоторые микроорганизмы окисляют только концевую метильную группу углеводорода, превращая его первично в спирт (ω-гидроксилирование).[2]
Исследования процесса гетерогенно-каталитического окисления метана в полезные продукты можно условно разделить на два направления. Одно из них связано с получением ценных кислородсодержащих соединений — метанола и формальдегида. Это направление развивается уже довольно давно и здесь достигнуты определенные результаты в понимании механизма процесса, влияния природы активных центров катализаторов на их активность и селективность. Однако выходы полезных продуктов на стабильно работающих катализаторах не превышают 3% по метанолу и 5-8% по формальдегиду при окислении метана кислородом или воздухом и без добавок различных соединений (окислы азота, галогенпроизводные) в качестве окислителей и инициаторов. Таким образом, при гетерогенно-каталитическом окислении метана пока не удалось достичь существенного увеличения выходов ценных кислородсодержащих соединений по сравнению с гомогенным окислением.
Второе направление – каталитическая окислительная конденсация метана в высшие углеводороды (в основном в этан, этилен, пропилен и ацетилен) — начало развиваться сравнительно недавно.[1]
1. Источники и свойства алканов
Основной источник алканов в природе - нефть; фракции нефти 200-430 °С содержат 30-50% (по массе) насыщенных углеводородов (из них до 60% углеводородов нормального строения); низшие газообразные насыщенные углеводороды входят в состав природного газа (до 98% метана) и растворены в нефти; твердые встречаются в виде залежей озокерита, а также образуют восковые покрытия листьев, цветов и семян растений, входят в состав пчелиного воска.
Длины связей С-С в алканах ~ 0,154 нм, С-Н ~ 0,109 нм, угол ССС в газообразном состоянии 109,47°, в кристаллическом - на 2-3° больше.
Низшие насыщенные углеводороды до бутана и неопентан - газы без цвета и запаха, углеводороды С5-С17 - бесцветные жидкости с характерным "бензиновым" запахом, высшие насыщенные углеводороды - бесцветные твердые вещества. Температуры плавления и кипения зависят от размера молекулы и возрастают в гомологическом ряду с увеличением молекулярной массы. Среди изомеров углеводороды нормального строения имеют наиболее высокие температуры кипения и плотности.[3]
Простейшим представителем алканов является метан. Метан – бесцветный газ без запаха. Его химическая формула – CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Основной компонент природных (77-99%), попутных нефтяных (31-90%), рудничного и болотного газов (отсюда другие названия метана – болотный или рудничный газ).[4]
2. Химические свойства насыщенных углеводородов
Алканы – химически наименее активные органические соединения. Все связи С–С и С–Н в алканах одинарные, поэтому алканы неспособны к реакциям присоединения. Для алканов характерны реакции замещения атомов водорода на другие атомы и группы атомов.
Основные химические превращения алканов идут только при сообщении им достаточно высокой энергии (при нагревании или облучении УФ-светом). При этом может произойти или разрыв связи С—Н с последующим замещением атома водорода на другой атом или группу атомов.
Поскольку алканы – соединения неполярные, то при разрыве связей образуются главным образом не ионы, а радикалы, т.е. этот процесс идет по гомолитическому механизму.
Таким образом, для алканов различают два основных типа химических реакций: реакции замещения водорода (с разрывом связи С—Н) и реакции расщепления (с разрывом связей С—С и С—Н).
2.1 Реакции замещения
Галогенирование (замещение галогеном) – важнейшая реакция алканов. Она протекает при освещении УФ-светом или в темноте при сильном нагревании, а также в присутствии катализаторов. Сравнительно легко алканы вступают в реакцию замещения с хлором и бромом, очень трудно – с иодом. С фтором реакция протекает со взрывом (поэтому обычно фтор разбавляют азотом или используют растворители). В результате замещения водорода галогеном образуются галогено-производные алканов. Например, хлорирование метана протекает с последовательным замещением в его молекуле всех атомов водорода на хлор.
Нитрование (замещение нитрогруппой NO2). Впервые эту реакцию открыл русский ученый М.И.Коновалов в 1888 г. (с тех пор она названа его именем). Алканы взаимодействуют с разбавленной азотной кислотой при нагревании, образуя нитропроизводные алканов: Сульфирование. Дымящая серная кислота (содержащая растворенный в ней SO3) с высшими алканами дает сульфокислоты.
2.2 Реакции расщепления
Реакции расщепления протекают при нагревании (в присутствии катализаторов или без них).
1 Отщепление водорода (дегидрирование). При нагревании алканов присутствии катализатора (СrО3) происходит отщепление атомов водорода с образованием непредельных углеводородов.
2 Термическое разложение (разрыв связей С—С и С—Н). Известно, что алканы устойчивы только при сравнительно невысоких температурах. При нагревании алканов до 500 ° С и выше, (без катализаторов или в их присутствии) они разлагаются с разрывом связей С—С и С—Н. В результате происходит образование более простых углеводородов – предельных и непредельных. Этот процесс называют крекингом.
3 Изомеризация. При этой реакции неразветвленная углеродная цепь превращается в разветвленную. Это сопровождается разрывом связей С—С: Процесс изомеризации проходит при нагревании в присутствии катализатора (А1С13). В эту реакцию вступают только те алканы, которые в углеродной цепи содержат не менее четырех углеродных атомов.
2.3 Реакции окисления
При обычных условиях алканы устойчивы к действию даже сильных окислителей (КМnO4, К2Сr4 и др.). Поэтому при добавлении к алканам водного раствора перманганата калия окраска раствора не меняется. Однако при каталитическом окислении (в присутствии солей марганца) и одновременном нагревании происходит окисление алканов (особенно высших) с образованием многих кислородсодержащих веществ (спиртов, кетонов, карбоновых кислот и др.).
На воздухе алканы горят с образованием оксида углерода (IV) и воды. При этом выделяется значительное количество теплоты.[5].
2.4 Новые направления в изучении реакции алканов
В последнее время были найдены новые гомогенные реакции алканов, протекающие в растворе или газовой фазе. Так, были открыты реакции насыщенных углеводородов с электрофилами в растворах сильных кислот или суперкислот [6, 7]. В качестве электрофильной частицы в растворах кислот FSO3H—SbF5 или HF—SbF5 выступает протон, при атаке которого на алкан образуется алкониевый ион СnН2n+3+, распадающийся далее с расщеплением связи С—Η или С—С.
Электрофильное замещение водорода в алканах на нитрогруппу происходит под действием NO2+PF6-в дихлорметане при комнатной температуре, а реакция алкана с Сl2 в SbF5—SO2C1F протекает даже при —78°.
Растворы флуоранила в HF—SbF5 окисляют метан, пропан, н-пентан [8]. При растворении Н2О2 или О3, в FSO3H—SbF5—SO2C1F возникают соответственно частицы Н3О2+ и НО3+, которые электрофильно атакуют молекулы алканов, в результате чего образуются различные кислородсодержащие производные.
3. Металлокомплексный катализ
В 1969 г. открыта первая реакция алкана с металлокомплексом [9], в которой промежуточно образуется металлорганическое соединение, т. е. производное, содержащее связь металл—углерод [10]. Эта реакция ответственна за Η—D-обмен в метане, этане и высших алканах в системе СnН2n+2—D2O—PtCl42- Несколько позже была обнаружена [11] способность алканов окисляться в системе СnН2n+2—Н2О—PtCl42-—PtCl62-, также с промежуточным образованием металлорганических σ-комплексов платины. Периана и др. [12 -16 ] в своих работах сообщали, что катионы Pd2+ в 96% серной кислоте будут катализировать прямое окисление метана при 453 К до уксусной кислоты с образованием бисульфата метана (предшественника метанола) и двуокиси углерода, как побочных продуктов реакции восстановления.
Понимание элементарных процессов, которые входят в активацию и окисление метана, катализируемых катионами Платины и Золота в серной кислоте, было получено с помощью квантово-химических исследований. Циглер и соавторы [17] изучили механизм активации и функционализации метана с помощью катионов Pt2+ в серной кислоте и определили, что активация метана происходит преимущественно через окислительное присоединение.
Годдард и соавторы [15] изучили туже систему и определяли влияние разных лигандов на стабильность и поведение катализатора. Они показали, что активация связи С-Н может происходить через электрофильное замещение либо окислительное присоединение, в зависимости от лигандов на платиновых центрах. Джонс и др. [18] получили экспериментальные и теоретические данные для превращений метана в метанол смесью селеной кислоты и металлическим золотом в 96%-ной серной кислоте. Их опыты показывают, что метан поддается реакции электрофильного замещения.
В работах [19-23] представлен обзор состояния исследований в области катализа биологического окисления насыщенных углеводородов молекулярным кислородом и моделирование этих процессов на основе комплексов металлов.
Проблемами каталитического окисления алканов рассматривают в своих работах и украинские авторы. Ведущее место в Украине в сфере изучения применения металлокомплексов для окисления алканов занимает ИнФОУ НАН Украины, некоторые результаты этих исследований представлены в [21].
Одним из перспективных направлений металлокомплексного катализа являются реакции с участием катионов палладия. Возможны два механизма активации алканов комплексами палладия. Оба начинаются с образования комплекса алкана с палладием. Первый механизм представляет собой окислительное присоединение метана по связи С-Н, а второй – отрыв атома водорода координированным бисульфатным лигандом с одновременным формированием связи Pd-C
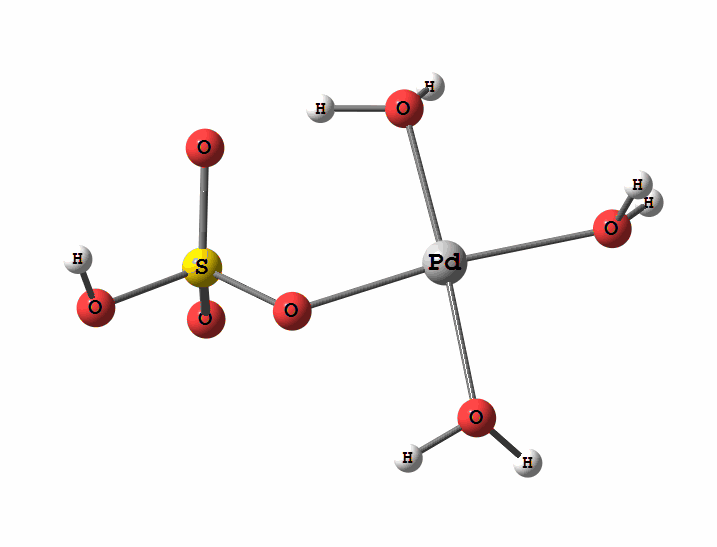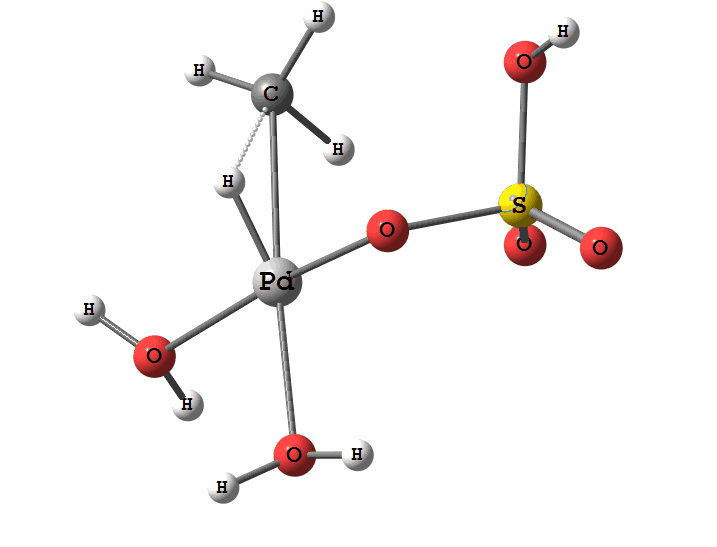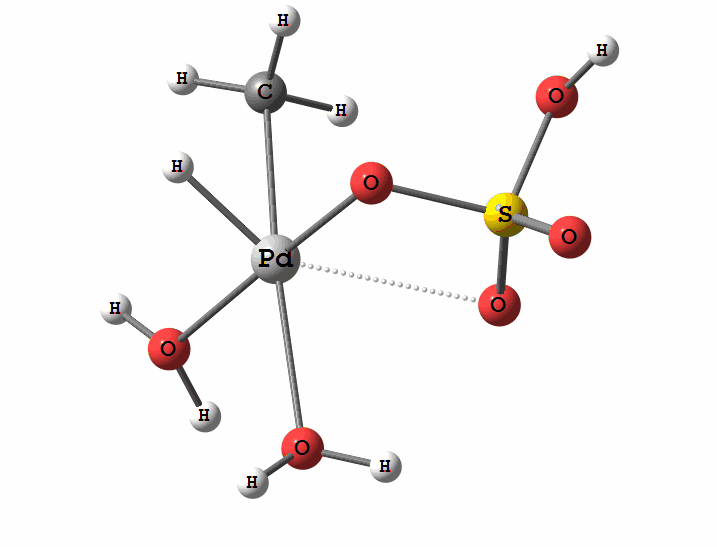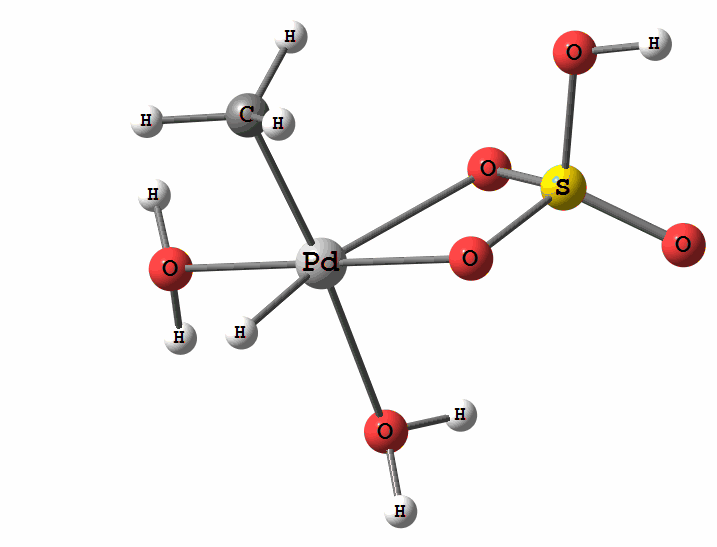
Рисунок 1 Пример реакции окисления
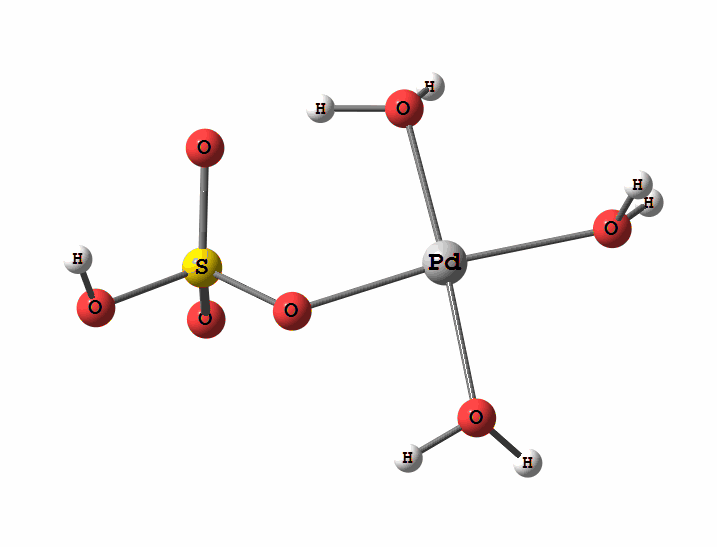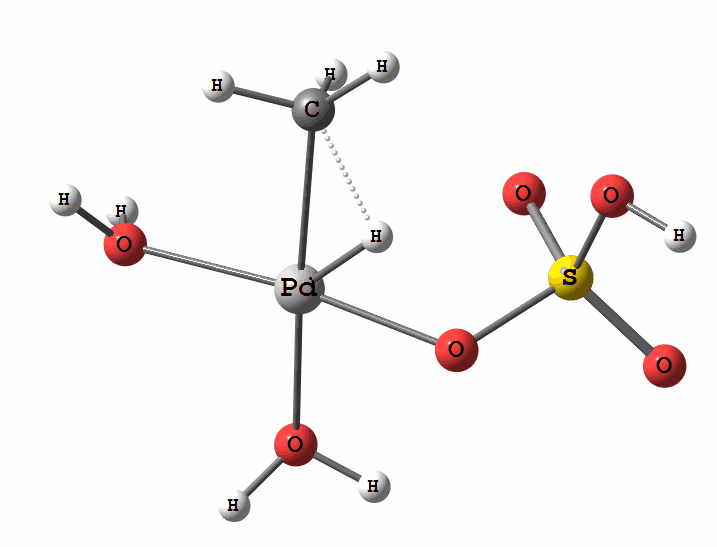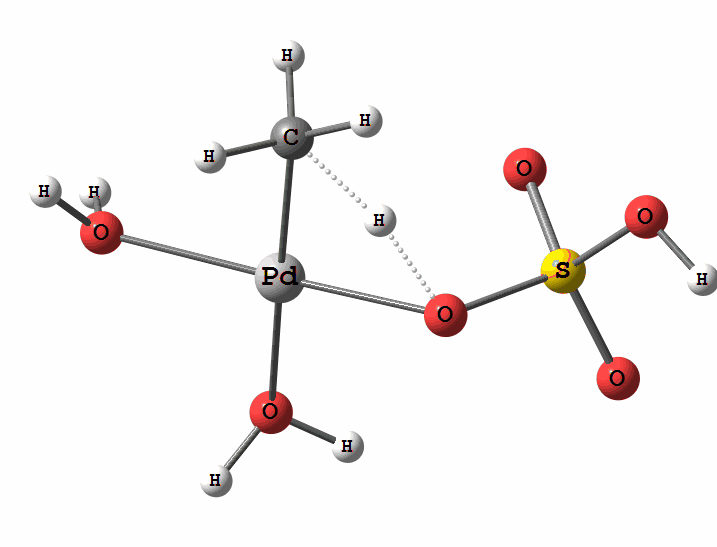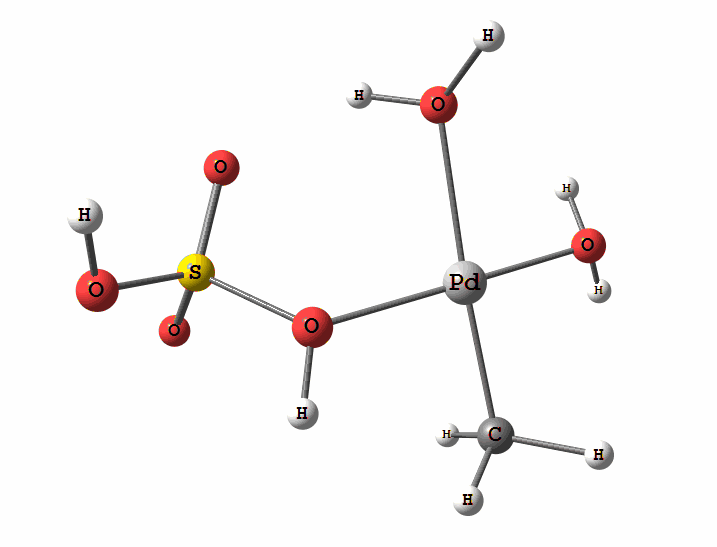
Рисунок 2 Пример реакции электрофильного замещения
Металлокомплексный катализ основан на взаимодействии субстрата с реагентом в координационной сфере комплекса металла. В ряде случаев аналогичен механизму действия ферментов, содержащих атом металла в качестве кофактора. Металлокомплексный катализ может осуществляться под действием гомогенных и гетерогенных металлокомплексных катализаторов. Первые присутствуют в растворе вместе с реагентами и продуктами, вторые осуществляют катализ на поверхности, если они не растворимы в данной среде или различными способами нанесены на носитель (полимер или неорганический материал). Такие гетерогенизированные металлокомплексные катализаторы обладают высокой селективностью, отличаются однородностью активных центров и легкостью их модифицирования, а также термостабильностью, длительным сроком службы и регенерируемостью. Выделяют следующие особенности комплексов переходных металлов, определяющих их каталитическую активность:
1. Способность образовывать комплексы с молекулами различных типов, которые, входя в координационную сферу металла – комплексообразователя, активируются, что обеспечивает легкость их дальнейшего взаимодействия.
2. Образование комплексов с координирующим ионом или атомом металла понижает энергию связи реагирующих молекул субстратов, что уменьшает энергии активации их последующих реакций по сравнению с некоординированными молекулами.
3. В координационной сфере металла молекулы изменяют свои кислотные или основные свойства и возникает возможность кислотно-основного взаимодействия при тех значениях рН, при которых свободная молекула не реагирует.
4. Если имеется запрет по симметрии молекулярных орбиталей, препятствующий взаимодействию молекул, то при реакции в координационной сфере металла он может сниматься или значительно ослабляться.
5. Во внутренней сфере процессы, протекающие через переходное состояние, могут быть разрешены и могут протекать с малыми энергиями активации.
6. Металлорганический катализ позволяет осуществить реакции многоэлектронного окисления и восстановления, в которых молекула субстрата в координационной сфере сразу принимает или отдает несколько электронов. При этом облегчаются процессы, в которых последовательный перенос электронов затруднен из-за термодинамических трудностей одно- или двухэлектронных стадий.[24]
4. Характеристика неэмпирических методов квантовой химии
В годы зарождения квантовой химии использовались полуэмпирические методы. Движение электронов в химических системах рассматривалось только при фиксированном положении ядер (адиабатическое приближение). Изучались молекулы самых легких элементов – водорода, гелия. Решение уравнения Шредингера даже в этом случае связано с трудоемкими расчетами. [25]
В современных химических исследованиях, благодаря распространению мощных ЭВМ, широко применяются неэмпирические квантовые расчеты, в которых из экспериментальных данных используются только заряды ядер атомов.
Неэмпирические методы служат для решения самых разнообразных задач. Определение равновесной конфигурации ядер молекулы требует поиск минимума на поверхности потенциальной энергии, который проводят по точкам, то есть многоразово решают электронную задачу для разных конфигураций ядер.
В переводе с латинского ab initio означает из первых принципов
. Действительно, к данной группе относятся методы, в соответствии с
которыми вычисление проводится исключительно на теоретической базе, то есть без введения в расчетную схему каких-либо параметров,
полученных экспериментальным путем. При расчете все величины имеют конкретный физический смысл. Такими методами являются: метод
Хартри-Фока-Рутаана, разнообразные вариации конфигурационного взаимодействия, методы теории возмущения, а также метод объединенных
кластеров. К преимуществу данного подхода следует отнести приемлемую точность расчета, относительную универсальность. Недостатком же
является ресурсоемкость процедуры, поэтому группа ab initio методов стала применяться химиками позднее методов полуэмпирических
(точнее, они находили применение, но лишь к простейшим системам, не намного превосходившим по сложности молекулу водорода) [26]
Неэмпирические методы, в принципе, дают квантовомеханическое описание состояний системы, исходя только из заданного числа электронов в ней, числа и зарядов ядер. Как правило, расчеты молекул в рамках неэмпирических методов выполняются в адиабатическом приближении, т.е. раздельно решается так называемая электронная задача – определение энергий и волновых функций электронов (электронных состояний) при фиксированных положениях ядер в пространстве, и ядерная задача – расчет энергий и волновых функций ядер в поле, создаваемом электронами в данном состоянии [27].
В настоящее время неэмпирические методы позволяют изучать особенности строения и взаимного расположения ППЭ, механизм реакций, взаимодействия молекулы с электромагнитным излучением, постоянными или переменными внешними воздействиями. Наиболее распространено применение неэмпирических методов для малых молекул, для которых эти методы позволяют подчас получить практически полное описание с точностью, близкой или даже превосходящей экспериментальную. Развитие вычислительной техники позволяет проводить неэмпирическое исследование все более сложных систем, например аминокислот или их комплексов. Однако для последовательного анализа выделенного класса родственных соединений целесообразнее использовать методы, учитывающие их специфику. Обычно молекулы большого размера описывают с помощью полуэмпирических методов квантовой химии либо других методов моделирования химических систем [27].
Неэмпирические (ab initio) методы, оставаясь наиболее точными и последовательными расчетными методами квантовой химии, тем не менее обладают принципиальными недостатками, затрудняющими их широкое применение:
- большая трудоемкость расчетов, связанная с тем, что время расчета растет как n4 (где n – число базисных атомных орбиталей (АО)), требует применения суперкомпьютеров уже для молекул с n~200–250, что соответствует числу атомов N=10–20 при использовании расширенного базиса;
- до сих пор не решена проблема полного учета корреляционной энергии Ecorr, величина которой в некоторых случаях сопоставима с энергией достаточно прочной ковалентной связи, хотя и мала по сравнению с полной энергией молекулы (Etot) [28].
Главным инструментом исследования при квантово-химическом моделировании является компьютер, на котором установлена одна из программ для расчетов по методу молекулярных орбиталей. К настоящему моменту доступно несколько таких программ, имеющих свои достоинства и недостатки. Одной из таких программ является GAMESS (General Atomic and Molecular Electronic Structure System – система общего назначения для расчетов атомных и молекулярных структур). Это некоммерческое программное обеспечение, которое его создатели распространяют в виде бинарных кодов при условии регистра-ции и заполнения специальной анкеты. Основным достоинством GAMESS-PC является высокая скорость работы по сравнению с другими квантово-химическими программами, что немаловажно при исследованиях сложных молекулярных систем.
Некоторые из возможностей программы GAMESS представлены ниже:
- Возможность расчета молекулярных волновых функций методом са-мосогласованного поля в приближении RHF, UHF, ROHF, GVB и MCSCF;
- Учет энергии электронной корреляции на основе теории возмущений, конфигурационного взаимодействия, связанных кластеров и функционала плотности;
- Возможность выполнения полуэмпирических расчетов методами MNDO, AM1 и PM3;
- Автоматическая оптимизация геометрии, поиск переходных состояний с использованием аналитических градиентов;
- Решение колебательной задачи – расчет частот валентных колебаний ИК- и спектров комбинационного рассеяния;
- Вычисление молекулярных свойств, таких как дипольный момент, электростатический потенциал, электронная и спиновая плотность, анализ заселенностей по Малликену и Лёвдину;
- Возможность моделирования влияния растворителя.
Работа в программе GAMESS состоит в составлении исходного файла с указанием всех необходимых параметров. После создания файла исходных данных вызов программы производится из командной строки, удобно использовать Total Commander. Просмотр результатов производится с помощью программы Chemcraft. Также с помощью этой программы можно задавать приблизительную геометрию молекулы. Вид окна программы Chemcraft показан на рисунке 3
Рисунок 3 Интерфейс Chemcraft
Выводы
Хотя соединения переходных металлов отличаются довольно сложной структурой и дороговизной, в их использовании прежде всего привлекает внимание высокая селективность совместно с высокой активностью катализаторов. Именно поэтому исследование свойств переходных металлов и механизмов их реакция являются актуальными научными задачами, рассмотрению которых и посвящена данная магистерская работа.
Таким образом, в магистерской работе решены следующие задачи:
- Проведены исследования реакций активации метана, которая катализируется катионами палладия (II), окруженного различными лигандами.
- Рассчитаны структуры исходных комплексов палладия и их метановых производных.
- Найдены структуры переходных состояний активации метана по двум возможным механизмам – окислительное присоединение и отрыв протона координированным бисульфатным лигандом с одновременным образованием связи Pd-C.
- Выполнена оценка барьеров активации исследованных реакций , что отвечают двум возможным механизмам.
Дальнейшая работа направлена на исследование процессов активации как палладиевыми комплексами с различными лигандами, так и другими металлокомплексами.
Список источников
- Синев М. Ю., Корчак В. Н., Крылов О.В. Механизм парциального окисления метана: – Успехи химии, 1987, №5,сс.754 -792
- Шилов А.Е., Шульпин Г.Б. Активация и каталитические реакции алканов в растворах комплексов металлов:– Успехи химии, 1989, №1,сс.38 -57
- Алканы [Электронный ресурс] – Режим доступа: http://chemister.ru/Database/words-description.php?dbid=1&id=92
- Метан, Methane [Электронный ресурс] – Режим доступа: http://www.niikm.ru/articles/element_articles/methane/
- Предельные, или насыщенные, углеводоробы ряда метана(алканы или парафины) [Электронный ресурс] – Режим доступа: http://himiy.ucoz.ru/index/0-9
- Shilov A. E. Activation of Saturated Hydrocarbons by Transition Metal Complexes. Dordrecht: D. Reidel, 1984.
- Olah G. A., Parker D. G., Yoneda N. Angew. Chem., Int. Ed., 1978, v. 17, p. 909.
- Bedioni F., Farbre P.-L, Devynek J. Chem. Communs, 1982, p. 290.
- Гольдшлегер Η. Φ., Тябин М. Б., Шилов А. Е., Штейнман А. А. Журн. физ. химии, 1969, т. 43, с. 2174.
- Губин С. П., Шульпин Г. Б. Химия комплексов со связями металл — углерод. Новосибирск: Наука, 1984.
- . Гольдшлегер Н. Ф., Еськова В. В., Шилов А. Е., Штейнман А. А. Журн. физ. химии, 1972, т. 46, с. 1353.
- Periana, R. A.; Mironov, O.; Taube, D.; Bhalla, G.; Jones, C. J. Science 2003, 301, 814.
- Kua, J.; Xu, X.; Periana, R. A.; Goddard, W. A. Organometallics 2002, 21, 511.
- Xu, X.; Kua, J.; Periana, R. A.; Goddard, W. A. Organometallics 2003, 22, 2057.
- Jones, C. J.; Taube, D.; Ziatdinov, V. R.; Periana, R. A.; Nielsen, R. J.; Oxgaard, J.; Goddard, W. A. Angew. Chem., Int. Ed. 2004, 43, 4626.
- Zerella, M.; Kahros, A.; Bell A. T. J. Catal. 2005, in press.
- Zerella, M.; Mukhopadhyay, S.; Bell, A. T. Chem. Commun. 2004, 1948
- Gilbert, T. M.; Hristov, I.; Ziegler, T. Organometallics 2001, 20, 1183.
- Hristov, I. H.; Ziegler, T. Organometallics 2003, 22, 1668.
- Treutler, O.; Ahlrichs, R. J. Chem. Phys. 1995, 102, 346.
- Rudakov, E. S.; Yaroshenko, A. P.; Rudakova, R. I.; Zamashchikov, V. V. Ukr. Khim. Zh. 1984, 50, 680.
- Мацура В.А., Украинцев В.Б., Потехин В.В. Окисление молекулярным кислородом и гидрирование бензилового спирта в присутствии коллоидного палладия in situ// Журн. общей химии. 2000. Т.70. Вып. 12. С. 2058.
- Рядинская Н.Ю., Потехин В.М., Потехин В.В. Реакции третичных спиртов с тетрааквакомплексом палладия(II). Образование π-аллильных комплексов палладия // Журн. общей химии. 2001. Т.71. Вып. 8. С. 1242-1248.
- Металлокомплексный катализ [Электронный ресурс] – Режим доступа: http://www.chem.isu.ru/leos/base/eos15.html
- Квантовая химия на ПК: Компьютерное моделирование молекулярных систем : учеб.-метод. пособие / В. Б. Кобычев. – Иркутск : Иркут. гос. ун-т, 2006. – 87 с.
- Овчинников, М.Ю. История квантовой химии [Электронный ресурс] – Режим доступа: http://www.qchem.ru/materials/history/omyu_qchem/
- Химическая энциклопедия / «Советская энциклопедия», М. – 1988
- Блатов, В.А. Полуэмпирические расчетные методы квантовой химии/ В.А. Блатов A.П. Шевченко, Е.В. Пересыпкина/
Универс-групп
, 2005
