Основные понятия и определения
Область применения биодатчиков главным образом связана с определением состояния биологических объектов, с удовлетворением запросов медицины, сельскохозяйственного производства, пищевой промышленности, сферы обитания.
В России работы по биодатчикам ведутся в Санкт-Петербургском технологическом институте и государственной Академии аэрокосмического приборостроения, в МГУ, в Институте медицинской и биологической кибернетики Сибирского отделения Академии медицинских наук (г. Новосибирск).
В настоящее время в медицине биодатчики используются для диагностики ряда заболеваний и контроля процессов их протекания в ходе лечения. Биодатчики могут оценивать количество глюкозы в организме, и результаты этих измерений, могут быть применены для поддержания нормальной концентрации инсулина в крови у больных диабетом.
В сельском хозяйстве и пищевой промышленности биодатчики могут применяться для контроля качества продукции. Например, датчики на основе мембран тиллакоидов шпината используются для определения концентрации гербицидов. В Японии созданы биодатчики для определения гипотоксина в тканях рыбы.
датчики для определения гипотоксина в тканях рыбы. В экологии биодатчики используются для наблюдения за химическим составом сточных вод, воздушной и водной сфер, параметрами окружающей среды и др.
Под биодатчиками обычно понимают:
а) средства определения содержания в анализируемом объекте биологических молекул и частиц;
б) системы, предназначенные для съёма сигналов измерительной информации с различных биологических объектов и их элементов;
в) средства косвенного измерения концентрации различных веществ путём оценки количества продуктов ферментивной реакции;
г) датчики, содержащие биологические элементы, тесно связанные с преобразователями его реакции на специфическое воздействие (химическое или физическое) и выдающие удобный для обработки сигнал.
Биодатчик конструктивно обособленная совокупность чувствительных биологических элементов и измерительных преобразователей, воспринимающая одну или несколько входных величин и формирующая измерительные сигналы.
Чувствительный биологический элемент – это часть первого в измерительной цепи биодатчика, воспринимающая входной измерительный сигнал. В качестве чувствительного элемента используют целые организмы, ткани, клетки, органеллы, биологические мембраны, ферменты и их компоненты, рецепторы, антитела, нуклеиновые кислоты, органические молекулы и другие вещества.
В биодатчиках широко используются электрохимические преобразователи с потенциометрическими, амперометрическими, кондуктометрическими и другими цепями.
Электрохимический преобразователь представляет собой проводник электрического тока, который помещается в исследуемую среду. При этом устанавливается электрохимический процесс, связанный с переносом зарядов между присутствующими в среде заряженными частицами и электрохимическим преобразователем. На границе раздела среда–преобразователь формируется выходной электрический сигнал (в виде тока или напряжения).
Принцип действия преобразователя с потенциометрическим выходом основан на определении разности потенциалов, которая устанавливается между измерительным электродом и электродом сравнения. Электрод сравнения имеет постоянный и воспроизводимый потенциал, не зависящий от среды, в которую он помещен. Разность потенциалов обусловливается активностью ионов электролита, в который помещен преобразователь. Определяются окислительно-восстановительные потенциалы, уровень рН и ионов. Окислительно-восстановительные реакции, протекающие в растворе, сопровождаются обменом электронов (ne):

Вещество, присоединяющее электроны в направлении → (1) , играет роль окислителя и восстанавливается. Вещество, которое отдаёт электроны в направлении ← (2) , играет роль восстановителя и окисляется. При помещении химически стойкой проводящей нити в раствор между проводником и веществами окислителем и восстановителем происходит обмен электронами в двух направлениях, пока проводник не приобретёт равновесный потенциал.
Обычно электроды изготавливаются из золота, платины, ртути, серебра или графита (рисунок 39). Например, платиновые электроды используются для измерения потенциалов от минус 0,1 до +0,9 В, золотые от минус 1 до +0,3 В.
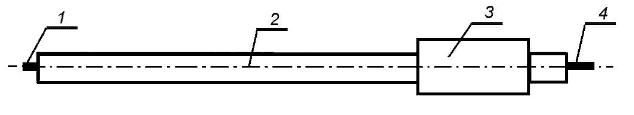
Рисунок 39 – Конструкция электрода для определения окислительно-восстановительных потенциалов (1 – чувствительный элемент (платина, золото и др.); 2 – стеклянный корпус; 3 – головка; 4 – электрический вывод )
Величина рН характеризует кислотность растворов и определяется как отрицательный логарифм ионов водорода Н+. Принцип действия преобразователя рН основан на следующем. Некоторые типы стекол являются слабым проводником электрического тока. Потенциал, который устанавливается на границе между мембраной из такого стекла и водным раствором, зависит от кислотности раствора (уравнение Нернста). Конструкция рН-электрода показана на рисунке 40.
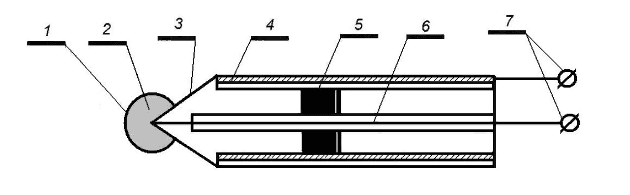
Рисунок 40 – Конструкция pH-электрода (1 – стеклянная мембрана; 2 – раствор; 3 – корпус; 4 – экран; 5 – втулка; 6 – электрод сравнения; 7 – электрический вывод )
К стеклянной мембране 1 сферической формы припаяна трубка-корпус 3 из стекла с высоким электрическим сопротивлением. Внутри электрода находится раствор 2 с известной кислотностью (обычно рН = 7), в который погружен электрод сравнения 6. Для измерения рН электрод погружают в исследуемый раствор и измеряют разность потенциалов между внутренним электродом сравнения 6 и рабочим электродом 1.
Принцип действия ионоселективных преобразователей аналогичен рН-преобразователю. Некоторые стекла, полимеры, моно- и поликристаллы проявляют особую чувствительность к активности ионов щелочных металлов и других веществ (Na+, K+, Ca2+, Ag+, Cu2+, NH4+, NO3-, C1O4- и др.). Ионоселективные электроды формируют электрический сигнал, определяемый активностью ионов. Активность ионов при постоянной температуре зависит от концентрации определяемых ионов, их заряда, а также от природы и концентрации посторонних ионов, присутствующих в растворе.
Работа амперометрических преобразователей связана с прохождением электрического тока в измерительной цепи. Как правило, между двумя электродами датчика (металлический электрод и электрод сравнения) создается разность потенциалов. Концентрация исследуемых частиц пропорциональна силе тока, возникающей в электродной цепи.
Среди амперометрических преобразователей в биодатчиках распространен так называемый «кислородный электрод» (рисунок 41). Он состоит из двух электродов различной полярности: платинового катода 1 и серебряного анода 4, покрытого хлоридом серебра. Электроды погружены в хлорид калия 3. Эта измерительная ячейка отделена от исследуемого вещества тонкой мембраной 2, проницаемой для кислорода. Электроды заряжают до разности потенциалов порядка 700 мВ. Кислород диффундирует через мембрану и восстанавливается на катоде. Ток, обусловленный этой окислительно-восстановительной реакцией, пропорционален количеству восстановленного кислорода. Разновидностью кислородного электрода является так называемый топливный элемент (ячейка).
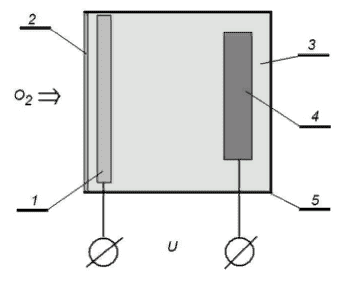
Рисунок 41 – Схема кислородного электрода (1 – катод; 2 – мембрана; 3 – электролит; 4 – анод; 5 – корпус)
В такой ячейке электропроводящий материал с большой поверхностью расположен между электролитом и атмосферным воздухом. В присутствии кислорода происходит окисление активной поверхности этого материала с выделением тепла. В результате химической реакции с кислородом воздуха в измерительной ячейке между катодом и анодом возникает напряжение. Реакция протекает очень быстро. Температурная компенсация осуществляется внутри ячейки.
Кондуктометрические преобразователи состоят из двух электродов, изготовленных из химически стойких материалов. На электроды подаётся переменное напряжение или ток. Использование переменного напряжения или тока позволяет уменьшить влияние поляризационных явлений на границе раздела среда-электрод. Измеряя напряжение при известном токе или ток при известном напряжении, рассчитывают проводимость исследуемой среды.
Основные принципы работы и метрологические характеристики
Тип биодатчика определяется прежде всего биологическим материалом его чувствительного элемента. Поэтому в первую очередь следует различать микробные, ферментативные, клеточные и тканевые биодатчики. На рисунке 42 показана конструкция микробного датчика для определения суммарного содержания усваиваемых сахаров в патоке.
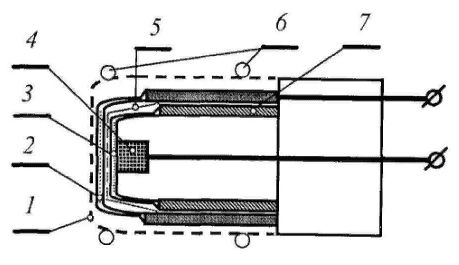
Рисунок 42 – Конструкция биодатчика для определения содержания усваиваемых сахаров в патоке (глюкозы, фруктозы и сахарозы)(1 – целлофановая мембрана; 2 – микроорганизмы, закреплённые на нейлоновой сетке; 3 – гелиевый электролит; 4 – платиновый катод; 5 – тефлоновая мембрана; 6 – резиновое кольцо; 7 – серебряный анод)
Этот биодатчик предназначен для определения общего содержания сахаров в бродильной среде. Он содержит чувствительный элемент из закреплённых живых клеток Brevibacteriumlactofermentum и кислородного электрода. Клетки иммобилизовали на куске нейлоновой сетки размером 10×10 мм2, которую прикрепляли к кислородному датчику. Содержание сахаров оценивается по потреблению кислорода иммобилизованными микроорганизмами. Повышение, например, концентрации глюкозы, приводит к увеличению поглощения кислорода в растворе.
Датчики имеют линейную зависимость между уровнем выходного тока и концентрацией глюкозы (до 1 мМ – милли-моль), фруктозы (до 1 мМ) и сахарозы (до 0,8 мМ). Время отклика биодатчика составило 10 мин. Общее содержание усваиваемых сахаров рассчитывали, суммируя значения откликов на глюкозу, фруктозу и сахарозу. Разность истинных и расчетных концентраций не превысила 8%. Биодатчик работал в бродильной среде для получения глутаминовой (амид глутаминовой кислоты, входящий в состав белков) кислоты в течение 10 дней и выдержал 960 измерений.
В России создан компьютеризированный стенд с биодатчиками глюкозы, температуры. На стенде производится экспресс-анализ в течение 50 с. Концентрация глюкозы в крови пациента определяется с погрешностью до 5 % непосредственно в кабинете врача.
Микробные биодатчики применяются для определения концентрации муравьиной, никотиновой, глутаминовой кислот, спиртов, аммиака и других веществ.
В ферментных биодатчиках в качестве чувствительных элементов используют специальные биологические катализаторы-ферменты, обеспечивающие специфичность и высокую скорость биохимических реакций с субстратом (веществом, химическая модификация которого катализируется ферментом). В состав такого датчика входят мембрана с иммобилизованным ферментом и вторичный измерительный преобразователь (амперометрический, потенциометрический и т.п.).
Одна из сторон мембраны контактирует с исследуемой средой, а другая ? с рабочей камерой вторичного измерительного преобразователя. Например, для измерения содержания глюкозы на мембрану нанесён фермент – глюкозоксидаза, в присутствии которой происходит окисление исследуемой глюкозы:

Выделяющаяся перекись водорода окисляется на разделе анод–мембрана в соответствии с реакцией:

Возникающий при этом ток пропорционален окисленной перекиси водорода и несет информацию о концентрации глюкозы в исследуемой среде. В биодатчике приняты меры для улучшения восприятия глюкозы в сложных биологических жидкостях. Приводятся такие характеристики этого датчика: диапазон концентрации глюкозы 0,2–2,0 мл (это требует разбавления крови в 10 раз); функция преобразования – линейная; время жизни 1 год; длительность работы с одним ферментным электродом 2 недели; срок хранения при 4 °С 6 месяцев; погрешность измерения ±5 %. В качестве ферментов используются и другие вещества: холиноксидаза, аминокислотная оксидаза, ксантиноксидаза и др.
В тканевых биодатчиках используются растительные и животные ткани: листья, цветы, плоды растений, мышцы кролика, бычья печень. Из-за наличия в тканях нескольких ферментов приходится принимать меры для разделения сигналов, например, подбором рН или температурного режима. В некоторых случаях это позволит использовать один датчик для восприятия нескольких величин. Созданы биодатчики из листьев кольраби (что-то вроде капусты) (для определения концентрации перекиси водорода), тканей баклажана, картофеля, тыквы, банана, кабачка, сахарной свеклы.
На рисунке 43 показана конструкция биодатчика для определения глутамина с животной тканью.
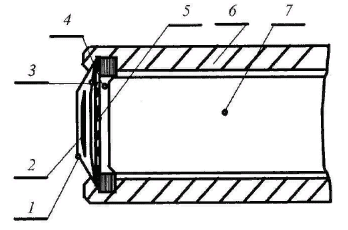
Рисунок 43 – Конструкция биодатчика для определения глутамина с живой тканью (1 – нейлоновая поддерживающая мембрана; 2 – ткань почки свиньи; 3 – внутренняя диализная мембрана; 4 – внутренний электролит; 5 – газопроницаемая тефлоновая мембрана; 6 – корпус; 7 – pH-электрод )
Концентрация глутамина служит диагностическим критерием в медицине (критерий Рея). В таком датчике тонкий слой кортекса почки свиньи закрепляется на поверхности рабочей части датчика, чувствительного к газообразному аммиаку.
Глутамин – амид глутаминовой кислоты, входящий в состав белков. Играет важную роль в азотистом обмене путем образования глутамина из глутаминовой кислоты в организмах растений и многих животных.
Клетки почки имеют высокую концентрацию фермента глутаминазы, катализирующего реакцию.
Ткань почки 2 удерживается тканевой нейлоновой сеткой 1 с размером отверстий порядка 150 мкм. Для защиты газопроницаемой мембраны 5 от клеточных компонентов ткани 2 между ней и мембраной помещают тонкую диацетилцеллюлезную пленку 3. При взаимодействии глутамина, поступающего из анализируемого раствора, с закреплённым катализатором (ткань почки), содержащим глутаминазу, образуется аммиак.
Измеряя концентрацию аммиака, получают информацию о содержании субстрата – глутамина в растворе. Тканевые глутаминовые биодатчики по своим характеристикам превосходят ферментные и микробные биодатчики.
В названии биодатчиков иногда отражается тип формирователей выходных сигналов (потенциометрические, амперометрические, кондуктометрические, калориметрические и др.).
По количеству воспринимаемых и преобразуемых величин можно выделить одномерные и многомерные биодатчики, воспринимающие несколько входных величин.
Использование плодов растений (без разрушения их структуры) в качестве многомерных биодатчиков – новое перспективное направление в измерительной технике. Необычайная чувствительность растений к различным факторам окружающей среды замечена ещё ботаниками и физиологами прошлого века.
Растения реагируют на ничтожные изменения интенсивности светового потока, обладают высокой химической чувствительностью. Реагируют на радиоактивное излучение и на малейшие изменения влажности воздуха. Высокой чувствительностью к внешним факторам обладают и семена растений.
Основные преимущества датчиков с плодами растений объясняются следующим:
1. Плоды обладают высокой устойчивостью к воздействию различных экстремальных факторов (они сохраняют жизнеспособность при воздействии отрицательных температур в течение длительного времени).
2. При использовании плодов в качестве биодатчиков существует реальная возможность создания миниатюрных датчиков, способных конкурировать с микроэлектронными датчиками.
3. При проведении процедуры измерений потребуются менее сложные технические средства, чем при решении подобных задач с применением ферментов и других биологических веществ.
4. Проще осуществить взаимозаменяемость чувствительных элементов, так как имеется возможность отбора и сортировки по равным показателям массы, формы, размеров и др.
Нужно отметить, что семена арктического люпина через 5–19 тысяч лет пребывания в арктической мерзлоте в норах леммингов дали всходы; через тысячу лет возвращаются к жизни семена растений Nelumbo nucifera, 110–130 лет сохраняют жизнеспособность семена обыкновенных ячменя и овса. Этот факт показывает, что срок службы биодатчиков может быть большим. Семена плодов имеют небольшую массу и размеры.
Приведём пример использования плода гороха в датчике влажности и температуры. Плод растения (рисунок 44) помещался в полый цилиндрический пьезоэлемент.
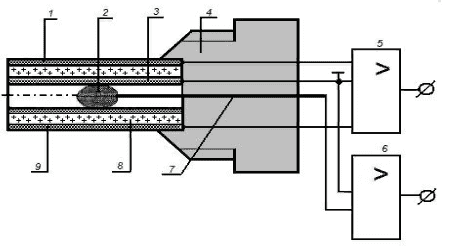
Рисунок 44 – Конструкция биодатчика температуры и влажности воздуха (1, 3, 9 – серебряные токопроводящие электроды; 2 – плод гороха; 4 – корпус; 5 – усилитель пьезо-ЭДС (влажность); 6 – усилитель биопотенциалов (температура); 7 – микроэлектрод для снятия биопотенциалов; 8 – цилиндрический полный пьезоэлемент)
Влажность среды изменяла объём семени. Это приводило к изменению заряда пьезоэлемента – выходного сигнала датчика. Кроме того, как оказалось, плоды растений реагировали на изменение температуры своей биоэлектрической активностью. Эксперимент подтвердил принципиальную возможность создания таких биодатчиков. Диапазон измерения влажности составил 0–100%, а основная погрешность не более 4%. Временная нестабильность выходного сигнала в течение 48 ч не превысила 1,5%. Нелинейность градуировочной характеристики была более 15% в диапазоне влажности от 14 до 97%. При измерении же температуры от 20 до 60 °С датчик позволял выполнять измерение с погрешностью ±5%.
Большой чувствительностью к влажности обладают и плоды аистника. В сухую погоду они закручиваются в «штопор», а во влажную распрямляются. Корпус биодатчика на рисунке 45 имеет форму цилиндрической резьбовой втулки.
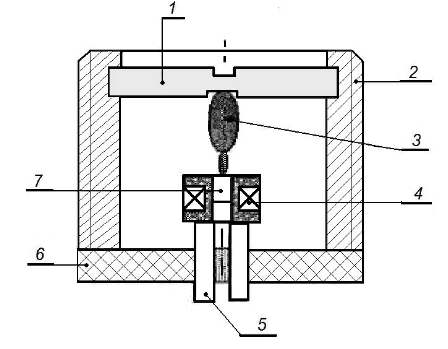
Рисунок 45 – Конструкция датчика температуры и влажности воздуха(1 – пробка; 2 – корпус; 3 – плод аистника; 4 – обмотка индуктивного преобразователя; 5 – электрические выводы датчика; 6 – основание; 7 – якорь индуктивного сопротивления )
В верхнюю часть трубки вкручивалась прозрачная пробка с закреплённым на ней плодом растения. Сердечник якоря индуктивного преобразователя имеет углубление для механического крепления его к остям аистника. Обмотка, изготовленная из медного провода, дополнительно выполняет функции преобразователя температуры. При совершении гигроскопических движений (под влиянием влажности) аистника с якорем изменяется индуктивность преобразователя. Индуктивность измерялась на переменном токе (10 кГц). Температура же изменяет активное сопротивление обмотки, и процедура измерения температуры осуществляется на постоянном токе.
Нелинейность влагочувствительной характеристики такого датчика составила не более 5 %. При измерении же температуры датчик не уступал по точности измерения обыкновенным медным термометрам сопротивления порядка 2 %. Быстродействие биодатчика при измерении влажности не превысило 1 мин.
Семена могут найти применение в специальных высокочувствительных средствах сигнализации и контроля: биологически активных веществ, вызывающих нежелательные реакции у растений и животных; наличия основных форм бактерий; опасных соединений некоторых химических веществ и др.
В последнее время для изготовления биодатчиков применяется интегральная технология. Например, в биодатчиках используются плоские узлы с вакуумным напылением электродов из платины, палладия или серебра на керамическую подложку. Фермент с пастой укрепляется с помощью ультразвука на поверхности пластины. По такой технологии изготовлен биодатчик глюкозы и лактата. Биодатчик лактата (лактат (молочная кислота) является конечным продуктом гликолиза и гликогенолиза) использовался для определения его содержания в яйцах курицы с различным временем инкубации. Погрешность измерения лактата составила ±5 %. На рисунке 46 показана конструкция интегрального биодатчика для определения концентрации глутамата.
Определение концентрации L-глутаминовой кислоты – важная операция в пищевой промышленности, так как эту кислоту применяют в качестве вкусовой добавки к пищевым продуктам. Чувствительным элементом служит глутаматоксидаза, которая катализирует окисление глутамата, причём в ходе окисления расходуется кислород. Кислородный датчик состоит из газопроницаемой тефлоновой мембраны 7, двух золотых микроэлектродов 4 и раствора электролита 6 (0,1 М КОН). К золотым микроэлектродам прикладывается напряжение порядка 1 В, так как при этом напряжении наблюдается пик тока, обусловленный восстановлением кислорода в процессе работы датчика (определено экспериментальным путем). Между этим размером тока и концентрацией существует линейная зависимость. Глутаматоксидазу закрепляли на триацетилцеллюлёзной мембране 8 и помещали на тефлоновую мембрану 7 кислородного микродатчика и защищали нейлоновой сеткой 9. Испытания биодатчика проводились при определении концентрации глутамата в диапазоне от 5 до 50 мМ. Нелинейность градуировочной характеристики не превысила 1 %.
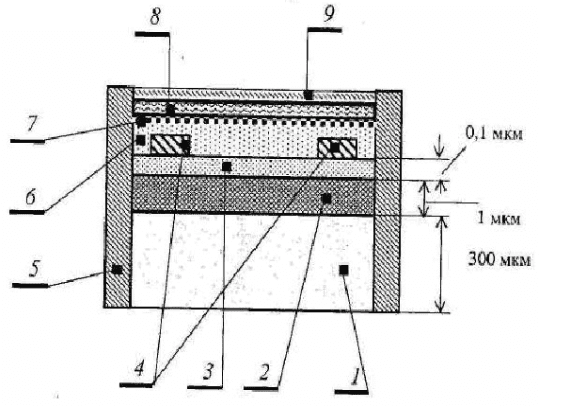
Рисунок 46 – Конструкция интегрального биодатчика для определения глутамата (1 – кремниевая подложка; 2 – диоксид кремния; 3 – нитрид кремния; 4 – золотые электроды; 5 – корпус; 6 – электролит; 7 – тефлоновая мембрана; 8 – трицетилцеллюлезная мембрана; 9 – нейлоновая сетка)
По виду выходного сигнала биодатчики можно условно разделить на активные и пассивные. В активных биодатчиках выходные величины имеют энергетическую природу, в пассивных – неэнергетический параметр.
Созданы активные биодатчики, входящие в тестовую систему «Эколюм» с морскими люминесцентными бактериями, уровень оптического свечения которых зависит от степени токсичности среды. Экспресс-анализ здесь занимает 5 мин. Реагенты производятся в консервированной форме со сроком хранения не менее 6 месяцев. В системе с высокой чувствительностью определяется наличие тяжелых металлов, фенолов, пестицидов. Отмечено, что реакция системы на основные токсические вещества коррелируется с реакцией высших организмов.
Не только высокая чувствительность биодатчиков, но и, главное, возможность определить концентрацию какого-либо вещества, т.е. выполнить биохимический анализ за одну операцию, определяют повышенный интерес к биодатчикам. Перспективы развития биодатчиков в будущем связывают с применением генной и биологической инженерии при создании биологических «искусственных» чувствительных элементов. Дальнейшее использование микроэлектронной технологии при производстве биодатчиков, развитие работ по применению микропроцессоров при обработке измерительных сигналов позволят существенно улучшить их метрологические характеристики и расширить область применения.