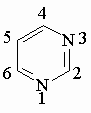 |
|
пиримидин |
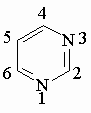 |
|
пиримидин |
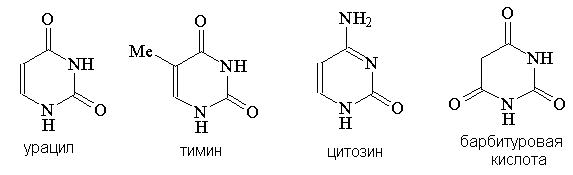
Производные пиримидина являются компонентами нуклеиновых кислот и важнейшими лекарственными препаратами (производные барбитуровой кислоты):
Одним из возможных методов синтеза пиримидинового ядра является образование связей N(1)-C(6)+N(3)-C(4), что предполагает использование трехуглеродного бисэлектрофильного и бинуклеофильного фрагментов
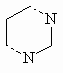
|
трехуглеродный фрагмент |
N-C-N |
|
|
|
|
бисэлектрофил |
бинуклеофил |
|
|
|
|
1,3-дикарбонильное соединение |
производные |
Выбор реагентов осуществляется на основе ретросинтетического анализа конкретных моделей. Например, синтез 4,5-диметилтиопиримидона предполагает использование в качестве бисэлектрофильного трехуглеродного фрагмента ацетилацетона, а бинуклеофила - тиомочевины.
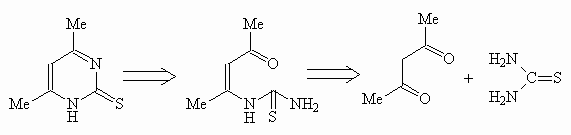 |
| 4,5-диметилтиопиримидон |
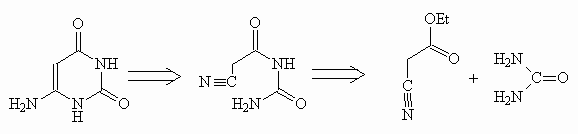 |
| 6-аминоурацил |
Синтез 5-метил-2-фенилпиримидин-4,6-диона на основании такого же подхода осуществляют из диэтилмалоната и бензамидина:
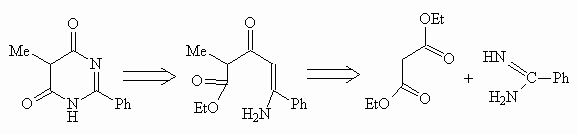
Каждый из предложенных на основании ретросинтетического анализа вариантов осуществлен на практике:
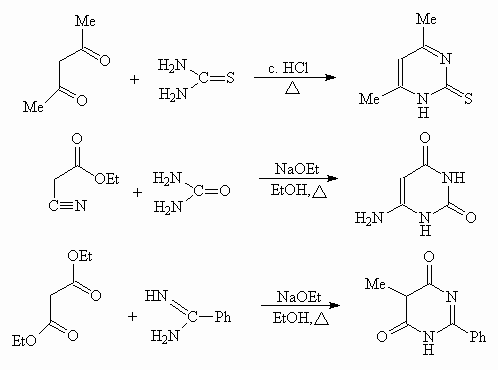
Эквиваленты и скрытые формы 1,3-дикарбонильных соединений также используются
в качестве бисэлектрофильного фрагмента. Так, взаимодействие пропиоловой кислоты
с мочевиной приводит к получению урацила.
Для синтеза цитозина используют диэтилацеталь циануксусного альдегида и мочевину:

Остальные методы получения пиримидинов носят более частный характер.
Для синтеза незамещенного пиримидина в качестве источника атома углерода С(2) используют формамид, который переаминирует енаминокетон I. Процесс идет по следующей схеме:
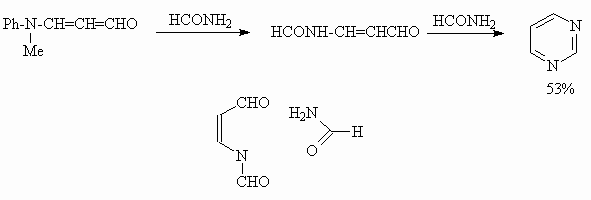
Замыкание цикла сопровождается отщеплением формильной группы.
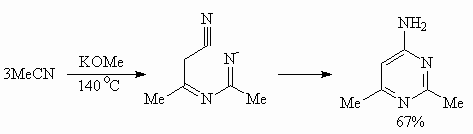
Тримеризация ацетонитрила в присутствии основания приводит к образованию 2,4-диметил-6-аминопиримидина:
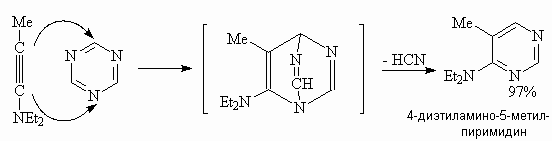
К формированию пиримидинового ядра приводит реакция Дильса-Альдера гетероциеновой системы 1,3,5-триазина с иниминами (диеновый синтез с обратными электронными требованиями):
5.5.Химические свойства производных пиримидина
Атомы азота в молекуле пиримидина обладают основными свойствами. Алкилирование приводит к образованию четвертичных солей.
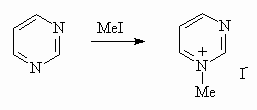
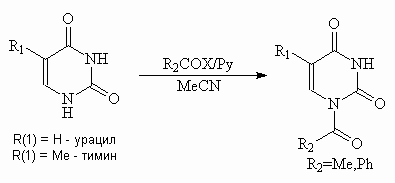
Для урацила и тимина характерно ацилирование атомов азота в присутствии оснований, что обусловлено значительной NH-кислотностью этих производных.
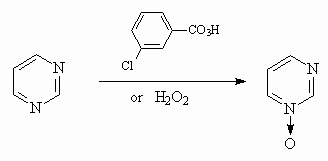
N-Оксиды пиримидина получают окислением пероксидом водорода или м-хлорпербензойной кислотой.
Реакции электрофильного замещения в ряду пиримидина
Электрофильное замещение в самом пиримидине затруднено в еще большей степени, чем в пиридине. При введении донорных заместителей процесс электрофильного замещения становится возможным. В качестве примеров производных пиримидина, активированных к электрофильному замещению, можно привести пиримидоны и аминопиримидины. При одном донорном заместителе успешно идет нитрование и галогенирование в основном по положению 5.
Для слабых электрофилов (реакции Манниха, азосочетание, нитрозирование) необходимо наличие в молекуле двух донорных заместителей.
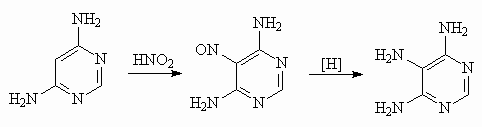
Так, 4,6-диаминопиримидин легко нитрозируется по положению 5, а восстановление нитрозосоединения дает 4,5,6-триаминопиримидин - исходное соединение для синтеза производных пурина.
Очень удобной моделью для осуществления процессов электрофильного замещения является урацил. Замещение идет также по положению 5.
Электрофильное замещение в молекуле урацила
|
Электрофил |
Условия реакции |
Выход, % |
|
NO2+ |
HNO3 (d=1,5), 75oC |
90 |
|
Br+ |
Br2, H2O, 100oC |
90 |
|
Cl+ |
N-хлорсукцинимид, AcOH, 50oC |
52 |
|
F+ |
F2, AcOH, 10oC |
92 |
|
CH2=N+Me2 |
(CH2O)n, Me2NH, 78oC |
76 |
|
+ CH2Cl |
(CH2O)n, HCl, 80oC |
57 |
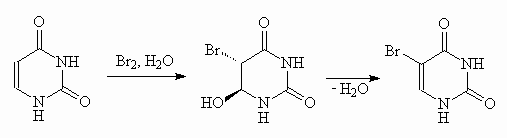
Бромирование урацила в водном растворе идет по механизму присоединения-отщепления:
Нуклеофильное замещение
Хорошо уходящие группы в положениях 2, 4 и 6 легко замещеются нуклеофилами.
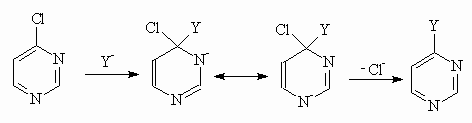
На примере 4-хлорпиримидина показано, что в промежуточно образующемся
анионном ![]() -комплексе отрицательный заряд эффективно делокализуется обоими атомами
азота. Аналогичное явление наблюдается и для атомов галогена в положениях 2 и 6.
Замещение в положении 4, как правило, происходит легче, чем в полод\жении 2, что
создает предпосылки для процедения селективных реакций. Например, в
2,4-дихлорпиримидине селективно замещается на метоксигруппу атом хлора в
положении 4:
-комплексе отрицательный заряд эффективно делокализуется обоими атомами
азота. Аналогичное явление наблюдается и для атомов галогена в положениях 2 и 6.
Замещение в положении 4, как правило, происходит легче, чем в полод\жении 2, что
создает предпосылки для процедения селективных реакций. Например, в
2,4-дихлорпиримидине селективно замещается на метоксигруппу атом хлора в
положении 4:

Помимо атома галогена, замещаться способны и другие уходящие группы:
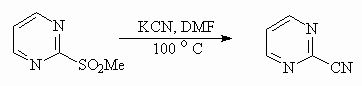
Даже метоксигруппа может быть вытеснена более сильными нуклеофилами:
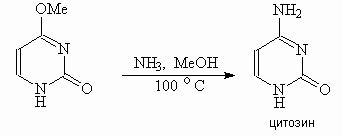
Реакции замещения, идущие по ANRORC-механизму
Примером реакции замещения, идущей через стадии присоединения нуклеофила, раскрытия цикла и повторной циклизации, может служить замещение атома хлора в молекуле 2-хлор-4-фенилпиримидина. Механизм процесса был установлен на основании экспериментов с изотопными метками.

По аналогичному механизму идет и перегруппировка Димрота 1-алкил-2-иминопиримидинов под действием оснований в соответствующие 2-алкиламинопиримидины:
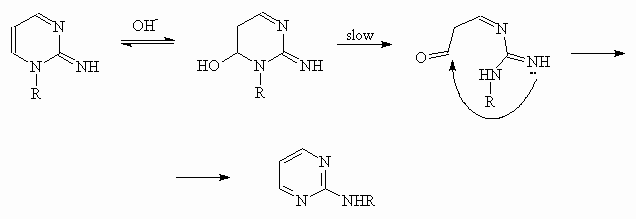
Маршрут процесса был подтвержден выделением оксима альдегида, образующегося при раскрытии цикла.