|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общие сведения о металлах, как загрязнителях окружающей
среды
Металлы - это основа человеческой цивилизации. Поэтому неудивительно, что объемы добычи их и использования огромны. Считается, что если добыча данного элемента опережает его естественный перенос в биогеохимическтм цикле в 10 раз, то такой элемент должен рассматриваться как загрязнитель. По многим металлам эта норма перекрыта сейчас в 15-20 и более раз. Особенно опасно загрязнение окружающей среды тяжелыми металлами.
Роль последних двойственна. С одной стороны, они необходимы для нормального протекания физиологических процессов, а с другой - токсичны при повышенных концентрациях. Их соединения и ионы, попадая в организм, взаимодействуют с рядом ферментов, подавляя их активность (рассмотреть вопрос, почему это происходит - на семинаре).
Поведение металлов в природных средах во многом зависит от специфичности миграционных форм и вклада каждой из них в общую концентрацию металла в экосистеме. Для понимания миграционных процессов и оценки токсичности тяжелых металлов недостаточно определить только их валовое содержание. Необходимо дифференцировать формы металлов в зависимости от химического состава и физической структуры: окисленные, восстановленные, метилированные, хелатированные и др.. Наибольшую опасность представляют лабильные формы, которые характеризуются высокой биохимической активностью и накапливаются в биосредах. По чувствительности к ним животных и человека металлы можно расположить в следующий приблизительный ряд: Hg > Cu > Zn > Ni > Pb > Cd > Cr > Sn > Fe > Mn > Al.
Тяжелые металлы проявляют широкое токсическое воздействие. Некоторые из них, например свинец, оказывают ярко выраженное воздействие на многочисленные органы, тогда как другие - кадмий - имеют более ограниченную область токсического воздействия. Для каждого металла существует свой механизм токсического воздействия, обусловленный конкуренцией между необходимыми и токсичными металлами и особенностями комплексообразования в местах связывания в белковых молекулах.
Следует отметить, что живые организмы имеют механизмы деинтоксикации в отношении тяжелых металлов. Так, в ответ на токсическое действие ионов свинца, кадмия и ртути, печень и почки человека увеличивают синтез металлотионинов - низкомолекулярных белков, в состав которых входит цистеин. высокое содержание в последнем SH-групп обеспечивает связывание ионов металлов в прочные комплексные соединения.
Особенностью металлов как загрязнителей является то, что в отличие от органических закрязняющих веществ, подвергающихся процессам разложения, металлы способны лишь к перераспределению.
Металлы-токсиканты в различных формах способны загрязнять все три области биосферы - воздух, воду и почву.
Поступление тяжелых металлов в окружающую среду имеет как естественное, так и техногенное происхождение. Техногенная доля меди и цинка в атмосфере - 75%, кадмия и ртути - 50%, никеля 30%, кобальта - 10%. Наиболее высокая эмиссия в атмочферу характерна для свинца - 50...80%.
В атмосфере тяжелые металлы присутствуют в форме органических и неорганических соединений в виде пыли и аэрозолей, а также в газообразной форме (ртуть). Основные механизмы выведения тяжелых металлов из атмосферы - вымывание с осадками и осаждение на подстилающую поверхность.
В водных средах тяжелые металлы присутствуют в трех формах: взвешенной, коллоидной и растворенной. Последняя представлена свободными ионами и растворимыми комплексными соединениями с органическими и неорганическими лигандами. Для неорганических соединений - это галогениды, сульфаты, фосфаты, карбрнаты и др.. Среди органических лигандов наиболее прочными являются комплексы гуминовых и фульвокислот (преимущественно низкомолекулярных), входящих в состав гумусовых веществ почвы и природных вод. Следует заметить, что значительная часть тяжелых металлов переносится поверхностными водами во взвешенном состоянии.
Сорбция металлов донными отложениями зависит от особенностей их состава и содержания органических веществ. В конечном итоге тяжелые металлы в водных экосистемах концентрируются в придонных осадках и в биоте, в то время как в самой воде они остаются в сравнительно небольших концентрациях. Так, при концентрации ртути в донных отложениях 80-800 мкг/кг ее содержание в воде не превышает 0,1-3,6 мкг/кг.
Уровни содержания тяжелых металлов в почвах зависят от
окислительно-восстановительных и кислотно-основных свойств последних,
водно-теплового режима и геохимического фона территории. Обычно с увеличением
кислотности почв подвижность элементов возрастает. Так, при
Значительное обогащение природной среды тяжелыми металлами наряду с низким природным уровнем этих металлов в биосфере и высокой токсичностью требует постоянного контроля за их содержанием не только в объектах окружающей среды, но и в пищевых продуктах. Загряхзнение пищевых продуктов тяжелыми металлами наблюдается для с/х культур, выращиваемых на полях вблизи промышленных предприятий или загрязненных городскими отходами и продуктами их переработки. Кроме того, токсичность тяжелых металлоа проявляется как правило на кислых и редко на нейтральных и щелочных почвах. Поглощение металла и его аккумуляция растением зависят также от типа последнего. В растении металл распределяется неравномерно. Так, медь и цинк концентрируются преимущественно в корнях, а кадмий - в листьях.
Т.к., тяжелые металлы малоподвижны в почве, их удаляют с помощью удаления загрязненного слоя. Другим способом является удаление самих металлов с помощью доступных хелатообразующих реагентов (например, этилендиаминтетрауксусной кислотой). При этом металлы переходят в лабильную форму и опускаются в почве на уровень ниже корневой системы (использовалось в Японии для очистки территорий от кадмия). Однако существует опасность загрязнения подземных вод. Поступление тяжелых металлов по пищевой цепи минимизируется выращиванием на загрязненных полях только кормов для животных или тех культур, которые используются для питания человека в малых дозах. Эффективным средством снижения концентрации подвижных форм тяжелых металлов является известкование кислых почв для увеличения рН.
Следует отметить, что в организмах сами тяжелые металлы влияют друг на друга. Типы влияния:
Так, смесь, содержащия цинк и медь в 5 раз более токсична, чем можно
предполагать, суммируя их действия. Цинк и кадмий действуют аддитивно. Кальций и
стронций, бериллий и магний - пары антагонистов.
Ртуть - один из лидеров группы металлов,
представляющих наибольшую опасность для людей. До индустриальной эры ртуть не
оказывала на жизнь организмов практически никакого действия, т.к. ее
концентрация в природе мала и подвижность в биосфере низка. Из схемы круговорота
ртути (по P.Wollast et all, 1975, запасы и перемещения выражены соответственно в
сотнях тонн и сотнях т/год) следует значительное отличие современного состояния
от ее круговорота до появления человека. 
Благодаря деятельности человека возникли два новых потока - разработка и выбросы. Поток ртути в атмосферу увеличился по сравнению с доиндустриальным периодом на 60%. Все это указывает на существенный вклад антрапогенного фактора в цикл данного элемента.
В природе ртуть присутствует в трех состояниях: элементарном, одновалентном,
двухвалентном. В водных системах ртуть может превращаться биогенно с помощью
микроорганизмов из относительно малотоксичных неорганических соединений в
высокотоксичные - метилирование ртути.
Метильные группы переносятся на ион ртути от метилкобаламина - специфического кофермента (небелковой части фермента) бактерии.
Источниками ртути служат производства, связанные с обогащением руд, ртутные
батареи, электролих, красители. Один из распространенных источников -
люминесцентные лампы. Одна лампа содержит около 150 мг ртути и способна
загрязнить
Токсикология свинца исследована
очень тщательно, т.к. его содержание в окружающей среде растет очень быстро. Он
принадлежит к числу малораспространенных элементов (содержание в земной коре по
весу - 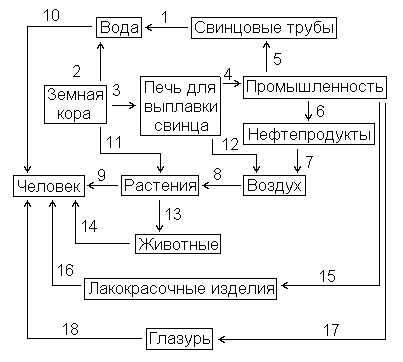
Перемещение свинца в окружающей среде:
Как следует из схемы свинец попадает в окружающую среду различными путями.
Один из распространенных - взаимодействие с водой и кислородом
воздуха:
В основных средах свинец может накапливаться в значительных концентрациях,
образуя растворимые плюмбиты:
Если в воде присутствует СО2, то это приводит к образованию
довольно хорошо растворимого гидрокарбоната свинца:
PbCO3 + H2O + CO2 --->
Pb(HCO3)2
Органические комплексы свинца становятся значимыми только при достаточно
высокой концентрации лигандообразователей - более
Интенсивность сорбции-десорбции свинца речными отложениями зависит от
особенностей их литологического состава и от содержания органических веществ.
При отсутствии растворимых комплексообразующих форм свинец полностью сорбируется
при
Неорганические соединения свинца нарушают обмен веществ и являются ингибиторами ферментов, вызывают умственную отсталость, заболевание мозга. Попадая в клетки, свинец (как и многие другие тяжелые металлы) дезактивирует ферменты. Реакция идет по сульфгидрильным группам белковых составляющих ферментов:
Свинец может заменять кальций в костях, становясь постоянным источником отравления. Органические соединения свинца ееще более токсичны.
Кадмий считается активнее свинца и отнесен
Всемирной организацией здравоохранения к числу наиболее опасных для здоровья
человека веществ. Ежегодное производство кадмия в мире составляет около 20000 т.
Он находит все большее применение в гальванике, производстве полимеров,
пигментов, серебряно-кадмиевых аккумуляторов. Это приводит к проблеме калмиевого
загрязнения окружающей среды. На территориях, вовлеченных в хозяйственную
деятельность человека, кадмий накапливается в организмах, обитающих там животных
и с возрастом увеличиваться до критических для их жизни величин.
Кадмий по своим химическим свойствам родственен цинку и в природных циклах они сопутствуют друг другу. Кадмий может замещать цинк в ряде биохимических процессов в организме и нарушать эти процессы (например, выступать как псевдоактиватор белков).
Симптомы кадмиевого отравления: белок в моче, поражение центральной нервной системы, острые костные боли, дисфункция половых органов. Кадмий влияет на кровяное давление, может служить причиной образования камней в почках (в почках он накапливается особенно интенсивно).
Опасность представляют все химические формы кадмия. Смертельной для человека может быть одноразовая доза в 30-40 мг. Особенностью кадмия является большое время удержания: за 1 сутки из организма выводится около 0,1% от полученной дозы.
Искуственные органические соединения
в окружающей среде
В настоящее время получены сотни тысяч органических соединений, используемых для производства пластмасс, СК, растворителей и др.. Многие из них напоминают природные и могут усваиваться организмом, взаимодействуя с ферментами и фругими системами. Организм может оказаться неспособным разлагать их или включать в метаболизм другим путем, т.е. они небиодеградирующие. Следовательно, нарушают функционирование. Одними из наиболее опасных являются галогенорганические соединения. В организме нет ферментов, способных их расщепить. Эти вещества поглощаются легко, но если и выводятся, то очень медленно. Организм не способен освобождаться от них с мочей, т.к. галогенированные орг.соединения растворяются в жирах гораздо лучше, чем в воде.
Опасными являются не только искусственные соединения, но и природные органические продукты, оказавшиеся не в том месте, например, разлившаяся нефть.
Важным фактором оценки воздействия искуственных химических соединений на
окружающую среду являются их подвижность и устойчивость. Последние тесно связаны
с процессами их
превращений в биотических и абиотических условиях в окружающей среде.
Галогенорганические соединения
Галогенорганические соединения вошли в человеческую цивилизацию с 30-х годов. Старейший источник - производство бумаги, стадия отбеливания (процесс хлорирования). В этом процессе при разрушении лигнина образуются хлорфенолы.
В настоящее время источниками галогенорганических соединений являются производство консервантов древесины (полихлорфенолы и феноляты), красителей, пестицидов, гербицидов, пластмасс и др..
Представители: ДДТ, диоксины.
Название и формула. 1,1,1-трихлор-2,2-бис-(4-хлорфенил)этан. 
Синтезирован в 1874 г. австрийским химиком Омаром Цайдлером. В качестве инсектицида предложен Паулем Мюллером,обнаруживший в 1939 г. инсектицидные свойства ДДТ (получил в 1948 г. Нобелевскую премию в области медицины).
Преимущества ДДТ: не отпугивает насекомых, стоек (частично разлагается при 195 С), низкая токсичность для человека и других теплокровных (однократная доза 500-700 мг считалась безопасной, поэтому случайно отравиться практически невозможно, случаев смертельного отравления не зарегистрировано), простота производства:
Отрицательные свойства:
- появление видов насекомых, нечувствительных к воздействию ДДТ;
- накапливается в живых тканях и вызывает различные паталогии;
- остается на десятки лет в в воде, почве и организмах;
- летуч; период обращения его частиц вокруг земного шара - 3-4 недели; обнаружен даже в тех странах и материках , где не применялся.
Эти свойства ДДТ, а также появление новых инсектицидыдов - фосфорорганических - привело к тому, что к 1970 году ДДТ был запрещен.
Позднее было выяснено, что значительная часть отрицательных свойств ДДТ
обусловлена наличием в нем примесей и, в частности, полихлорбифенилов
(ПХБ)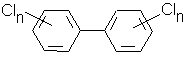
Методика анализа ДДТ определяет совместно с ним также и ПХБ. В промышленном ДДТ содержится до 30% ПХБ, безвредных для насекомых, но токсичных для людей. При этом, если чистый ДДТ распадается в растениях на 90% через месяц, то техническому препарату требуется не менее 180 лет.
возникают во всех процессах, в которых хлор, бром, или их сочетания
взаимодействуют с углеродом в кислородной среде (преимущественно при высоких
температурах и давлениях).
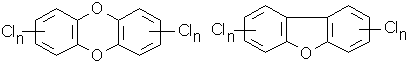
| |
(ПХДД) |
Полихлордибензофураны (ПХДФ) |
Глава диоксинового семейства:
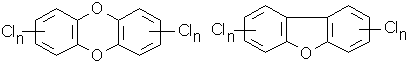
Столкнулись в 30-х годах с началом производства в США полихлорфенолов. Первое острое отравлени - авария в 1949 г.
Химически диоксины очень инертны (не разрушаются кислотами, щелочами, окислителями в некаталитических условиях). Имеют высокую адгезионную способность.
Очень токсичены. Смертельные дозы измеряются в микрограммах на кг живого веса.
Проявление поражения: хлоракне (остаточные явления до 25 лет).
Способны к биоаккумуляции. Период полувыведения -5-6 лет.
Источники диоксинов:
- отходы, содержащие хлорфенолы (особенно в щелочной среде);
- выбросы печей, сжигающих промышленные отходы;
- процессы хлорирования.
С 1880 г. добыча нефти растет по экспоненте и сейчас ее извлекают из недр
земли и донных отложений в объеме
Химически нефть представляет собой смесь различных алифатических и ароматических углеводородов с примесями различных химических элементов, в том числе, металлов.
Воздействие нефти на морские экосистемы:
Превращение нефти в водоемах.
Первоначально нефть и нефтепродукты скапливаются в поверхностной пленке.
При перемешивании образуются устойчивые эмульсии в толще воды, которые частично растворяются или оседают на дно.
Анаэробные бактерии окисляют нефтепродукты и доводят их в конечном итоге до углекислого газа и воды:
Т.е., результатом протекающих процессов является образование менее токсичных,
чем нефтепродукты, соединений. Однако эти реакции идут медленно, при
значительной концентрации кислорода и при температуре воды не ниже
Следует отметить, что бактерии разных видов селективно разрушают различные компоненты нефти. При этом н-алканы разлагаются быстрее, чем циклопарафины и ароматические углеводороды. Однако последние лучше растворяются в воде, что способствует их утилизации.