Керамические пигменты очень важны в индустрии благодаря их применению в гигиенических средствах, черепице, керамике. Они могут быть классифицированы на две большие категории: а) идиохроматические и б) аллохроматические. Идиохроматические (естественной окраски) пигменты- те, в которых переходные важная часть - ионы металлов, которые вставляются в природное лигандное поле. Хром зеленый Cr2O3 и голубой CoAl2O4 как одинаковые типичные примеры. Аллохроматические (другого цвета) пигменты могут быть дальше подразделены на две группы: а) замещения и б) пигменты типа включения. В пигментах замещения переходные или лантанидные ионы металла представлены в лигандном поле множеством решеток. Для примера, розовый цвет рубина (Cr3+/Al2O3) следствие количества хрома, присутствующего в октаэдрическом месте корундовой решетки. Пигменты включения - те, в которых цветные оксиды улавливливаются или заключаются во множество инертных оксидов и могут быть рассмотрены как твердые в твердых типах эмульсий. Хорошо известный красный цирконовый пигмент (Fe3+: ZrSiO4) красный благодаря внедрению ионов F3+ в кристалл циркона.
Важными физико-оптическими свойствами пигментов являются их легкая абсорбция и рассеяние свойств, которые зависят от валентности, размера частицы, формы частицы и показателя преломления. Поэтому для окрашенных пигментов оптимальный размер частиц должен быть 10 мкм и они должны обладать высоким показателем преломления, чтобы дать хорошую красильную прочность (способность красителя придавать цвет). Оксидные материалы подобно глинозему, алюминатам, силикатам, боратам, цирконатам и цирконам с переходными металлами или редкоземельными элементами удовлетворяют техническим условиям керамических красителей. Кобальтовые пигменты наиболее значительны в керамической индустрии благодаря их спектральному разнообразию цветов, высокой прочности окрашивания и замечательной устойчивости к химическим, термическим и восстановительным условиям.
Химия координации кобальтовых комплексов очаровывала ученых химии со времен Вернера лагодаря производимому ими спектральному диапазону цвета. Различные цвета известынх комплексов суммированы в таблицу 1. Интересно отметить, что цвет кобальтовых соединений - стереохимическая специцика, зависящая от координационного местоположения и числа. Пока октаэдрические кобальтовые смеси в общем от розового до фиолетового, тетраэдрические только голубого. Производство разных цветов кобальтовых соединений и ионов также возможно в теврдом состоянии. Цветовой диапазон от голубых, зеленых до розовых зависит от множества решеток и координационной геометрии. Приянятый метод для приготовления этих пигментов является реакцией в твердом состоянии (керамический метод) используя соответствующие соли подобных оксидов, карбонатов и т.п. Это требует высокой температуры (1000–1400oC) и долгого времени процесса (несколько часов в день). Окончательные продукты обычно грубые и неоднородные, которые непригодны для применения. Они тербуют дальнейшей обработки подобно влажному и сухому помолу, чтобы получить мелкий порошок. Добавление минерализатора часто необходимо, чтобы облегчить еакцию в жидком состоянии
| Кординационные смеси кобальта (II) | Цвет | Координационная решетка кобальт(II) |
| [Co(H2O)6]2+ | Розовый | Октаэдрическая |
| [Co(NH3)5Cl]2+ | Розовый | Октаэдрическая |
| [CoCl(H2O)5]+ | Малиново-красный | Октаэдрическая |
| Co(CH3COO)24H2O | Фиолетово-красный | Октаэдрическая |
| [Co(bipy)3]2+ | Красный | Октаэдрическая |
| CoF2 | Розовый | Октаэдрическая |
| CoCL2 | Небесно-голубой | Октаэдрическая |
| [CoCl4]2– | Голубой | Тетраэдрическая |
| [Co(NCS)4]2– | Голубой | Тетраэдрическая |
| [Co(N3)4)2- | Голубой | Тетраэрическая |
| [(C2H5O)2PS]Co(C2H5OH)2 | Голубой | Тетраэдрическая |
| [Co(CN05]3- | Темно-зеленый | Тетрагонально-пирамидальная |
Целью этих исследований является приготовление керамических пигментов на основе Co2+ из раствора методом горения. Этот метод был успешно использован для получения тонких материалов. Мы намеревались получить голубые и розовые цвета идиохроматических пигментов, таких как CoAl2O4 и Co2B2O5 с добавлением минимального количества Co2+ в Al2O3/ZnAl2O4 и Mg2B2O5, чтобы сделать процесс экономным.
Горючие окислительно-восстановительные смеси содержат металлические нитраты как окислители и карбогидразид (CH)/мочевину, как горючее для синтеза керамичсеких пигментов. Стехиометрический расчет окислительно-восстановительныых смесей должен гарантировать полное сгорание без какого-либо карбонового остатка. Водный раствор, содержащийся в стеклянном пироксном сосуде, в стехиометрическом количестве металлических нитратов и горючего, когда вводится в предварительно нагретую муфельную печь (350oC–500oC) кипит, обезвоживается, загорается и горит, производя объемистые, пенистые, однородные цветные пигменты.
Шпинель, алюминат кобальта (CoAl2O4) была получена горением водного раствора 10 г Al(NO3)3•9H2O, 3.9 г Co(NO3)2, и 4.5 г CH. Расткор, когда быстро нагрели до 350oC испытывает тление сгорая с прерывистыми искрами и пламенем (температура пламени ~ 1000oC) дает окраску пигмента индиго. Выход горючего 13% дает 2.35 г пенистого алюмината кобальта (плотность пены = 0.015 г/см3).
Кобальт содержащие алюминаты цинка Al(CoxZn1–xAl2O4, x =0.03) были подготовлены горением водного раствора, содержащего 15 г Al(NO3)3•9H2O, 0.18 г Co(NO3)2, 1.6 г Zn(NO3)2 и 8 г мочевины. Этот раствор был быстро нагрет до 500oC. Это испытывает тип пламенного горения (температура пламени ~ 1350oC) выход 4.8 г (12%) пенящегося голубого окрашенного алюмината цинка (плотность пены= 0.017 г/см3). Также голубой алюминат (содержание Co 2.5 атомн % ) был синтезирован быстрым сгоранием водного раствора, содержащего 19.5 г Al(NO3)3•9H2O, 0.2 г Co(NO3)2•6H2O и 8 г мочевины при 500oC. Раствор горел с пламенем (температура племени ~ 1500oC) выходом 10% (2.8 g) пенистого кобальт содержащего алюмината (плотность пены = 0.009 г/см3). Содержание различных атомных % Co производят различные оттенки голубого алюмината.
Пироборат кобальта Co2B2O5 был подготовлен быстрым сгоранием (около 350oC) из водного раствора, содержащего 5 г Co(NO3)26H2O, 1 г H3BO3 и 2 г CH. Раствор испытывает горение типа тления (температура пламени ~ 1000oC) дает сиренево-розовый (пурпурный) продукт. Выход горения 24% дает 1.8 г бората кобальта (плотность пены = 0.015 г/см3). Розовый кобальтовый пигмент был получен быстрым нагреванием водного раствора, содержащего 20 г Mg(NO3)2•6H2O, 1 г Co(NO3)2•6H2O, 4.8 г H3BO3 и 7.8 г CH при 350oC. Горение пламенным типом типом (температура пламени ~ 1250oC) выходом 17% (2.9 г) румяно-розового Mg2B2O5 (плотность пены = 0.015 г/см3). Во всех этих случаях система самораспространяющаяся дает нестационарное пламя высокой температуры (1000o–1500oC). Реакция происходит в течении 10с без повреждения стеклянного пирексного сосуда.
Сгорание синтезированного порошка характеризовалось рентгеновским излучением дифракционных порошков используя D-D1 рентгеновский дифрактометр с CuK излучением и никелевым фильтром. Инфракрасные спектыр были записаны, используя Brucker FTIR Multiscan 15sf II в матрице KBr. Спектры ультрафиолетового излучения образцов порошка записаны способом рассеяния отражательной способности при комнатной температуре, используя Unicam SP8-100 с MgO как эталон. Выравнивание было использовано для изменения отражательной способности от масштаба к масштабу. Плотность порошка была измерена используя пикнометр с ксилолом как жидкой среды. 50 % срднего размера агломерата было определено седиментацией и правилом рассеяния. Поверхностная область порошков была измерена адсорбцией азота, использу микрометрический инструмент (модель 2100E).
Оба аллохроматические (CoxAl2–xO3 и CoxM1–xAl2O4) и идиохроматический (CoAl2O4) голубые пигменты были подготовлены как описано выше и характериузется их цветами, рентгеновским и ультрафиолетовым спектрами. Теоретическое уравнение для образования CoAl2O4 aпредполагает полное сгорание, которое может быть записано ниже как:
Co(NO3)3+2Al(NO3)3 + 5CH6N4O= CoAl2O4+ 5CO2 + 14N2 + 15H2O.Цвет продукта индиго с пенистой структурой (рисунок 1). В подобных случаях, урачнения для образования аллохроматических пигментов CoxAl2–xO3 и CoxM1–xAl2O4 (M = Mg и Zn, x = 0.01 to 0.2) может быть отбражено ниже как:
2Al(NO3)3 + 5CH4N2O= Cox : α–Al2–xO3 + 5CO2 + 8N2 + 10H2O3Zn(NO3)2 + 6Al(NO3)3 + 20CH4N2O 3CoxZn1–xAl2O4+ 20CO2+ 32N2 + 40H2O

Все Co2+ (различные пропорции) содержащиеAl2O3/ZnAl2O4 пигменты однородного голубого цвета. Интенсивность голубого цвета постепенно увеличивается от количества содержания Co2+ варьирующего от 0.5 до 10 атомн % в алюминате, как показано на рисунке 2. Замена около 5 атомн % хорошо сочетается в CoAl2O4. Следовательно оптимальная концентрация (Co2+) требуемая для достижения идиохроматического голубого цвета между 5 и 7 атомн % в алюминате/ZnAl2O4 (рисунок 3).

b. 2.5 атомн. %; c.5 атомн. %; d. 7.5 атомн%; e. 10 атомн. %.
Пигменты синтезированные горением, все кристаллические, как отображают рентгеновские спектры от образцов. Рисунок 4 показывает дифракционный образец шпинели CoAl2O4 and Co2+, содержащийся в варьирующих пропорциях α-Al2O3 шпинельном ZnAl2O4. Рентгеновский спектр образца с 0.5 атомн % Co2+ в Al2O3 показывают единую фазу α-Al2O3. Но при замене, усиливающейся от 5 to 10 атомн %,начинают появляться дополнительные пики. От 5 атомн % и дальше начинает появляться фаза CoAl2O4, которая становится отчетливой около 10 атомн %. Для параметрической решетки различных голубых алюминатов повышенного качества с наименьшей площадью пригоден метод постепенного уменьшения в ‘a’ и ‘c’ значений по сравнению с одним незамененным. Для Co2+ замена x = 0.01 до 0.1, значение ‘a’ изеняется от 0.4772 нм до 0.4767 нм и значение ‘c’ изменяется от 1.3043 нм до 1.3013 нм. Возрастание в содержании кобальта вызывает уменьшение в константе решетки, указывая на возрастание в кристаллическом поле вокруг иона Co2+. Это могло бы также быть причиной углубления голубого цвета с возрастанием добавок кобальта вместе с увеличением образования CoAl2O4. После 7.5 атомн % изменение в параметрах решетки показывает некоторые различия. Хотя усадка параметров ‘c’ продолжается, в ‘a’ параметр удлиняется. Это кажется, что образование шпинели CoAl2O4, которое возрастает с этого времени (рисунок 4), начинает влиять на гексагональную решетку Al2O3, делая ее больше кубической (a = 0.8103 нм).
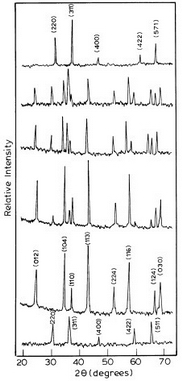
(d) 7.5 атомн %; (e) 10 атомн % of Co 2+:Al2 O3; (f) 2.5 атомн % of Co 2+: ZnAl2O4
Диффузионные спектры отражения CoAl2O4, CoxAl2–xO3 иCoxZn1–xAl2O4 показаны на рисунке 5. Элетронный спектр синтезированных голубых пигментов, содержащих алюминат кобальта, характеризуется широким абсорбционным диапазоном, центроид которого расположен в красной части видимого спектра.
Интенсивность абсорбционного спектра с выдающимися абсорбционными пиками около 550, 580 и 620 нм указывает на тетраэдрическую координацию Co2+. Энергетический уровень d-d перехода в тетраэдрическую координацию:
≤1 4A2(F)(e4t2
3) → 4T2(F)(e3t2
4)
≤1
4A2(F) → 4T1(F)(e3t2
4)
≤3
4A2(F) →4T1(P)(e2t2
5)
где ≤1 < ≤1 < ≤3.
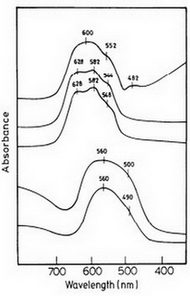
Обширный и интенсивный абсорбционный диапазон между 500 и 700 нм может быть отнесен к третьему перемещению (≤3) от 4A2(F) состояни к возбужденному состоянию 4T1(P). Превосходный спектр, который является диагностиком в тетраэдрическую координацию связывает Co2+, возникает благодаря крутящейся орбите, связывает между возбуждающим и соседним состояниями 2A1(G) и 2T2(G). Другие два перехода (≤1 и ≤2) не наблюдаются, так как они лежат в дальшем инфракрасном регионе.
4A2(F) → 2A1(G) and 2T2(G)Спектр подобен во всех трех образцах возникает благодаря присутствию кобальта в тетраэдрическом узле шпинели CoAl2O4. Решетка α-Al2O3 имеет гексагональную структуру там, где заменаCo2+ на место Al3+ невозможна из-за большого размера Co2+. Поэтому занимает промежуточное как CoAl2O4 как сообщенный ранее и очевидно для рентегновских образцов, которое показывает эту фазу шпинели. Твердый раствор, образованный там имеет тип включения. Однако, в случае матрицы ZnAl2O4 замена Co2+ на место Zn иммет место для придания цвета. Твердый раствор является типом замещения в шпинели ZnAl2O4
Так же аллохроматический (CoxMg2–xB2O5) и идиохроматический (Co2B2O5) розово-сиреневые (пурпурные) пигменты подготовлены как изложено выше и характеризутся их цветом, рентгеновским, инфракрасным и ультрафиолетовым видимым спектром. Теоретическое уравнение допустимого полного сгорания для образования Co2B2O5 и CoxMg2–xB2O5 может быть записано как:
4Co(NO3)2 + 4H3BO3 + 5CH6N2O → 2Co2B2O5 + 5CO2 + 14N2 + 21H2O4Mg(NO3)2 + 4H3BO3 + 5CH6N2O → 2(CoxMg2–xB2O5) + 5CO2 + 14N2 + 21H2O
Цвет аллохроматического CoxMg2–xB2O5 сравнивается с пурпурным цветом Co2B2O5 как показано на рисунке 6 (добавлено 5 атомн % Co). Синтезированный пигмент является аморфным на рентгеновских лучах. Кристаллчиеская фаза появлялась после спекания около 1200oC. Порошки рентгеновских образцов Co2B2O5 и CoxMg2–xB2O7 подобны Mg2B2O5 (рисунок 7). Структура пиробората магния могла быть описана как конструирование 2-D слоев для образования пироборатных групп(B2O54–). Сложный ион B2O54– образован двумя трегольниками BO33– связанными одним атомом кислорода. Связь между группами внутри и меж слоями поддерживается ионами Mg2+, которые окружены 6 атомами кислорода, формирующими деформированный октаэдр. Сильные группы в спектрах около 1200, 700 и 600 см–1 указывают существование групп BO3 в кристалической структуре пиробората.

Отражательная способность спектра пигментов Co2B2O5 иCoxMg2–xB2O7 представлена на рисунке 7. Спектр CoxMg2–xB2O7 подобен тому фиолетово-красномуCo(CH3COO)2•4H2O в которых кобальт является октаэдрическим координатором ацетатных лигандов. Октаэдрические кобальтовые смеси в общем розового цвета. Поэтому в румяно-розовом CoxMg2–xB2O7, кобальт заменен на магний в узле октаэдрической решетки пироборатной структуры. Пурпурный Co2B2O5 показывается подоюно, но более широкий электронный спектр кобальта в октаэдрическом окружении. Диапазон около 560 нм для обоих Co2B2O5 и CoxMg2–xB2O7 мог быть позволен за счет d–d перехода.
4T1g(F)(t2g5eg2) → 4T2g(P)(t2g4eg3).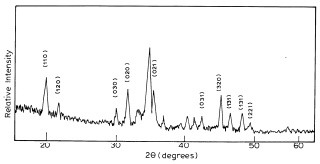
Свойства микрочастиц (видимые плотные пудры),такие как специфическая поверхностная площадь, средний размер агломерата пигментов суммируется в таблице 2. Прекрасная природа пигментов рчевидна по табличным данным. Экзотермическая реакция металлических нитратов-мочевины (> 1500oC) совершенно высока для приготовления CoAl2O4 и боратов, которые неутойчивы к 1000oC. Таким образом было необходимо использовать гидрозированное горючее, которое испытывает тление (безпламенное), горение с металлическими нитратами. Этот метод был в дальнейшем использован для синтезирования различных цветов на основе Co2+ аллохроматических и идиохроматических пигментов, как показано в таблице 3.
| Пигмент | Горючее | Температура пламениoC | Размер кристаллов (нм) | Плотность пены (г/см3) | Площадь поверхности (м2/г) | Размер частиц (мкм) | Средний размер агломерата (мкм) |
| CoAl2O4 (Индиго) |
CH | 1100 | 18 | 2.32(53) | 58 | 0.100 | 4.5 |
| CoxAl2–xO3 (голубой) |
Мочевина | 1500 | 40 | 2.75(70) | 10 | 0.220 | 4.0 |
| Co2B2O5 (Пурпурный) |
CH | 950 | - | 1.85 | 12 | 0.27 | 2.5 |
| CoxMg2–xB2O5 (Розовый) |
CH | 1350 | 15 | 2.1(72) | 8 | 0.35 | 2.2 |
| Пигмент (Crystal class) | Цвет | Координациооная кобальтовая решетка |
| Co2+:ZnB4O7 |
Фиолетовый | Тетраэдрическая |
| CoAl2O4 |
Индиго | Тетраэдрическая |
| Co2+:ZnAl2O4 |
Голубой | Тетраэдрическая |
| Co2+:Zn2SiO4 |
Лавандовый | Тетраэдрическая |
| CoCr2O4 |
Голубо-зеленый | Тетраэдрическая |
| Co2+:ZnO |
Зеленый | Тетраэдрическая |
| Co2+:Mg2B2O5 |
Румяно-розовый | Октаэдрическая |
| Co2B2O5 |
Пурпурный | Октаэдрическая |
Задачи, которые достигнуты этими исследованиями указаны ниже:
- основа Co2+голубой и розовый аллохроматические пигменты сответствуют идиохроматическому цвету пигментовCoAl2O4 и Co2B2O5 подготовлены успешно процессом твердого горения;
- оптимальное количество требуемых ионов Co2+ ,чтобы достичь определенной цветовой интенсивности идиохроматических пигментов определено (например, 5 атомн % Co2+ в Al2O3/ZnAlO4/Mg2B2O5);
- аллохроматические пигменты могут быть сделаны с использованием более дешевого горючего подобно мочевине с меньшим количеством красящих атомов, что уменьшает производственную стоимость;
- процесс горения раствора, описанный для синтезирования пигментов простой, быстрый и энергетически привлекателен. Это имеет приемущество передачи однородности, чистоты и молекулярного уровня Co2+ (красителя) в оксидную матрицу;
- так как все пигменты хороши с большой поверхностной областью, но потребность в этих пигментах для облицовки поверхности керамического тела небольшая;
- процесс является "процессом единственного шага" и может легко увеличиваться в масштабах.
Электронная библиотека |